WikiDer > Атроментин - Википедия
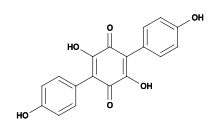 Структурная формула атроментина | |
| Имена | |
|---|---|
| Название ИЮПАК 2,5-дигидрокси-3,6-бис (4-гидроксифенил) циклогекса-2,5-диен-1,4-дион | |
| Другие имена 2,5-дигидрокси-3,6-бис (4-гидроксифенил) -1,4-бензохинон | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C18ЧАС12О6 | |
| Молярная масса | 324.288 г · моль−1 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Атроментин это природное химическое соединение, обнаруженное в Агарикомицеты грибы в заказах Agaricales и Thelephorales. Его также можно приготовить лабораторный синтез.[1] Химически это полифенол и бензохинон.
Вхождения
Атроментин был обнаружен в культурах Clitocybe subilludens[2] и в экстрактах Hydnellum peckii. Первые ферменты в его биосинтезе были охарактеризованы в Tapinella panuoides.[3] Один из них называется атроментинсинтетаза.[4]
Биологическая деятельность
Номер in vitro изучены биологические активные вещества атроментина. Атроментин обладает in vitro антибактериальная активность, ингибирование фермента редуктаза белка-носителя еноилацила (необходимо для биосинтез из жирные кислоты) в бактериях Пневмококк.[5] Атроментин оказался гладкая мышца стимулятор.[6] Это также вызывает апоптоз в изолированном человеке лейкемия Ячейки U937.[7] Это также антикоагулянт.[8]
Генетические и ферментативные основы атроментина
Атроментин катализируется двумя единицами 4-гидроксифенилпировиноградной кислоты (4-HPP) с помощью нерибосомного пептид-синтетазоподобного фермента (атроментинсинтетаза), содержащего доменную архитектуру аденилирования-тиолат-тиоэстеразы (A-T-TE). 4-HPP образуется в результате дезаминирования через аминотрансферазу. Генетическая основа этих двух генов сгруппирована (т. Е. Рядом друг с другом). Эти ферменты были впервые охарактеризованы в Tapinella panuoides за счет сверхэкспрессии соответствующих генов (AtrA и AtrD) в Кишечная палочка и инкубирование холофермента с 4-HPP для наблюдения за образованием атроментина.[3] Затем была проведена характеристика фермента GreA в Suillus grevillei,[9] шесть (InvA1-6, из которых InvA1, 2 и 5 работали) в Paxillus invutus,[10] и NPS3 из Serpula lacrymans.[11][12] Кроме того, существует еще один соседний и консервативный ген, кодирующий алкогольдегидрогеназу / оксидоредуктазу, функция которого неясна. В большинстве случаев кластерные гены биосинтеза оказываются ортологичными у базидиомицетов. Был обнаружен общий промоторный мотив атроментинсинтетазы и аминотрансферазы 23 различных базидиомицетов, продуцирующих атроментин, который почти во всех случаях отсутствовал у алкогольдегидрогеназы, что указывает на совместную регуляцию двух основных генов, которые обеспечивают продукцию атроментина общим фактором транскрипции. .[11][13] Дополнительные промоторные мотивы были идентифицированы перед генами атроментина для эктомикорихзы, которые отсутствовали у коричневых гнилей, что указывает на несходную генетическую регуляцию атроментина.[13] Гены атроментинсинтетазы и аминотрансферазы из S. lacrymans были активированы во время совместной инкубации с бактериями.[13]
Аминокислотный нерибосомный код для биосинтеза
Нерибосомный фермент, подобный пептид-синтетазе (атроментинсинтетаза), который симметрично конденсирует два мономера 4-HPP, имеет домен аденилирования, который принимает субстраты до катализа. Акцепторный домен содержит код из 10 аминокислот, известный как Нерибосомный код (Код NRPS). Вот пример синтетазы атроментин из Suills Grevillei, GreA, используется. Код находится в положениях аминокислот 235 (V), 236 (A), 239 (E), 278 (F), 299 (S), 301 (G), 322 (G), 320 (A), 331 ( С), 517 (К).[9] Код соответствует синтетазам атроментина из S. lacrymans (NPS3), Tapinella panuoides (AtrA) и Paxillus invutus (ИнвА). Аналогичным образом, код NRPS для продукции атроментина поддерживает универсальный код для других соединений, производных от ароматических альфа-кетокислот, таких как L-фенилаланин, подобный ральфуранону B, через фенилпировиноградную кислоту и из L-триптофан, как дидеметиластеррихинон D через индол-3-пировиноградная кислота (обратите внимание, что атроментин является производным от ароматической альфа-кетокислоты L-тирозина через 4-гидроксифенилпировиноградную кислоту).
Для InvAs от Paxillus invutus, общий аминокислотный мотив был также обнаружен в домене тиоэстеразы (последний домен), который подтвердил биохимические данные о том, является ли фермент функциональным для завершения образования атроментина или нет.[10]
Биосинтез атроментина
Ароматическая аминокислота L-тирозин является предшественником 4-гидроксифенилпировиноградной кислоты, и 2 единицы 4-HPP конденсируются с образованием атроментина. Первым шагом является дезаминирование с помощью аминотрансферазы. Вторая стадия катализируется нерибосомным ферментом, подобным пептид-синтетазе (NRPS-подобным, потому что у него нет канонического домена конденсации, называемого атроментин / хинон-синтетазой). Домен аденилирования этого NRPS-подобного фермента принимает 4-HPP, как определено анализом обмена ATP-PPi. Фермент, когда он производится в Кишечная палочка, необходимо примировать к своей холо-форме с помощью фосфопантетеинилтрансферазы (Ppant), хотя E. coli может in vivo примировать апо-фермент (например, через EntD). Ppants успешно использовались из кДНК, полученной из А. нидуланс (например, NpgA), Streptomyces verticillus (Svp) и Paxillus invutus (PptA). Несколько исследований, особенно на бактериях Burkholderia thailandensis Biggins et al. показали, что ген аминотрансферазы может отсутствовать, и эта активность может обеспечиваться посредством его первичного метаболизма.
Конгенерные пигменты
Атроментин является предшественником различных других пигментов. Семейство типов пульвиновой кислоты включает пестрая кислота, ксеромоновая кислота, гомоксеромоновая кислота, изоксеромоновая кислота, атроменовая кислота, пестрый рубин, ксерокоморубин, и другие модифицированные производные. Было обнаружено, что основные пигменты типа пульвиновой кислоты секретируются во время совместной инкубации с бактериями или введения до высокого содержания органического азота (по сравнению с ростом на неиндуцирующей среде, содержащей неорганический азот). Диарилциклопентеноны включают инволютин, инволютон, гироциканин, гиропорин (окисленный вариант гироцианина), ангидроинволутин и хамониксин. Гревиллины (A-D) структурно похожи, но являются производными 4-HPP, предшественника атроментина. Гревиллины являются хемотаксономическим маркером для рода Suillus. Модификации атроментина включают лейкоатроментин, лейкоментин-3, лейкоментин-4 и цикколейкомелон. Кроме того, телефорная кислота является производным клады телефороидов. Неизвестны различные ферменты, участвующие в образовании этих пигментов, помимо генетической и ферментативной основы производства его предшественника атроментина.
Избыточный биосинтез
В Paxillus invutusв аннотированном геноме, доступном через портал JGI MycoCosm, было идентифицировано шесть нерибосомных ферментов, подобных пептид-синтетазе. Эти гены, обозначенные как InvA1,2,3,4,5 и 6, были сверхэкспрессированы в Кишечная палочка и гены были охарактеризованы совместной инкубацией апо-фермента с 4-HPP для определения образования атроментина, как было отмечено его характеристическим спектром в УФ-видимом диапазоне и моноизотопной массой. Было обнаружено, что три из шести ферментов функционируют. Это показало беспрецедентную избыточность продукции атроментина в базидиомицете.[10]
Рекомендации
- ^ Ye, Y. Q .; Кошино, Н .; Abe, N .; Накамура, Т .; Hashizume, D .; Такахаши, С. (2010). «Синтез атроментина и его О-алкилированных природных продуктов». Биология, биотехнология и биохимия. 74 (11): 2342–2344. Дои:10.1271 / bbb.100451. PMID 21071857.
- ^ Sullivan, G .; Garrett, R.D .; Ленехан, Р.Ф. (1971). «Встречаемость атроментина и телефорной кислоты в культурах clitocybe subilludens». Журнал фармацевтических наук. 60 (11): 1727–1729. Дои:10.1002 / jps.2600601134. PMID 4332377.
- ^ а б Schneider, P .; Bouhired, S .; Хоффмайстер, Д. (2008). «Характеристика генов и ферментов биосинтеза атроментина у гомобазидиомицетов. Tapinella panuoides". Грибковая генетика и биология. 45 (11): 1487–1496. Дои:10.1016 / j.fgb.2008.08.009. PMID 18805498.
- ^ Атроментин синтетаза на www.uniprot.org
- ^ Чжэн CJ, Сон MJ, Ким WG (2006). «Атроментин и лейкомелон, первые ингибиторы, специфичные для еноил-ACP редуктазы (FabK), Пневмококк". Журнал антибиотиков. 59 (12): 808–12. Дои:10.1038 / ja.2006.108. PMID 17323650.
- ^ Sullivan, G .; Угадай, У. Л. (1969). «Атроментин: стимулятор гладкой мускулатуры Clitocybe subilludens». Ллойдия. 32 (1): 72–75. PMID 5815216.
- ^ Индуцированный атроментином апоптоз в клетках лейкемии человека U937. Ким Джин Хи и Чунг Хван Ли, Журнал микробиологии и биотехнологии, 2009, т. 19, №9, страницы 946-950, ИНИСТ:21945937
- ^ Ханна Дж. М., Мэлоун М. Х., Эйлер К. Л., Брэди Л. Р. (1965). «Атроментин - антикоагулянт от Hydnellum diabolus". Журнал фармацевтических наук. 54 (7): 1016–20. Дои:10.1002 / jps.2600540714. PMID 5862512.
- ^ а б Wackler, Барбара; Лакнер, Джеральд; Chooi, Yit Heng; Хоффмайстер, Дирк (2012). «Характеристики хинон-синтетазы GreA Suillus grevillei подтверждают нерибосомный код ароматических α-кетокислот». ChemBioChem. 13 (12): 1798–804. Дои:10.1002 / cbic.201200187. PMID 22730234.
- ^ а б c Брезель, Яна; Гётце, Себастьян; Шах, Фироз; Гейне, Даниэль; Таубер, Джеймс; Хертвек, Кристиан; Тунлид, Андерс; Сталлфорт, Пьер; Хоффмайстер, Дирк (2015). «Три избыточных синтетаза обеспечивают производство окислительно-восстановительного пигмента в базидиомицете Paxillus invutus». Химия и биология. 22 (10): 1325. Дои:10.1016 / j.chembiol.2015.08.016. PMID 26496685.
- ^ а б Таубер, Джеймс П.; Schroeckh, Volker; Шелест, Екатерина; Бракэдж, Аксель А; Хоффмайстер, Дирк (2016). «Бактерии вызывают образование пигмента в базидиомицете Serpula lacrymans». Экологическая микробиология. 18 (12): 5218–5227. Дои:10.1111/1462-2920.13558. PMID 27699944.
- ^ Иствуд, Д. С.; Floudas, D; Связующее, М; Majcherczyk, A; Schneider, P; Aerts, A; Asiegbu, F. O; Baker, S.E; Барри, К; Бендиксби, М; Blumentritt, M; Коутиньо, П. М.; Каллен, Д.; De Vries, R.P; Гатман, А; Goodell, B; Henrissat, B; Ихрмарк, К; Каузеруд, H; Колер, А; Лабутти, К; Лапидус, А; Lavin, J. L; Ли, Й.-Н; Линдквист, Э; Лилли, Вт; Лукас, S; Morin, E; Мурат, К; и другие. (2011). «Машины, разрушающие стенки клеток растений, лежат в основе функционального разнообразия лесных грибов». Наука. 333 (6043): 762–5. Bibcode:2011Научный ... 333..762E. Дои:10.1126 / science.1205411. PMID 21764756.
- ^ а б c Таубер, Джеймс П .; Гальегос-Монтерроса, Рамзес; Ковач, Акош Т .; Шелест, Екатерина; Хоффмайстер, Дирк (2018). «Регулирование разнородных пигментов у Serpula lacrymans и Paxillus incurlutus во время взаимодействий между царствами» (PDF). Микробиология. 164 (1): 65–77. Дои:10.1099 / микрофон. 0.000582. PMID 29205129.