WikiDer > Циклизация Бергмана
| Циклизация Бергмана | |
|---|---|
| Названный в честь | Роберт Джордж Бергман |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | бергман-циклизация |
| RSC ID онтологии | RXNO: 0000240 |
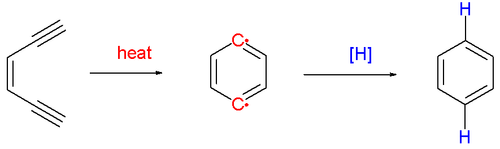
В Циклизация Бергмана или же Реакция Бергмана или же Циклоароматизация Бергмана является органическая реакция и более конкретно реакция перегруппировки происходит, когда Enediyne нагревается в присутствии подходящего донора водорода (Схема 1).[1] Это самый известный и хорошо изученный представитель общего класса циклоароматизация реакции.[2] Назван в честь американского химика. Роберт Г. Бергман (р. 1942 г.). Продукт реакции является производным от бензол.
Реакция протекает термической реакцией или пиролиз (выше 200 ° C), образуя короткоживущий и очень реактивный пара-бензин бирадикал разновидность. Он будет реагировать с любым донором водорода, таким как 1,4-циклогексадиен который превращается в бензол. Когда гасится тетрахлорметан продукт реакции представляет собой 1,4-дихлорбензол и с метанол продукт реакции бензиловый спирт.
Когда Enyne фрагмент включен в 10-членное углеводородное кольцо (например, циклодека-3-ен-1,5-диин в схема 2) реакция, пользуясь повышенной напряжение кольца в реагенте возможно при гораздо более низкой температуре 37 ° C.
Встречающиеся в природе соединения, такие как калихеамицин содержат такое же 10-членное кольцо и оказываются цитотоксический. Эти соединения образуют описанный выше бирадикальный промежуточный продукт, который может вызывать одно- и двухцепочечные ДНК порезы. Есть роман наркотики которые пытаются использовать это свойство, в том числе моноклональные антитела Такие как милотарг.[3]
А бирадикал предложен также механизм образования определенных биомолекулы найдено в морском споролиды которые имеют хлорбензольное звено как часть своей структуры. По этому механизму галоген обеспечивает галогенидная соль. Модельная реакция с ендиеном циклодека-1,5-диин-3-ен, бромид лития как источник галогена и уксусная кислота как источник водорода в ДМСО при 37 ° C подтверждает теорию:[4][5]
Реакция оказывается первый заказ в ендиин с образованием п-бензина А как ограничивающий шаг. Затем галогенид-ион отдает свои два электрона при образовании новой связи Br-C, и считается, что вовлеченный электрон-радикал перемещается по временной связи C1-C4, образуя анион средний B. Анион - мощное основание, отщепляющее протоны даже от ДМСО до конечного продукта. Дибромид или дигидроген (тетралин) никогда не образуются.
В 2015 году ученые IBM продемонстрировали, что обратимая циклизация диина по Бергману может быть вызвана кончиком атомно-силовой микроскоп (АСМ). Они также записали изображения отдельных молекул диина во время этого процесса.[6] Узнав об этой прямой экспериментальной демонстрации, Бергман прокомментировал: «Когда мы впервые сообщили об этой реакции, я понятия не имел, что она будет иметь биологическое значение или что реакция когда-нибудь может быть визуализирована на молекулярном уровне.[7]
Рекомендации
- ^ Ричард Р. Джонс; Роберт Г. Бергман (1972). «п-Бензин. Образование в качестве промежуточного продукта в реакции термической изомеризации и улавливание свидетельств 1,4-бензолдиильной структуры». Варенье. Chem. Soc. 94 (2): 660–661. Дои:10.1021 / ja00757a071.
- ^ Р. К. Мохамед, П. В. Петерсон и И. В. Алабугин; Петерсон; Алабугиным (2013). «Согласованные реакции, которые производят дирадикалы и цвиттерионы: электронный, стерический, конформационный и кинетический контроль процессов циклоароматизации». Chem. Rev. 113 (9): 7089–7129. Дои:10.1021 / cr4000682. PMID 23600723.
- ^ Лука Банфи; Андреа Бассо; Джузеппе Гуанти и Рената Рива (2006). «Дизайн и синтез гетероцикл-конденсированных пролекарств ендиина, активируемых по желанию» (PDF). Аркивок. HL-1786GR: 261–275.[постоянная мертвая ссылка]
- ^ Чарльз Л. Перрен; Бетси Л. Роджерс и Джозеф М. О'Коннор (2007). «Нуклеофильное добавление к п-бензину, полученному из эндиина: новый механизм включения галогенидов в биомолекулы». Варенье. Chem. Soc. 129 (15): 4795–9. Дои:10.1021 / ja070023e. PMID 17378569.
- ^ Стю Борман (2007). «Новый путь добавления галогенидов». Новости химии и машиностроения.
- ^ Шулер, Бруно; Фатайер, Шади; Мон, Фабиан; Молл, Николай; Павличек, Нико; Мейер, Герхард; Пенья, Диего; Гросс, Лев (25 января 2016 г.). «Обратимая циклизация Бергмана путем атомной манипуляции». Химия природы. 8 (3): 220–4. Bibcode:2016НатЧ ... 8..220С. Дои:10.1038 / nchem.2438. PMID 26892552. S2CID 21611919.
- ^ Шакка, Крис (25 января 2016 г.). «30 лет атомно-силовой микроскопии: ученые IBM запускают и наблюдают реакции в отдельной молекуле». Получено 25 января 2016.
внешняя ссылка
| Викискладе есть медиафайлы по теме Циклизация Бергмана. |
- Циклоароматизация Бергмана Силовая установка Уитни М. Эрвин 2002