WikiDer > Бластуляция
| Blastula | |
|---|---|
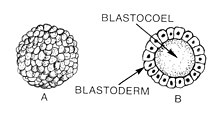
 Бластуляция: 1 - морула, 2 - бластула. | |
| Подробности | |
| Дней | 4 |
| Предшественник | Морула |
| Дает начало | Гаструла |
| Идентификаторы | |
| MeSH | D036703 |
| Анатомическая терминология | |
Бластуляция это стадия в раннем животном эмбриональное развитие что производит бластула.[1] Бластула (от греч. βλαστός (бласты смысл росток) является полой сферой из клетки (бластомеры), окружающие внутреннюю полость, заполненную жидкостью ( бластоцель).[1][2] Эмбриональное развитие начинается с сперма удобрение яйцеклетка стать зигота, который претерпевает множество расщепления превратиться в клубок клеток, называемый морула. Только когда формируется бластоцель, ранний эмбрион становится бластулой. Бластула предшествует формированию гаструла в которой ростковые отростки эмбриональной формы.[3]
Общая черта позвоночное животное бластула состоит в том, что она состоит из слоя бластомеров, известных как бластодерма, который окружает бластоцель.[4][5] В млекопитающие, бластула называется бластоциста. Бластоциста содержит эмбриобласт (или внутренняя клеточная масса), которые в конечном итоге приведут к определенным структурам плод, а трофобласт который продолжает формировать внеэмбриональные ткани.[3][6]
Во время бластуляции в раннем эмбрионе происходит значительная активность, чтобы установить полярность ячейки, спецификация ячейки, формирование оси, и регулировать экспрессия гена.[7] У многих животных, таких как Дрозофила и Xenopus, то средний переход бластулы (MBT) - важный шаг в развитии, во время которого материнская мРНК деградирует, и контроль над развитием передается эмбриону.[8] Многие взаимодействия между бластомерами зависят от кадгерин выражение, особенно E-кадгерин у млекопитающих и EP-кадгерин в амфибии.[7]
Изучение бластулы и спецификации клеток имеет большое значение в стволовая клетка исследования и вспомогательные репродуктивные технологии.[6] В Xenopus, бластомеры ведут себя как плюрипотентный стволовые клетки, которые могут мигрировать несколькими путями, в зависимости от клеточная сигнализация.[9] Манипулируя клеточными сигналами на стадии развития бластулы, различные ткани может быть сформирован. Этот потенциал может способствовать регенеративная медицина для случаев заболеваний и травм. Экстракорпоральное оплодотворение предполагает имплантацию бластулы в матку матери.[10] Имплантация клеток бластулы может помочь устранить бесплодие.
Разработка
Стадия бластулы раннего развития эмбриона начинается с появления бластоцеля. Происхождение бластоцеля в Xenopus было показано, что это с первого борозда декольте, который расширен и уплотнен узкие стыки для создания полости.[11]
У многих организмов развитие эмбриона до этого момента и на ранней стадии стадии бластулы контролируется материнской мРНК, названной так потому, что она продуцировалась в яйцеклетке до оплодотворения и поэтому происходит исключительно от матери.[12][13]
Переход средней бластулы
У многих организмов, включая Xenopus и Дрозофила, то переход средней бластулы обычно происходит после определенного числа клеточных делений для данного вида и определяется окончанием синхронных циклов клеточного деления раннего развития бластулы и удлинением клеточные циклы путем добавления G1 и Фазы G2. До этого перехода расщепление происходит только в фазах синтеза и митоза клеточного цикла.[13] Добавление двух фаз роста в клеточный цикл позволяет клеткам увеличиваться в размере, поскольку до этого момента бластомеры подвергаются редуктивным делениям, при которых общий размер эмбриона не увеличивается, но создается больше клеток. С этого перехода начинается рост организма в размерах.[3]
Переход средней бластулы также характеризуется заметным увеличением транскрипция новой, нематериальной мРНК, транскрибируемой из генома организма. На этом этапе большие количества материнской мРНК разрушаются белками, такими как SMAUG в Дрозофила[14] или по микроРНК.[15] Эти два процесса перекладывают контроль над эмбрионом с материнской мРНК на ядра.
Структура
Бластула - это сфера из клеток, окружающая бластоцель. Бластоцель - это заполненная жидкостью полость, в которой аминокислоты, белки, факторы роста, сахара, ионы и другие компоненты, необходимые для клеточная дифференциация. Бластоцель также позволяет бластомерам двигаться во время процесса гаструляция.[16]
В Xenopus У эмбрионов бластула состоит из трех различных областей. Шляпка животного образует крышу бластоцеля и в первую очередь формирует эктодермальный производные. Экваториальная или краевая зона, составляющая стенки бластоцеля, в первую очередь различается на мезодермальный ткань. Растительная масса состоит из пола бластоцеля и в основном развивается в энтодермальный ткань.[7]
В бластоцисте млекопитающих (термин для обозначения бластулы млекопитающих) существует три линии, которые дают начало более позднему развитию тканей. В эпибласт дает начало самому плоду, в то время как трофобласт развивается в часть плацента и примитивная энтодерма становится желточный мешок.[6]
У эмбрионов мыши образование бластоцелей начинается на стадии 32 клеток. Во время этого процесса вода попадает в эмбрион, чему способствует осмотический градиент, который является результатом Na+/ К+ АТФазы которые производят высокий Na+ градиент на базолатеральной стороне трофэктодермы. Этому движению воды способствует аквапорины. Герметичность создается за счет плотных стыков эпителиальные клетки это линия бластоцеля.[6]
Клеточная адгезия
Плотные соединения очень важны в развитии эмбриона. В бластуле эти опосредованные кадгерином клеточные взаимодействия необходимы для развития эпителия, что является наиболее важным для парацеллюлярный транспорт, поддержание полярности клеток и создание уплотнения проницаемости для регулирования образования бластоцелей. Эти плотные контакты возникают после того, как полярность эпителиальных клеток устанавливается, что закладывает основу для дальнейшего развития и спецификации. Внутри бластулы внутренние бластомеры обычно неполярны, в то время как эпителиальные клетки демонстрируют полярность.[16]
Эмбрионы млекопитающих подвергаются уплотнению на стадии 8 клеток, где E-кадгерины а также альфа и бета катенины выражены. В результате этого процесса образуется клубок эмбриональных клеток, способных к взаимодействию, а не группа диффузных и недифференцированных клеток. Адгезия E-кадгерина определяет апико-базальная ось в развивающемся эмбрионе и превращает эмбрион из нечеткого шара в более поляризованный фенотип который закладывает основу для дальнейшего развития в полностью сформированную бластоцисту.[16]
Xenopus полярность мембраны устанавливается при первом отщеплении клетки. EP-кадгерин амфибий и XB / U-кадгерин выполняют у млекопитающих ту же роль, что и E-кадгерин, устанавливая полярность бластомеров и укрепляя межклеточные взаимодействия, которые имеют решающее значение для дальнейшего развития.[16]
Клинические последствия
Технологии удобрения
Эксперименты с имплантацией на мышах показывают, что гормональная индукция, суперовуляция и искусственное оплодотворение успешно производят преимплантационные мышиные эмбрионы. У мышей девяносто процентов самок были вынуждены механической стимуляцией забеременеть и имплантировать по крайней мере один эмбрион.[17] Эти результаты оказываются обнадеживающими, поскольку они обеспечивают основу для возможной имплантации другим видам млекопитающих, например, людям.
Стволовые клетки
Клетки на стадии бластулы могут вести себя как плюрипотентные стволовые клетки у многих видов. Плюрипотентные стволовые клетки являются отправной точкой для производства органоспецифических клеток, которые потенциально могут помочь в восстановлении и предотвращении повреждений и дегенерации. Комбинируя выражение факторы транскрипции а расположение клеток бластулы может привести к развитию индуцированных функциональных органов и тканей. Плюрипотентный Xenopus клетки, при использовании в стратегии in vivo, смогли превратиться в функциональные сетчатка. Пересадив их в глазное поле на нервная пластинкаи, вызывая несколько неправильных выражений факторов транскрипции, клетки были связаны с сетчаткой и могли управлять поведением, основанным на зрении, в Xenopus.[18]
Также см
Рекомендации
- ^ а б «Бластуляция». www.web-books.com.
- ^ «Бластула». Британская энциклопедия. 2013.
- ^ а б c Гилберт, Скотт (2010). Биология развития 9-е изд. + Devbio Labortatory Vade Mecum3. Sinauer Associates Inc., стр. 243–247, 161. ISBN 978-0-87893-558-1.[постоянная мертвая ссылка]
- ^ Ломбарди, Джулиан (1998). «Эмбриогенез». Сравнительное воспроизводство позвоночных. Springer. п. 226. ISBN 978-0-7923-8336-9.
- ^ Форгач и Ньюман, 2005: п. 27
- ^ а б c d Кокберн, Кэти; Россант, Джанет (1 апреля 2010 г.). «Изготовление бластоцисты: уроки мышки». Журнал клинических исследований. 120 (4): 995–1003. Дои:10.1172 / JCI41229. ЧВК 2846056. PMID 20364097.
- ^ а б c Хисман, Дж (ноябрь 1997 г.). "Моделирование Xenopus бластула ". Разработка. 124 (21): 4179–91. PMID 9334267.
- ^ Тадрос, Ваэль; Липшиц, Ховард Д. (1 марта 2004 г.). «Создание условий для развития: трансляция и стабильность мРНК во время созревания ооцитов и активации яиц в Дрозофила". Динамика развития. 232 (3): 593–608. Дои:10.1002 / dvdy.20297. PMID 15704150.
- ^ Гурдон, Джон Б .; Стендли, Генриетта Дж. (Декабрь 2002 г.). "Незавершенный Xenopus клетки бластулы могут быть направлены на равномерную экспрессию мышечных генов с помощью градиентной интерпретации и эффекта сообщества ". Международный журнал биологии развития (Кембридж, Великобритания). 46 (8): 993–8. PMID 12533022.
- ^ Тот, Аттила. «Лечение: устранение причин бесплодия у мужчин и женщин». Лаборатория Маклеода. Получено 22 марта 2013.
- ^ Kalt, MR (август 1971). "Взаимосвязь между расщеплением и образованием бластоцелей в Xenopus laevis. I. Световые микроскопические наблюдения ». Журнал эмбриологии и экспериментальной морфологии. 26 (1): 37–49. PMID 5565077.
- ^ Тадрос, Вт; Липшиц, HD (март 2005 г.). «Создание условий для развития: трансляция и стабильность мРНК во время созревания ооцитов и активации яиц в Дрозофила". Динамика развития. 232 (3): 593–608. Дои:10.1002 / dvdy.20297. PMID 15704150.
- ^ а б Эткин, Л.Д. (1988). «Регуляция перехода средней бластулы у амфибий». Биология развития. 5: 209–25. Дои:10.1007/978-1-4615-6817-9_7. PMID 3077975.
- ^ Тадрос, Вт; Вествуд, JT; Липшиц, HD (июнь 2007 г.). «Переход от матери к ребенку». Клетка развития. 12 (6): 847–9. Дои:10.1016 / j.devcel.2007.05.009. PMID 17543857.
- ^ Вайгель, Д; Изаурральде, Э (24 марта 2006 г.). «Крошечный помощник облегчает материнский груз». Клетка. 124 (6): 1117–8. Дои:10.1016 / j.cell.2006.03.005. PMID 16564001.
- ^ а б c d Флеминг, Том П .; Папенброк, Том; Фесенко, Ирина; Хаузен, Питер; Шет, Бхавванти (1 августа 2000 г.). «Сборка плотных контактов во время раннего развития позвоночных». Семинары по клеточной биологии и биологии развития. 11 (4): 291–299. Дои:10.1006 / scdb.2000.0179. PMID 10966863.
- ^ Уотсон, Дж. (Октябрь 1977 г.). «Сбор и перенос доимплантационных эмбрионов мыши». Биология размножения. 17 (3): 453–8. Дои:10.1095 / биолрепрод17.3.453. PMID 901897.
- ^ Viczian, Andrea S .; Solessio, Eduardo C .; Лю, Юнг; Зубер, Майкл Э (август 2009 г.). «Создание функциональных глаз из плюрипотентных клеток». PLoS Биология. 7 (8): e1000174. Дои:10.1371 / journal.pbio.1000174. ЧВК 2716519. PMID 19688031.
Библиография
- Форгач, Г. и Ньюман, Стюарт А. (2005). «Дробление и образование бластулы». Биологическая физика развивающегося эмбриона. Издательство Кембриджского университета. ISBN 978-0-521-78337-8.
- Каллен, К. (2009). «Эмбриология и раннее развитие животных». Энциклопедия наук о жизни, Том 2. Информационная база. ISBN 978-0-8160-7008-4.
- Макгиди, Томас А., изд. (2006). «Гаструляция». Ветеринарная эмбриология. Вили-Блэквелл. ISBN 978-1-4051-1147-8.