WikiDer > Вирус мозаики цветной капусты
| Вирус мозаики цветной капусты | |
|---|---|
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Царство: | Рибовирия |
| Королевство: | Парарнавиры |
| Тип: | Artverviricota |
| Класс: | Revtraviricetes |
| Порядок: | Ортервиралес |
| Семья: | Caulimoviridae |
| Род: | Каулимовирус |
| Виды: | Вирус мозаики цветной капусты |
Вирус мозаики цветной капусты (CaMV) является членом рода Каулимовирус, один из шести родов в семье Caulimoviridae, которые параретровирусы это заразить растения.[1] Параретровирусы размножаются через обратная транскрипция как ретровирусы, но вирусные частицы содержат ДНК вместо РНК.[2]
Определение
Вирус мозаики цветной капусты (CaMV) - типовой вид семейства Caulimoviridae. Это семейство сгруппировано вместе с Гепаднавирусы в Параретровирус группа из-за ее режима репликации через обратная транскрипция прегеномного промежуточного звена РНК.
CaMV поражает в основном растения семейства Brassicaceae (например, цветная капуста и репа), но некоторые штаммы CaMV (D4 и W260) также способны инфицировать Пасленовые виды родов Дурман и Никотиана. CaMV вызывает множество системных симптомов, таких как мозаика, некротические поражения на поверхности листьев, задержка роста и деформация общей структуры растения. Проявленные симптомы различаются в зависимости от штамма вируса, экотипа хозяина и условий окружающей среды.[3]
CaMV передается без кровообращения такими видами тлей, как Myzus persicae.[4] После введения в клетку растения-хозяина, вирионы перейти на ядерная оболочка растительной клетки.
Структура
Частица CaMV представляет собой икосаэдр диаметром 52 нм, состоящий из 420 субъединиц капсидного белка (CP), расположенных с триангуляцией T = 7, которая окружает заполненную растворителем центральную полость.[5][6]
CaMV содержит кольцевую двухцепочечную молекулу ДНК размером около 8,0 тыс. Пар оснований, прерванную порезами, которые возникают в результате действия РНКазы H во время обратной транскрипции. Эти зарубки происходят от Met-тРНК и двух праймеров РНК, используемых в обратной транскрипции. После входящий В клетке-хозяине эти одноцепочечные «щели» в вирусной ДНК восстанавливаются, образуя сверхспиральную молекулу, которая связывается с гистонами. Эта ДНК транскрибируется в полную длину, Терминально избыточный, 35S РНК и субгеномная 19S РНК.
Геном
В промоутер 35S РНК является очень сильным конститутивным промотором, ответственным за транскрипцию всего генома CaMV. Он хорошо известен своим использованием в трансформация растений. Это вызывает высокий уровень экспрессии генов у двудольных растений. Однако на однодольных, особенно на злаках, он менее эффективен. Различия в поведении, вероятно, связаны с различиями в качестве и / или количестве регулирующих факторов. Недавнее исследование показало, что промотор 35S CaMV также функционирует в некоторых клетках животных, хотя используемые промоторные элементы отличаются от таковых в растениях. Хотя этот промотор имел низкую активность по сравнению с каноническими промоторами животных, уровни репортерных продуктов были значительными. Это наблюдение предполагает, что промотор 35S может иметь потенциал для использования у животных.[7]
Промотор был назван промотором 35S CaMV («промотор 35S»), поскольку коэффициент седиментации вирусного транскрипта, экспрессия которого естественным образом обеспечивается этим промотором, составляет 35S. Это один из наиболее широко используемых конститутивных промоторов общего назначения. Он был открыт в начале 1980-х годов Чуа и его сотрудниками из The Рокфеллеровский университет.
35S РНК особенно сложна, она содержит высокоструктурированную лидерную последовательность длиной 600 нуклеотидов с 6-8 короткими открытые рамки для чтения (ORF).[8][9][10]
За этим лидером следуют семь плотно расположенных длинных ORF, которые кодируют все вирусные белки. Механизм экспрессии этих белков уникален тем, что белок ORF VI (кодируемый 19S РНК) контролирует повторную инициацию трансляции основных открытых рамок считывания на полицистронной 35S РНК, процесс, который обычно происходит только на бактериальных мРНК. Функция TAV зависит от ее связи с полисомы и эукариотический фактор инициации eIF3.[11]
- ORF1 - белок движения (P03545)
- ORF2 - Коэффициент передачи тлей / насекомых (P03548)
- ORF3 - белок, связанный с вирионом (VAP, P03551). Структурный белок, возможности связывания ДНК
- ORF4 - белок капсида (CP, P03542)
- ORF5 - pro-pol (P03554): Протеаза, бифункциональная обратная транскриптаза и РНКаза H
- ORF6 - Трансактиватор / вироплазмин (P03559): Формирование инклюзивного тела / торговля людьми; Возможно больше функций (см. Ниже)
- ORF7 / 8 - Неизвестно (не требуется для заражения, Q83163, Q83164)
- Содержит тРНК-Монтировать сайт привязки
В дополнение к своим функциям, касающимся активации трансляции и образования телец включения, было показано, что P6 взаимодействует с рядом других белков CaMV, таких как P2 и P3, что позволяет предположить, что он также может в некоторой степени способствовать сборке вирусов и опосредованному тлей коробка передач. Кроме того, было показано, что P6 связывается с P7; исследование взаимодействий между ними может помочь выяснить пока неизвестную функцию P7.[12]
Другая функция P6 включает модификацию хозяина, НЕ ЭКСПРЕССОР ПАТОГЕНЕЗА, СВЯЗАННОГО 1 (NPR1) в процессе заражения. NPR1 - важный регулятор салициловая кислота (SA) и жасмоновая кислота (JA) -зависимая передача сигналов и наиболее тесно связана с перекрестными помехами между ними. Модификация NPR1 служит для ингибирования защитных ответов растительных клеток путем предотвращения SA-зависимой передачи сигналов; модифицированный NPR1 может правильно перемещаться в ядро и связываться с промотором PR-1, но неспособен инициировать транскрипцию. Поскольку для накопления SA требуется активный NPR1, это приводит к дальнейшему истощению SA. В то время как регуляция SA-зависимой передачи сигналов с помощью P6-модифицированного NPR1 локализована в ядре, регуляция JA-зависимой передачи сигналов является цитоплазматической по своей природе и включает путь COI1. В отличие от SA, JA-зависимая передача сигналов увеличивается в присутствии модифицированного NPR1.[13]
Репликация
CaMV реплицируется путем обратной транскрипции:
- Вирусные частицы попадают в растительную клетку и некапсидируются. На этом этапе вирусная ДНК состоит из трех фрагментов, один на - цепи (α) и два на + цепи (β и γ), которые несовершенно собраны в кольцевой геном с тремя пробелами или разрывами (D1, D2 и D3). ).
- Вирусная ДНК попадает в ядро где несплошности заполнены. На этом этапе вирусная ДНК также ассоциируется с хозяином гистоны, образуя минихромосому (не показано).
- Гостья ДНК-зависимая РНК-полимераза транскрибируется с промотора 35S по всему вирусному геному, превосходя промотор 35S. (Это создает две копии промотора 35S в полученной РНК.) Транскрипция также инициируется на промоторе 19S (не показан).
- Вирусные РНК переходят в хозяина цитоплазма где они расшифрованы.
- 3'-конец тРНКfMet отжигается на сайте, соответствующем разрыву 1 (D1) около 5'-конца 35S РНК.
- ТРНКfMet синтез праймов с помощью вирусной обратной транскриптазы (кодируемой ORF V) новой α-цепи.
- РНКаза H удаляет РНК из дуплекса ДНК-РНК, оставляя ДНК.
- Эта новая ДНК связывает промотор 35S на 3'-конце матрицы РНК, и синтез α-цепи ДНК продолжается, а РНКаза H продолжает разлагать РНК в комплексе с ДНК.
- Синтез α-цепи завершен. Активность РНКазы H раскрывает богатые пурином участки в позиции разрыва 3 (D3), что запускает синтез γ-цепи ДНК.
- Активность РНКазы H раскрывает богатые пурином участки в позиции разрыва 2 (D2), что запускает синтез β-цепи ДНК. Когда новая γ-цепь ДНК достигает 5'-конца новой α-цепи, она переключается на 5'-конец новой α-цепи, воссоздавая разрыв 1 (D1). Когда новая γ-цепь ДНК достигает 5'-конца новой β-цепи, она замещает праймер и часть вновь синтезированной β-цепи, что приводит к воссозданию разрыва 2 (D2). Когда новая β-цепь ДНК достигает 5'-конца новой γ-цепи, она замещает праймер и часть вновь синтезированной γ-цепи, что приводит к воссозданию разрыва 3 (D3).
На этом этапе новый вирусный геном можно либо упаковать в капсиды и выпущены из камеры, или их можно транспортировать белки движения в соседнюю незараженную ячейку.[14]
Промотор вируса мозаики цветной капусты (CaMV 35S) используется в большинстве трансгенных культур для активации чужеродных генов, которые были искусственно введены в растение-хозяин. Он вводится в трансгенные растения в форме, отличной от той, которая обнаруживается, когда он присутствует в естественном виде. Brassica растения-хозяева. Это позволяет ему работать в широком диапазоне сред организма-хозяина, что в противном случае было бы невозможно.
CaMV содержит геном двухцепочечной ДНК размером около 8 т.п.н. и производит сферические частицы. Инфекции CaMV носят системный характер, и даже его ДНК заразительна при инокулировании на истертые поверхности растений. В геноме CaMV есть 8 плотно упакованных генов, из которых только два небольших гена, гены II и VII, являются несущественными; в результате только эти два гена могут быть заменены / удалены без потери инфекционности. Кроме того, модифицированные геномы CaMV, превышающие естественный размер генома (8024 п.н.) даже на несколько сотен п.н., не упаковываются в вирионы. Эти два фактора серьезно ограничивают размер вставки ДНК, клонируемой в CaMV. Бактериальная дигидрофолатредуктаза DHFR Ген был успешно клонирован в геном CaMV вместо гена II и успешно экспрессируется в растениях.
Молекулярные механизмы векторной передачи CaMV
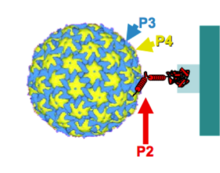
Вирус приобретается от инфицированного хозяина во время кормления тлей-переносчиком. Таким образом, трансмиссивный комплекс состоит из вирионов и белка P2, расположенных в стилетах вектора. N-концевой домен P2 распознает рецептор белка, расположенный на кончике стилета, а C-концевой домен P2 связывается с вирионами, украшенными P3.[15]
Способ захвата вектором контролируется тканевой и внутриклеточной локализацией P2. Этот белок содержится только в клетках эпидермиса и паренхимы. Более того, в этих клетках P2 локализован в единичных вирусных электронно-просветных телец включения (ELIB).[16] В клетках-хозяевах вирусные белки P2 и P3 сначала продуцируются на многочисленных вирусных фабриках (электронно-плотные тельца включения), а затем экспортируются и совместно локализуются с микротрубочками, а затем концентрируются в ELIB. CaMV специально использует микротрубочки для формирования передаваемого тела и, таким образом, обеспечивает передачу вектора.[17] Полная молекулярная характеристика и изучение этого вируса не проводились.
Уклонение от защиты растений
Вирус мозаики цветной капусты обладает рядом механизмов, которые позволяют ему противодействовать защите клеток растения-хозяина. Хотя прегеномная 35S РНК отвечает за репликацию генома с помощью обратной транскриптазы, она также содержит некодирующую лидерную последовательность из 600 пар оснований, которая служит важной мРНК для производства факторов, участвующих в противовирусной защите. Ряд хозяев CaMV обладают механизмами сайленсинга вирусов на основе малых РНК, которые служат для ограничения вирусной инфекции. Продукты вышеупомянутой последовательности длиной 600 п.н. представляют собой вирусные малые РНК (vsRNA) длиной 21, 22 и 24 нуклеотида, которые служат в качестве ловушек, связывают и инактивируют эффекторы механизма подавления звука хозяина, такие как Argonaute 1 (AGO1). В качестве доказательства принципа экспериментальная сверхэкспрессия этих vsРНК позволяет увеличить накопление вируса в инфицированных растениях.[18]
Обеспокоенность по поводу использования промотора 35S CaMV в трансгенных растениях
В последнее время возникли некоторые опасения по поводу использования промотора 35S CaMV для экспрессии в трансгенных растениях, поскольку между этим промотором и кодирующими последовательностями P6 существует перекрытие последовательностей. Пятьдесят четыре трансгенных объекта, сертифицированных для выпуска в США, содержат до 528 п.н. ORF VI (кодирующие C-концевые домены P6).[19] Поскольку P6 является многофункциональным белком, полный спектр функций которого неизвестен, есть некоторые опасения, что экспрессия одного или нескольких его доменов может иметь непредвиденные последствия для трансгенных организмов. В недавних исследованиях была предпринята попытка определить, какая длина промотора 35S CaMV имеет наименьший шанс непреднамеренного образования доменов P6, сохраняя при этом полную активность промотора. Как и следовало ожидать, использование более коротких промоторов уменьшает количество включаемых доменов P6, а также снижает вероятность нежелательных эффектов.[19]
Рекомендации
- ^ Pringle, CR. (1999). «Таксономия вирусов - 1999. Универсальная система таксономии вирусов, обновленная с учетом новых предложений, ратифицированных Международным комитетом по таксономии вирусов в 1998 году». Arch Virol. 144 (2): 421–9. Дои:10.1007 / s007050050515. ЧВК 7086988. PMID 10470265.
- ^ Rothnie, HM .; Chapdelaine, Y .; Хон, Т. (1994). Параретровирусы и ретровирусы: сравнительный обзор вирусной структуры и стратегий экспрессии генов. Adv Virus Res. Достижения в вирусных исследованиях. 44. С. 1–67. Дои:10.1016 / s0065-3527 (08) 60327-9. ISBN 9780120398447. PMID 7817872.
- ^ Хелифа, М .; Massé, D .; Blanc, S .; Друкер, М. (январь 2010 г.). «Оценка минимального времени репликации вируса мозаики цветной капусты у разных хозяев». Вирусология. 396 (2): 238–45. Дои:10.1016 / j.virol.2009.09.032. PMID 19913268.
- ^ Brault, V .; Узест, М .; Monsion, B .; Jacquot, E .; Блан, С. (2010). «Тля как средство переноса вирусов растений». Comptes Rendus Biologies. 333 (6–7): 524–38. Дои:10.1016 / j.crvi.2010.04.001. PMID 20541164.
- ^ Cheng, RH .; Olson, NH .; Бейкер Т.С. (Февраль 1992 г.). «Вирус мозаики цветной капусты: субъединица 420 (Т = 7), многослойная структура». Вирусология. 186 (2): 655–68. Дои:10.1016 / 0042-6822 (92) 90032-к. ЧВК 4167691. PMID 1733107.
- ^ Haas, M .; Бюро, М .; Geldreich, A .; Yot, P .; Келлер, М. (ноябрь 2002 г.). «Вирус мозаики цветной капусты: все еще в новостях». Мол Растение Патол. 3 (6): 419–29. Дои:10.1046 / j.1364-3703.2002.00136.x. PMID 20569349.
- ^ Тепфер, М .; Gaubert, S .; Leroux-Coyau, M .; Князь, С .; Houdebine, LM. (2004). «Временная экспрессия в клетках млекопитающих трансгенов, транскрибированных с промотора 35S вируса мозаики цветной капусты» (PDF). Защита окружающей среды по биобезопасности. 3 (2): 91–7. Дои:10.1051 / ebr: 2004010. PMID 15612506.
- ^ Fütterer, J .; Гордон, К .; Bonneville, JM .; Sanfaçon, H .; Пизан, Б .; Пенсвик, Дж .; Хон, Т. (сентябрь 1988 г.). «Ведущая последовательность большой РНК каулимовируса может быть свернута в большую структуру петля-стебель». Нуклеиновые кислоты Res. 16 (17): 8377–90. Дои:10.1093 / nar / 16.17.8377. ЧВК 338565. PMID 3419922.
- ^ Пуггин, ММ .; Hohn, T .; Фюттерер, Дж. (Май 1998 г.). «Принудительная эволюция показывает важность короткой открытой рамки считывания А и вторичной структуры в лидере 35S РНК вируса мозаики цветной капусты». J Virol. 72 (5): 4157–69. Дои:10.1128 / JVI.72.5.4157-4169.1998. ЧВК 109645. PMID 9557705.
- ^ Hemmings-Mieszczak, M .; Steger, G .; Хон, Т. (апрель 1997 г.). «Альтернативные структуры лидера 35 S РНК вируса мозаики цветной капусты: значение для вирусной экспрессии и репликации». Дж Мол Биол. 267 (5): 1075–88. Дои:10.1006 / jmbi.1997.0929. PMID 9150397.
- ^ Парк, HS .; Химмельбах, А .; Браунинг, KS .; Hohn, T .; Рябова, ЛА. (Сентябрь 2001 г.). «Фактор реинициации вируса растений взаимодействует с трансляционной машиной хозяина». Ячейка. 106 (6): 723–33. Дои:10.1016 / S0092-8674 (01) 00487-1. PMID 11572778. S2CID 14384952.
- ^ Lutz, L .; Райхы, Г .; Лейснер, СМ. (Декабрь 2012 г.). «Белок основного тела включения вируса мозаики цветной капусты взаимодействует с фактором передачи тли, ассоциированным с вирионом белком и продуктом гена VII». Вирус Res. 170 (1–2): 150–3. Дои:10.1016 / j.virusres.2012.08.017. ЧВК 4215633. PMID 22982205.
- ^ С любовью, AJ .; Джери, С .; Laird, J .; Carr, C .; Юн, BW .; Loake, GJ .; Tada, Y .; Sadanandom, A .; Милнер, Дж. (2012). «Белок P6 вируса мозаики цветной капусты подавляет сигнальные реакции на салициловую кислоту и регулирует врожденный иммунитет». PLOS ONE. 7 (10): e47535. Bibcode:2012PLoSO ... 747535L. Дои:10.1371 / journal.pone.0047535. ЧВК 3469532. PMID 23071821.
- ^ Laliberté, JF .; Санфасон, Х. (2010). «Клеточное ремоделирование при заражении растений вирусом». Анну Рев Фитопатол. 48: 69–91. Дои:10.1146 / annurev-phyto-073009-114239. PMID 20337516.
- ^ Hoh, F .; Узест, М .; Друкер, М .; Плиссон-Частанг, С .; Bron, P .; Blanc, S .; Дюма, К. (май 2010 г.). «Структурное понимание молекулярных механизмов передачи вируса мозаики цветной капусты его насекомыми-переносчиками». J Virol. 84 (9): 4706–13. Дои:10.1128 / JVI.02662-09. ЧВК 2863735. PMID 20181714.
- ^ Martinière, A .; Zancarini, A .; Друкер, М. (июнь 2009 г.). «Перенос вируса мозаики цветной капусты тлями: роль растения-хозяина». Сигнальное поведение растений. 4 (6): 548–50. Дои:10.4161 / psb 4.6.8712. ЧВК 2688309. PMID 19816139.
- ^ Martinière, A .; Gargani, D .; Узест, М .; Lautredou, N .; Blanc, S .; Друкер, М. (апрель 2009 г.). «Роль микротрубочек растений в формировании телец включения, специфичных для передачи вируса мозаики цветной капусты». Завод J. 58 (1): 135–46. Дои:10.1111 / j.1365-313X.2008.03768.x. ЧВК 2688309. PMID 19077170.
- ^ Блевинс, Т .; Rajeswaran, R .; Ареггер, М .; Borah, BK .; Щепетильников, М .; Baerlocher, L .; Farinelli, L .; Meins, F .; и другие. (Июль 2011 г.). «Массивное производство малых РНК из некодирующей области вируса мозаики цветной капусты для защиты растений и противовирусной защиты». Нуклеиновые кислоты Res. 39 (12): 5003–14. Дои:10.1093 / nar / gkr119. ЧВК 3130284. PMID 21378120.
- ^ а б Подевин, Н .; дю Жардин, П. (2012). «Возможные последствия перекрытия между областями промотора 35S CaMV в используемых векторах трансформации растений и вирусным геном VI в трансгенных растениях». ГМ-культуры Еда. 3 (4): 296–300. Дои:10.4161 / gmcr.21406. PMID 22892689.
внешние ссылки
- Вирус мозаики цветной капусты
- «Промоутер CaMV 35S». патентlens.net. Архивировано из оригинал на 2008-01-07.