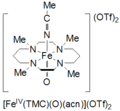WikiDer > Высоковалентное железо
Высоковалентное железо обычно обозначает соединения и промежуточные соединения, в которых утюг находится в формальном степень окисления > 3, которые показывают количество облигаций > 6 с координационный номер ≤ 6. Термин довольно необычный для гептакоординированных соединений железа.[1] Его следует отличать от терминов гипервалентный и гиперкоординатный, поскольку соединения высоковалентного железа не обязательно нарушают 18-электронное правило и не обязательно показывать координационные числа> 6. феррат (VI) ион [FeO4]2− была первой синтезированной структурой этого класса. Синтетические соединения, обсуждаемые ниже, в целом содержат сильно окисленное железо, поскольку концепции тесно связаны.
Соединения оксоирона[2]
Оксоферрильные соединения обычно предлагаются в качестве промежуточных продуктов в каталитические циклы, особенно биологические системы, в которых O2 требуется активация. Двухатомный кислород имеет высокий восстановительный потенциал (E0 = 1,23 В), но первым шагом, необходимым для использования этого потенциала, является термодинамически невыгодное восстановление одного электрона E0 = -0,16 В. Это снижение происходит в природе за счет образования супероксид комплекс, в котором восстановленный металл окисляется O2. Продуктом этой реакции является более активный перекисный радикал. Обилие этих видов в природе и доступный для них химический состав - вот причины, по которым изучение этих соединений важно.[нужна цитата] Широко применимый метод получения высоковалентных оксоферрильных частиц - окисление йодособензол:
- символическое окисление соединения железа с использованием йодособензол; L обозначает поддерживающий лиганд
Fe (IV) O
Сообщалось о нескольких формах синтеза оксо железа (IV).[3] Эти соединения моделируют биологические комплексы, такие как цитохром P450, БЕЗ синтазы, и изопенициллин-N-синтаза. Двумя такими описанными соединениями являются оксоирон с тиолат-лигированием (IV) и оксоирон с циклам-ацетатом (IV). Тиолат-лигированное оксоирон (IV) образуется в результате окисления предшественника [FeII(TMCS)] (PF6) (TMCS = 1-меркаптоэтил-4,8,11-триметил-1,4,8,11-тетразациклотетрадекан) и 3-5 эквивалентов H2О2 при -60 ˚C дюйм метанол. Соединение железа (IV) имеет темно-синий цвет и демонстрирует интенсивные абсорбционные характеристики при 460 нм, 570 нм, 850 нм и 1050 нм. Этот вид FeIV(= O) (TMCS) + стабилен при -60 ˚C, но сообщается о разложении при повышении температуры. Соединение 2 было идентифицировано Мессбауэровская спектроскопия, высокое разрешение ионизация электрораспылением масс-спектрометрия (ESI-MS), Рентгеновская абсорбционная спектроскопия, расширенная тонкая структура поглощения рентгеновского излучения (EXAFS), ультрафиолетовая видимая спектроскопия (УФ-видимый), Инфракрасная спектроскопия с преобразованием Фурье (FT-IR), и результаты сравнивали с теория функционала плотности (DFT) расчеты.[4]
Тетраметилциклам оксоирон (IV) образуется по реакции FeII(TMC) (OTf)2, TMC = 1,4,8,11-тетраметил-1,4,8,11-тетраазациклотетрадекан; OTf = CF3ТАК3, с йодозилбензолом (PhIO) в CH3CN при -40 ˚C. О втором способе образования оксоирона циклама (IV) сообщается как реакция FeII(TMC) (OTf)2 с 3 эквивалентами H2О2 на 3 часа. Этот вид имеет бледно-зеленый цвет и имеет максимум поглощения при 820 нм. Сообщается, что он стабилен не менее 1 месяца при -40 ˚C. Он был охарактеризован мессбауэровской спектроскопией, ESI-MS, EXAFS, UV-vis, Рамановская спектроскопия, и FT-IR.[5]
Высоковалентное железо биспидин комплексы могут окислять циклогексан к циклогексанол и циклогексанон с выходом 35% при соотношении спирта к кетону до 4.[6]
Fe (V) O
FeVTAML (= O), TAML = тетраамидо макроциклический лиганд, образуется по реакции [FeIII(TAML) (H2O)] (PPh4) с 2-5 эквивалентами мета-хлорпербензойной кислоты при -60 ˚C в н-бутиронитриле. Это темно-зеленое соединение (два λМаксимум при 445 и 630 нм соответственно) стабильна при 77 К. Стабилизация Fe (V) объясняется сильной π-донорной способностью депротонированных амидных атомов азота.[7]
Fe (VI) O
Феррат (VI) - это неорганический анион из химическая формула [FeO4]2−. это светочувствительный и придает бледно-фиолетовый цвет его соединениям и растворам. Это один из самых прочных водостойких окисляющие вещества известен. Хотя он классифицируется как слабая база, концентрированные растворы феррата (VI) стабильны только при высоких pH.
Электронная структура
Проведен обзор электронной структуры порфириновых соединений оксо железа.[8]
Соединения нитридоирона и имидоирона
Нитридоирон[9] и имидоирон[10] соединения тесно связаны с химия железа и азота.[11] Биологическое значение нитридоирона (V) порфирины был рассмотрен.[12][13] Широко применяемый метод получения форм высокомолекулярного нитридо железа - это термическое или фотохимическое окислительное удаление молекулярного азота из азид сложный.
- символическое окислительное отщепление азота дает комплекс нитридо-железа; L обозначает поддерживающий лиганд.
Fe (IV) N
Существует несколько структурно охарактеризованных соединений нитридо-железа (IV).[14][15][16]
Fe (V) N
Первое соединение нитридо-железа (V) было синтезировано и охарактеризовано Вагнером и Накамото (1988, 1989) с использованием фотолиз и Рамановская спектроскопия при низких температурах.[17][18]
Fe (VI) N
Второй FeVI виды, кроме феррат (VI) ион, [(Me3cy-ac) FeN] (PF6)2, было сообщено. Этот вид образуется в результате окисления с последующим фотолиз с получением частиц Fe (VI). Характеристика комплекса Fe (VI) была проведена расчетами Мёссбауэра, EXAFS, ИК и DFT. В отличие от иона феррата (VI) соединение 5 представляет собой диамагнитный.[19]
μ-нитридосоединения и окислительный катализ[20]
Мостиковый μ-нитридо ди-железа фталоцианин соединения катализируют окисление метан к метанол, формальдегид, и муравьиная кислота с помощью пероксид водорода как жертвенный окислитель.[21]
Электронная структура
Виды нитридо железа (IV) и нитридо железа (V) были впервые теоретически исследованы в 2002 году.[22]
Рекомендации
- ^ Craig et al. Dalton Trans., 2010, 39, 4874-4881 Дои:10.1039 / B927032A
- ^ Que et al .; Журнал неорганической биохимии, том 100, выпуск 4, апрель 2006 г., страницы 421-433;Дои:10.1016 / j.jinorgbio.2006.01.014
- ^ Йи, Гереон М .; Толмен, Уильям Б. (2015). "Глава 5, раздел 2.2.4 Fe (IV) -Oxo промежуточные соединения"В книге Питера М. Х. Кронека и Марты Э. Соса Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие кислород и другие жевательные газы. Ионы металлов в науках о жизни. 15. Springer. С. 145–146. Дои:10.1007/978-3-319-12415-5_5.
- ^ Буковски, М. Р., Кентоп, К. Д., Стубна, А., Боминар Э. Л., Халфен, Дж. А., Мунк, Э., Нам, В., Ку, Л., Science, 310, 1000-1002, 2005; Дои:10.1126 / science.111909
- ^ Роде, J.-U., In, J.-H., Lim, MH, Brennessel, WW, Bikowski, MR, Stubna, A., Munck, E., Name, W., Que, L., Science, 299, 1037-1039, 2003; Дои:10.1126 / science.299.5609.1037
- ^ Comba, P. et al .; Неорг. Chem., 2009, 48 (21), pp 10389–10396; Дои:10.1021 / ic901702s
- ^ Оливейра, FT, Чанда, А., Банерджи, Д., Шан, X., Мондал, С., Ку, Л., Боминаар, Е.Л., Мунк, Э., Коллинз, Т.Дж., Science, 315, 835-838, 2007; Дои:10.1126 / science.1133417
- ^ Fujii, H .; Обзоры по координации химии, том 226, выпуски 1-2, март 2002 г., страницы 51-60; Дои:10.1016 / S0010-8545 (01) 00441-6
- ^ Berry, J.F .; Комментарии по неорганической химии, 30: 28–66, 2009; Дои:10.1080/02603590902768875
- ^ Peters, J.C., Mehn, M.P .; Журнал неорганической биохимии, том 100, выпуск 4, апрель 2006 г., страницы 634-643; Дои:10.1016 / j.jinorgbio.2006.01.023
- ^ Тайлер, Д. Р., Кроссленд, Дж. Э .; Обзоры по координации химии 254 (2010) 1883–1894; Дои:10.1016 / j.ccr.2010.01.005
- ^ Накамото, К .; Обзоры координационной химии, том 226, выпуски 1-2, март 2002 г., страницы 153-165; Дои:10.1016 / S0010-8545 (01) 00425-8
- ^ Накамото, К .; Journal of Molecular Structure Volumes 408-409, 1 июня 1997 г., страницы 11-16; Дои:10.1016 / S0022-2860 (96) 09670-6
- ^ Peters, Jonas C .; Que, Lawrence, Jr. et al .; Неорг. Chem., 2007, 46 (14), pp 5720–5726; Дои:10.1021 / ic700818q
- ^ Smith et al .; Angewandte Chemie International Edition, том 48, выпуск 17, страницы 3158–3160, 14 апреля 2009 г .; Дои:10.1002 / anie.200900381
- ^ Meyer et al .; Angewandte Chemie International Edition, том 47, выпуск 14, страницы 2681–2684, 25 марта 2008 г., 14 апреля 2009 г .; Дои:10.1002 / anie.200800600
- ^ Wagner, W.D .; Накамото, К .; Варенье. Chem. Soc., 1988, 110 (12), стр. 4044–4045; Дои:10.1021 / ja00220a057
- ^ Wagner, W.D .; Накамото, К .; Варенье. Chem. Soc., 1989, 111 (5), стр. 1590–1598; Дои:10.1021 / ja00187a010
- ^ Берри, Дж. Ф., Билл, Э., Боте, Э., Джордж, С. Д., Минер, Б., Низ, Ф., Вигард, К., Science, 312, 1937-1941, 2006; Дои:10.1126 / science.1128506
- ^ Обзор: Que, L., Tolman, W.B .; Nature 455, 333-340 (18 сентября 2008 г.); Дои:10.1038 / природа07371
- ^ Сорокин, А.Б .; Кудрик, Е.В .; Bouchu, D .; Chem. Commun., 2008, 2562-2564; Дои:10.1039 / B804405H
- ^ Dey, A .; Ghosh, A .; Варенье. Chem. Soc., 2002, 124 (13), pp 3206–3207; Дои:10.1021 / ja012402s
Смотрите также
- Катализатор Якобсена (высоковалентный марганец)
дальнейшее чтение
- Solomon et al .; Angewandte Chemie International Edition, том 47, выпуск 47, страницы 9071–9074, 10 ноября 2008 г .; Дои:10.1002 / anie.200803740