WikiDer > Гидроний
| Имена | |||
|---|---|---|---|
| Название ИЮПАК оксоний | |||
| Другие имена ион гидроксония | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Свойства | |||
| ЧАС 3О+ | |||
| Молярная масса | 19,02 г / моль | ||
| Кислотность (пKа) | -1,74 или 0 (неоднозначно, см. Текст) | ||
| Основание конъюгата | вода | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
В химия, гидроксоний (гидроксоний в традиционном британском английском) - это общее название водный катион ЧАС
3О+
, тип оксониевый ион произведено протонирование из воды. Это положительный ион, присутствующий, когда Аррениевая кислота растворяется в воде, так как кислота Аррениуса молекулы в решение отказаться от протон (положительный ион водорода, ЧАС+
) к окружающим молекулам воды (ЧАС
2О).
Определение pH
Концентрация ионов гидроксония определяет концентрацию раствора. pH. Концентрация гидроксид ионов определяет pOH. Молекулы в чистой воде самодиссоциировать (т.е..: реагируют друг с другом) на ионы гидроксония и гидроксид-ионы в следующем равновесии:
- 2 ч
2O ⇌ OH−
+ H
3О+
В чистой воде содержится равное количество ионов гидроксида и гидроксония, поэтому это нейтральный раствор. При 25 ° C (77 ° F) вода имеет pH 7 и pOH 7 (это меняется при изменении температуры: см. самоионизация воды). Значение pH менее 7 указывает на кислый раствор, а значение pH более 7 указывает на щелочной раствор.
Номенклатура
Согласно с Номенклатура органической химии ИЮПАКион гидроксония следует называть оксоний.[1] Гидроксоний также может использоваться однозначно для его идентификации. Черновик ИЮПАК предложение также рекомендует использовать оксоний и оксидан в контексте органической и неорганической химии соответственно.
An оксониевый ион представляет собой любой ион с трехвалентным катионом кислорода. Например, протонированный гидроксильная группа представляет собой ион оксония, но не ион гидроксония.
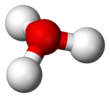
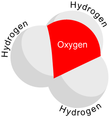
Структура
поскольку О+
и N имеют одинаковое количество электронов, ЧАС
3О+
является изоэлектронный с участием аммиак. Как показано на изображениях выше, ЧАС
3О+
имеет треугольная пирамидальная геометрия молекул с атомом кислорода на его вершине. В H − O − H угол связи примерно 113 °,[2] а центр масс очень близко к атому кислорода. Поскольку основание пирамиды состоит из трех одинаковых атомов водорода, ЧАС
3О+
конфигурация симметричного верха молекулы такова, что она принадлежит C
3в точечная группа. Из-за этой симметрии и наличия дипольного момента правила отбора по вращению ΔJ = ± 1 и ΔK = 0. Диполь перехода лежит вдоль c-ось и, поскольку отрицательный заряд локализован около атома кислорода, дипольный момент указывает на вершину, перпендикулярную плоскости основания.
Кислоты и кислотность
Гидроний - это катион, который образуется из воды в присутствии ионы водорода. Эти гидроны не существуют в свободном состоянии - они чрезвычайно реактивны и растворенный по воде. An кислый растворенное вещество обычно является источником гидронов, но ионы гидроксония существуют даже в чистой воде. Этот частный случай реакции воды с водой с образованием гидроксония (и гидроксид) ионы обычно называют самоионизация воды. Образующихся ионов гидроксония мало и они недолговечны. pH является мерой относительной активности ионов гидроксония и гидроксида в водных растворах. В кислых растворах гидроксоний более активен, его избыток протон легко доступен для реакции с основными частицами.
Ион гидроксония очень кислый: при 25 ° C его пKа примерно 0.[3][4][5] Это наиболее кислые вещества, которые могут существовать в воде (при условии, что воды достаточно для растворения): любая более сильная кислота ионизирует и протонирует молекулу воды с образованием гидрокония. Кислотность гидроксония - это неявный стандарт, используемый для оценки силы кислоты в воде: сильные кислоты должны быть лучшими донорами протонов, чем гидроксоний, иначе значительная часть кислоты будет существовать в неионизированном состоянии (то есть в слабой кислоте). В отличие от гидроксония в нейтральных растворах, которые возникают в результате автодиссоциации воды, ионы гидроксония в кислых растворах долговечны и концентрируются пропорционально силе растворенной кислоты.
pH изначально задумывался как мера ион водорода концентрация водного раствора.[6] Практически все такие свободные протоны быстро реагируют с водой с образованием гидроксония; поэтому кислотность водного раствора более точно характеризуется концентрацией гидроксония. В органических синтезах, таких как реакции, катализируемые кислотой, ион гидроксония (ЧАС
3О+
) могут использоваться как взаимозаменяемые с ЧАС+
ион; выбор одного из них не оказывает существенного влияния на механизм реакции.
Решение
Исследователям еще предстоит полностью охарактеризовать сольватация иона гидроксония в воде, отчасти потому, что существует много разных значений сольватации. А депрессия точки замерзания исследование показало, что средний ион гидратации в холодной воде составляет приблизительно ЧАС
3О+
(ЧАС
2O)
6:[7] в среднем каждый ион гидроксония сольватирован 6 молекулами воды, которые не могут сольватировать другие молекулы растворенного вещества.
Некоторые гидратные структуры довольно большие: ЧАС
3О+
(ЧАС
2O)
20 структура числа магических ионов (называемая магия из-за его повышенной стабильности по отношению к структурам гидратации, включающим сопоставимое количество молекул воды - это аналогичное использование слова магия как в ядерная физика) может поместить гидроний внутрь додекаэдр клетка.[8] Однако более поздние ab initio метод молекулярно-динамическое моделирование показало, что в среднем гидратированный протон находится на поверхности ЧАС
3О+
(ЧАС
2O)
20 кластер.[9] Кроме того, несколько разрозненных характеристик этих симуляций согласуются с их экспериментальными аналогами, предлагая альтернативную интерпретацию экспериментальных результатов.
Две другие известные структуры - это Катион Цунделя и Собственный катион. В сольватационной структуре Эйгена ион гидроксония находится в центре ЧАС
9О+
4 комплекс, в котором гидроксоний сильно водородная связь к трем соседним молекулам воды.[10] В Цунделе ЧАС
5О+
2 комплекс протон делится поровну двумя молекулами воды в симметричная водородная связь.[11] Недавняя работа показывает, что оба этих комплекса представляют собой идеальные структуры в более общем дефекте сети водородных связей.[12]
Выделение мономера иона гидроксония в жидкой фазе достигалось в неводной среде с низкой нуклеофильностью. суперкислотный решение (HF−SbF
5ТАК
2). Ион характеризовался высоким разрешением 17
О ядерный магнитный резонанс.[13]
Расчет 2007 г. энтальпии и свободные энергии различных водородных связей вокруг катиона гидроксония в жидкой протонированной воде[14] при комнатной температуре и исследование прыжки протонов механизм с использованием молекулярная динамика показали, что водородные связи вокруг иона гидроксония (образованного тремя водными лиганды во-первых сольватационная оболочка гидрокония) довольно сильны по сравнению с объемной водой.
Стоянов предложил новую модель.[15] на основе инфракрасная спектроскопия в котором протон существует как ЧАС
13О+
6 ион. Таким образом, положительный заряд делокализован на 6 молекул воды.
Твердые соли гидроксония
Для многих сильные кислоты, возможно образование кристаллов их гидроксониевой соли, которые относительно стабильны. Эти соли иногда называют моногидраты кислот. Как правило, любая кислота с константа ионизации из 109 или выше может это сделать. Кислоты с константами ионизации ниже 109 обычно не может образовывать стабильный ЧАС
3О+
соли. Например, азотная кислота имеет константу ионизации 101.4, а смеси с водой во всех пропорциях являются жидкими при комнатной температуре. Однако, хлорная кислота имеет константу ионизации 1010, и если жидкая безводная хлорная кислота и вода смешиваются в молярном соотношении 1: 1, они реагируют с образованием твердого перхлората гидроксония (ЧАС
3О+
· ClO−
4).
Ион гидроксония также образует стабильные соединения с карборана суперкислота H (CB
11H (CH
3)
5Br
6).[16] Рентгеновская кристаллография показывает C
3в симметрия для иона гидроксония с каждым протоном, взаимодействующим с атомом брома, каждый из трех карборановых анионов 320 вечера в среднем друг от друга. В [ЧАС
3O] [H (CB
11HCl
11)] соль также растворима в бензол. В кристаллах, выращенных из бензольного раствора, происходит сокристаллизация растворителя и ЧАС
3O · (C
6ЧАС
6)
3 катион полностью отделен от аниона. В катионе три молекулы бензола окружают гидроксоний, образуя Пи-катион взаимодействует с атомами водорода. Ближайшее (несвязывающее) приближение аниона хлора к катиону кислорода составляет 348 пм.
Известно также множество примеров гидратированных ионов гидроксония, таких как ЧАС
5О+
2 ион в HCl · 2H2О, то ЧАС
7О+
3 и ЧАС
9О+
4 ионы оба найдены в HBr · 4H2О.[17]
Межзвездный ЧАС
3О+
Гидроний является распространенным молекулярный ион в межзвездной среде и находится в диффузных[18] и плотный[19] молекулярные облака, а также плазменные хвосты комет.[20] Межзвездные источники наблюдений гидрокония включают области Стрельца B2, Ориона OMC-1, Ориона BN – IRc2, Ориона KL и кометы Хейла – Боппа.
Межзвездный гидроксоний образуется в результате цепочки реакций, запускаемых ионизацией ЧАС
2 в ЧАС+
2 космическим излучением.[21] ЧАС
3О+
может произвести либо ОЙ− или ЧАС
2О через диссоциативная рекомбинация реакции, которые происходят очень быстро даже при низких (≥10 K) температурах плотных облаков.[22] Это приводит к тому, что гидроксоний играет очень важную роль в межзвездной ионно-нейтральной химии.
Астрономы особенно заинтересованы в определении содержания воды в различных межзвездных климатах из-за ее ключевой роли в охлаждении плотных молекулярных газов посредством радиационных процессов.[23] Однако, ЧАС
2О не имеет много благоприятных переходов для наземных наблюдений.[24] Хотя наблюдения HDO (the дейтерированная версия воды[25]) потенциально может быть использован для оценки ЧАС
2О численности, отношение HDO к ЧАС
2О известно не очень точно.[24]
Hydronium, с другой стороны, имеет несколько переходов, которые делают его превосходным кандидатом для обнаружения и идентификации в различных ситуациях.[24] Эта информация использовалась в сочетании с лабораторными измерениями коэффициентов ветвления различных ЧАС
3О+
реакции диссоциативной рекомбинации[22] предоставить то, что считается относительно точным ОЙ− и ЧАС
2О численности, не требуя прямого наблюдения за этими видами.[26][27]
Межзвездная химия
Как упоминалось ранее, ЧАС
3О+
встречается как в диффузных, так и в плотных молекулярных облаках. Применяя константы скорости реакции (α, β, и γ), соответствующих всем доступным в настоящее время охарактеризованным реакциям с участием ЧАС
3О+
, можно вычислить k(Т) для каждой из этих реакций. Умножая эти k(Т) по относительному содержанию продуктов, относительные нормы (в см3/ с) для каждой реакции при заданной температуре. Эти относительные ставки можно сделать в абсолютных показателях, умножив их на [ЧАС
2]2
.[28] Предполагая Т = 10 К для плотного облака и Т = 50 К для диффузного облака результаты показывают, что наиболее доминирующие механизмы образования и разрушения были одинаковыми для обоих случаев. Следует отметить, что относительные содержания, использованные в этих расчетах, соответствуют TMC-1, плотному молекулярному облаку, и поэтому ожидается, что рассчитанные относительные скорости будут более точными при Т = 10 К. Три самых быстрых механизма образования и разрушения перечислены в таблице ниже вместе с их относительными скоростями. Обратите внимание, что скорости этих шести реакций таковы, что они составляют примерно 99% химических взаимодействий иона гидроксония в этих условиях.[20] Все три механизма разрушения в таблице ниже классифицируются как диссоциативная рекомбинация реакции.
| Реакция | Тип | Относительная скорость (см3/ с) | |
|---|---|---|---|
| при 10 К | при 50 К | ||
| ЧАС 2 + H 2О+ → H 3О+ + H | Формирование | 2.97×10−22 | 2.97×10−22 |
| ЧАС 2O + HCO+ → CO + H 3О+ | Формирование | 4.52×10−23 | 4.52×10−23 |
| ЧАС+ 3 + H 2O → H 3О+ + H 2 | Формирование | 3.75×10−23 | 3.75×10−23 |
| ЧАС 3О+ + е− → ОН + Н + Н | Разрушение | 2.27×10−22 | 1.02×10−22 |
| ЧАС 3О+ + е− → H 2O + H | Разрушение | 9.52×10−23 | 4.26×10−23 |
| ЧАС 3О+ + е− → ОН + Н 2 | Разрушение | 5.31×10−23 | 2.37×10−23 |
Также стоит отметить, что относительные скорости реакций образования в таблице выше одинаковы для данной реакции при обеих температурах. Это связано с тем, что константы скорости этих реакций имеют β и γ константы 0, в результате чего k = α который не зависит от температуры.
Поскольку все три реакции производят либо ЧАС
2О или ОН, эти результаты подтверждают тесную связь между их относительной численностью и численностью ЧАС
3О+
. Скорости этих шести реакций таковы, что они составляют приблизительно 99% химических взаимодействий иона гидроксония в этих условиях.
Астрономические открытия
Еще в 1973 году, до первого межзвездного обнаружения, химические модели межзвездной среды (первая из которых соответствовала плотному облаку) предсказывали, что гидроксоний является распространенным молекулярным ионом и играет важную роль в ионно-нейтральной химии.[29] Однако до того, как могли начаться астрономические поиски, все еще оставалась проблема определения спектроскопических характеристик гидроксония в газовой фазе, которые на тот момент были неизвестны. Первые исследования этих характеристик были проведены в 1977 г.[30] за которым последовали другие спектроскопические эксперименты с более высоким разрешением. После того, как в лаборатории было идентифицировано несколько линий, первое межзвездное обнаружение H3О+ был произведен двумя группами почти одновременно в 1986 году.[19][24] В первом, опубликованном в июне 1986 г., сообщалось о наблюдении Jvt
K = 1−
1 − 2+
1 переход в 3071920,41 МГц в OMC-1 и Sgr B2. Во втором, опубликованном в августе, сообщается о наблюдении того же перехода к туманности Орион-KL.
За этими первыми обнаружениями последовали наблюдения ряда дополнительных ЧАС
3О+
переходы. Первые наблюдения каждого последующего обнаружения перехода приведены ниже в хронологическом порядке:
В 1991 г.+
2 − 2−
2 переход в 3647970,427 МГц наблюдалась в OMC-1 и Sgr B2.[31] Год спустя 3+
0 − 2−
0 переход в 3962720,412 МГц наблюдалась в нескольких областях, наиболее яркой из которых было облако W3 IRS 5.[27]
Первый дальний ИК 4−
3 − 3+
3 переход на 69,524 мкм (4,3121 ТГц) был сделан в 1996 г. вблизи Orion BN-IRc2.[32] В 2001 году три дополнительных перехода ЧАС
3О+
in наблюдались в дальней инфракрасной области у Sgr B2; 2−
1 − 1+
1 переход на 100,577 мкм (2,98073 ТГц), 1−
1 − 1+
1 при 181,054 мкм (1,65582 ТГц) и 2−
0 − 1+
0 при 100,869 мкм (2,9721 ТГц).[33]
Смотрите также
- Hydron (катион водорода)
- Гидрид
- Анион водорода
- Ион водорода
- Механизм грота
- Трифтороксоний
- Закон разбавления
использованная литература
- ^ «Таблица 17 Одноядерные родительские ониевые ионы». ИЮПАК.
- ^ Тан, Цзянь; Ока, Такеши (1999). «Инфракрасная спектроскопия ЧАС
3О+
: V1 основная полоса ". Журнал молекулярной спектроскопии. 196 (1): 120–130. Bibcode:1999JMoSp.196..120T. Дои:10.1006 / jmsp.1999.7844. PMID 10361062. - ^ Мейстер, Эрих; Виллеке, Мартин; Angst, Вернер; Тонни, Антонио; Вальде, Питер (2014). «Запутанные количественные описания кислотно-основных равновесий Бренстеда-Лоури в учебниках химии - критический обзор и разъяснения для преподавателей-химиков». Helv. Чим. Acta. 97 (1): 1–31. Дои:10.1002 / hlca.201300321.
- ^ Значения, обычно приводимые для pKаводный(ЧАС3О+) равны 0 или –1,74. В первом используется соглашение, согласно которому активность растворителя в разбавленном растворе (в данном случае вода) равна 1, в то время как во втором используется значение концентрации воды в чистой жидкости, равное 55,5 M, и могут быть приведены убедительные аргументы. на каждый выбор. Несогласие происходит из-за двусмысленности, что для определения pKа из H3О+ в воде, H2O должен действовать одновременно как растворенное вещество и растворитель. ИЮПАК не дал официального определения pKа это разрешило бы эту двусмысленность. Бурго утверждал, что H3О+(водн.) + H2O (l) ⇄ H2O (водн.) + H3О+ (aq) просто не является термодинамически четко определенным процессом. Для оценки pKаводный(ЧАС3О+), Бурго предлагает принять измеренное значение pKаEtOH(ЧАС3О+) = 0,3, pKа из H3О+ в этаноле, и применяя корреляционное уравнение pKаводный = pKаEtOH - 1,0 (± 0,3) для преобразования этанола pKа к водному значению, чтобы получить значение pKаводный(ЧАС3О+) = –0.7 (± 0.3).
- ^ Бурго, Жан-Луи (1998). «Перспектива - новая точка зрения на значение и значения пар Ka ○ (H3O +, H2O) и Kb ○ (H2O, OH−) в воде». Аналитик. 123 (2): 409–410. Дои:10.1039 / a705491b.
- ^ Соренсен, С. П. Л. (1909). "Ueber die Messung und die Bedeutung der Wasserstoffionenkonzentration bei fermentischen Prozessen". Biochemische Zeitschrift (на немецком). 21: 131–304.
- ^ Завицас, А.А. (2001). «Свойства водных растворов электролитов и неэлектролитов». Журнал физической химии B. 105 (32): 7805–7815. Дои:10.1021 / jp011053l.
- ^ Hulthe, G .; Stenhagen, G .; Wennerström, O .; Оттоссон, C-H. (1997). «Водный кластер исследован методом электроспрей-масс-спектрометрии». Журнал хроматографии А. 512: 155–165. Дои:10.1016 / S0021-9673 (97) 00486-X.
- ^ Iyengar, S. S .; Петерсен, М. К .; Burnham, C.J .; Day, T. J. F .; Voth, G.A .; Вот, Г. А. (2005). «Свойства ионно-водных кластеров. I. Протонированный 21-водный кластер» (PDF). Журнал химической физики. 123 (8): 084309. Bibcode:2005ЖЧФ.123х4309И. Дои:10.1063/1.2007628. PMID 16164293.
- ^ Zundel, G .; Мецгер, Х. (1968). "Energiebänder der tunnelnden Überschuß-Protonen in flüssigen Säuren. Eine IR-spektroskopische Untersuchung der Natur der Gruppierungen ЧАС
5О+
2". Zeitschrift für Physikalische Chemie. 58 (5_6): 225–245. Дои:10.1524 / zpch.1968.58.5_6.225. S2CID 101048854. - ^ Wicke, E .; Эйген, М .; Акерманн, Т. (1954). "Uber den Zustand des Protons (Hydroniumions) в wäßriger Lösung". Zeitschrift für Physikalische Chemie. 1 (5_6): 340–364. Дои:10.1524 / zpch.1954.1.5_6.340.
- ^ Маркс, Д .; Tuckerman, M.E .; Hutter, J .; Парринелло, М. (1999). «Природа гидратированного избыточного протона в воде». Природа. 397 (6720): 601–604. Bibcode:1999Натура.397..601М. Дои:10.1038/17579. S2CID 204991299.
- ^ Mateescu, G.D .; Бенедикт, Г. М. (1979). «Вода и родственные системы. 1. Ион гидроксония (ЧАС
3О+
). Получение и определение характеристик методом ядерного магнитного резонанса кислорода-17 высокого разрешения ». Журнал Американского химического общества. 101 (14): 3959–3960. Дои:10.1021 / ja00508a040. - ^ Маркович, О .; Агмон, Н. (2007). «Строение и энергетика гидратных оболочек гидрокония». (PDF). Журнал физической химии A. 111 (12): 2253–6. Bibcode:2007JPCA..111.2253M. CiteSeerX 10.1.1.76.9448. Дои:10.1021 / jp068960g. PMID 17388314.
- ^ Стоянов, Евгений С .; Стоянова, Ирина В .; Рид, Кристофер А. (15 января 2010 г.). «Строение иона водорода (ЧАС+
водный) в воде". Журнал Американского химического общества. 132 (5): 1484–1485. Дои:10.1021 / ja9101826. ЧВК 2946644. PMID 20078058. - ^ Стоянов, Евгений С .; Ким, Ки-Чан; Рид, Кристофер А. (2006). "Природа ЧАС
3О+
Ионы гидроксония в бензоле и хлорированных углеводородных растворителях. Условия существования и переосмысления инфракрасных данных ». Журнал Американского химического общества. 128 (6): 1948–58. Дои:10.1021 / ja0551335. PMID 16464096. - ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Фор, А .; Теннисон, Дж. (2003). "Коэффициенты скорости для вращательного возбуждения электронным ударом ЧАС+
3 и ЧАС
3О+
". Ежемесячные уведомления Королевского астрономического общества. 340 (2): 468–472. Bibcode:2003МНРАС.340..468Ф. Дои:10.1046 / j.1365-8711.2003.06306.x. - ^ а б Hollis, J.M .; Churchwell, E. B .; Herbst, E .; Де Люсия, Ф. К. (1986). "Межзвездная линия, совпадающая с переходом P (2, l) гидроксония (ЧАС
3О+
)". Природа. 322 (6079): 524–526. Bibcode:1986Натура.322..524H. Дои:10.1038 / 322524a0. S2CID 4346975. - ^ а б Рауэр, Х (1997). «Ионный состав и взаимодействие солнечного ветра: наблюдения кометы C / 1995 O1 (Хейла-Боппа)». Земля, Луна и планеты. 79: 161–178. Bibcode:1997EM&P ... 79..161R. Дои:10.1023 / А: 1006285300913. S2CID 119953549.
- ^ Вейби ‐ Кристенсен, Л .; Андерсен, Л. Х .; Heber, O .; Kella, D .; Pedersen, H.B .; Schmidt, H.T .; Зайфман, Д. (1997). «Полные коэффициенты ветвления для диссоциативной рекомбинации ЧАС
2О+
, ЧАС
3О+
, и CH+
3". Астрофизический журнал. 483 (1): 531–540. Bibcode:1997ApJ ... 483..531V. Дои:10.1086/304242. - ^ а б Neau, A .; Аль Халили, А .; Rosén, S .; Le Padellec, A .; Деркач, А. М .; Shi, W .; Викор, Л .; Larsson, M .; Semaniak, J .; Thomas, R .; Någård, M. B .; Андерссон, К .; Данаред, H .; Аф Угглас, М. (2000). "Диссоциативная рекомбинация D
3О+
и ЧАС
3О+
: Абсолютные сечения и коэффициенты ветвления ». Журнал химической физики. 113 (5): 1762. Bibcode:2000ЖЧФ.113.1762Н. Дои:10.1063/1.481979. - ^ Neufeld, D.A .; Лепп, С .; Мельник, Г. Дж. (1995). «Тепловой баланс в плотных молекулярных облаках: скорость радиационного охлаждения и светимости линий излучения». Серия дополнений к астрофизическому журналу. 100: 132. Bibcode:1995ApJS..100..132N. Дои:10.1086/192211.
- ^ а б c d Wootten, A .; Boulanger, F .; Bogey, M .; Гребни, F .; Encrenaz, P.J .; Герин, М .; Зюрис, Л. (1986). "В поисках межзвездного ЧАС
3О+
". Астрономия и астрофизика. 166: L15–8. Bibcode:1986A & A ... 166L..15W. PMID 11542067. - ^ ИЮПАК, Сборник химической терминологии2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "тяжелая вода". Дои:10.1351 / goldbook.H02758
- ^ Herbst, E .; Green, S .; Thaddeus, P .; Клемперер, В. (1977). «Косвенное наблюдение ненаблюдаемых межзвездных молекул». Астрофизический журнал. 215: 503–510. Bibcode:1977ApJ ... 215..503H. Дои:10.1086/155381. HDL:2060/19770013020.
- ^ а б Phillips, T. G .; Van Dishoeck, E. F .; Кин, Дж. (1992). "Интерстеллар ЧАС
3О+
и его отношение к O2 и ЧАС
2О Изобилие » (PDF). Астрофизический журнал. 399: 533. Bibcode:1992ApJ ... 399..533P. Дои:10.1086/171945. HDL:1887/2260. - ^ "ЧАС
3О+
реакции образования ". База данных UMIST по астрохимии. - ^ Herbst, E .; Клемперер, В. (1973). «Образование и истощение молекул в плотных межзвездных облаках». Астрофизический журнал. 185: 505. Bibcode:1973ApJ ... 185..505H. Дои:10.1086/152436.
- ^ Шварц, Х.А. (1977). «Газофазные инфракрасные спектры ионов гидрата оксония от 2 до 5 мкм». Журнал химической физики. 67 (12): 5525. Bibcode:1977ЖЧФ..67.5525С. Дои:10.1063/1.434748.
- ^ Wootten, A .; Тернер, Б. Э .; Mangum, J. G .; Bogey, M .; Boulanger, F .; Гребни, F .; Encrenaz, P.J .; Герин, М. (1991). "Обнаружение межзвездных ЧАС
3О+
- Подтверждающая строка ». Астрофизический журнал. 380: L79. Bibcode:1991ApJ ... 380L..79W. Дои:10.1086/186178. - ^ Timmermann, R .; Никола, Т .; Поглич, А .; Geis, N .; Стейси, Г. Дж .; Таунс, К. Х. (1996). "Возможное открытие 70 мкм {H3О+} 4−
3 − 3+
3 переход в Орионе BN-IRc2 ". Астрофизический журнал. 463 (2): L109. Bibcode:1996ApJ ... 463L.109T. Дои:10.1086/310055. - ^ Goicoechea, J. R .; Черничаро, Дж. (2001). "Обнаружение в дальнем инфракрасном диапазоне ЧАС
3О+
в Стрельце B2 ". Астрофизический журнал. 554 (2): L213. Bibcode:2001ApJ ... 554L.213G. Дои:10.1086/321712.