WikiDer > Волшебная кислота
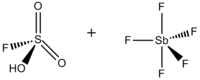 Пентафторид сурьмы-фтористоводородная кислота 1: 1 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.041.727 |
PubChem CID | |
| |
| |
| Характеристики | |
| HSbF6ТАК3 | |
| Молярная масса | 316,82 г / моль |
| Внешность | Жидкость |
| Опасности | |
| R-фразы (устарело) | R14 R15 / 29 R16 R17 R18 R19 R26 / 27/28 R30 R31 R32 R33 R34 |
| S-фразы (устарело) | S26 S27 S36 / 37/39 S38 S40 S41 S42 S43 S45 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Волшебная кислота (FSO3H · SbF5) это суперкислотный состоящий из смеси, чаще всего в молярном соотношении 1: 1, фтористоводородная кислота (HSO3F) и пентафторид сурьмы (SbF5). Это сопряжение Brønsted–Льюис суперкислотная система была разработана в 1960-х годах Джордж Олах лаборатория в Кейс Вестерн Резервный университет, и был использован для стабилизации карбокатионы и гиперкоординированные ионы карбония в жидких средах. Волшебная кислота и другие суперкислоты также используются для катализирования изомеризации насыщенных углеводородов и, как было показано, протонировать даже слабые основания, включая метан, ксенон, галогены и молекулярный водород.[1]
История
Термин «суперкислота» впервые был использован в 1927 году, когда Джеймс Брайант Конант обнаружили, что хлорная кислота может протонировать кетоны и альдегиды с образованием солей в неводном растворе.[1] Сам термин был придуман Р. Дж. Гиллеспи позже, после того, как Конант соединил серную кислоту с фтористоводородная кислота, и обнаружил, что раствор в несколько миллионов раз более кислый, чем одна серная кислота.[2] Система волшебной кислоты была разработана в 1960-х Джорджем Олахом и должна была использоваться для изучения стабильных карбокатионов. Гиллеспи также использовал кислотную систему для образования электронодефицитных неорганических катионов. Название возникло после рождественской вечеринки в 1966 году, когда сотрудник лаборатории Olah поставил парафин свечу в кислоту, и обнаружил, что она растворяется довольно быстро. Рассмотрение решения с 1H-ЯМР показал терт-бутил-катион, что свидетельствует о том, что парафиновая цепь, образующая воск, была расщеплена, а затем изомеризована в относительно стабильный третичный карбокатион.[3] Имя появилось в статье, опубликованной лабораторией Olah.
Характеристики
Структура
Хотя молярное соотношение HSO 1: 13F и SbF5 best генерирует ионы карбония, эффекты системы при других молярных соотношениях также были задокументированы. Когда соотношение SbF5: HSO3F меньше 0,2, следующие два состояния равновесия, определяемые 19Спектроскопия ЯМР F, наиболее заметны в растворе:
(В обеих этих структурах сера имеет тетраэдрическую координацию, а не планарную. Двойные связи между серой и кислородом более правильно представить как одинарные связи, причем формальный отрицательные заряды на атомах кислорода и формальный плюс два заряда на сере. Атомы сурьмы также будут иметь формальный заряд минус один.)
На приведенном выше рисунке на равновесие I приходится 80% данных ЯМР, а на равновесие II приходится около 20%. При увеличении соотношения двух соединений от 0,4 до 1,4 появляются новые сигналы ЯМР, интенсивность которых увеличивается с увеличением концентрации SbF.5. Разрешение сигналов также снижается из-за увеличения вязкости жидкой системы.[4]
Сила
Все протонообразующие кислоты сильнее 100% серной кислоты считаются суперкислотами и характеризуются низкими значениями Функция кислотности Гаммета. Например, серная кислота, H2ТАК4, имеет функцию кислотности Гаммета, ЧАС0, из −12, хлорная кислота, HClO4, имеет функцию кислотности Гаммета, равную -13, и кислотную систему 1: 1, HSO3F · SbF5, составляет −23. Фторантимоновая кислота, самая сильная из известных суперкислот, как полагают, достигает экстраполированного ЧАС0 значения до -28.
Использует
Наблюдения за стабильными карбокатионами
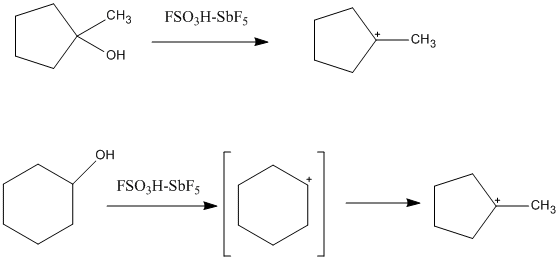
Магическая кислота имеет низкую нуклеофильность, что обеспечивает повышенную стабильность карбокатионов в растворе. «Классический» трехвалентный карбокатион можно наблюдать в кислой среде, и было обнаружено, что он плоский и sp2-гибридизированный. Поскольку углерод окружен всего шестью валентными электронами, он сильно электронодефицитный и электрофильный. Это легко описывается Точечные структуры Льюиса потому что он содержит только двухэлектронные, двухуглеродные связи. Многие третичные циклоалкильные катионы также могут образовываться в надкислотных растворах. Одним из таких примеров является 1-метил-1-циклопентильный катион, который образуется как из циклопентана, так и из предшественника циклогексана. В случае циклогексан, циклопентильный катион образуется в результате изомеризации вторичного карбокатиона в третичный, более стабильный карбокатион. Также наблюдались ионы циклопропилкарбения, алкенильные катионы и катионы арения.
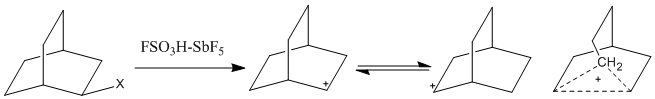
Однако по мере того, как система Magic acid стала более распространенной, наблюдались карбокатионы с более высокими координатами. Пентакоординатные карбокатионы, также описываемые как неклассические ионы, не могут быть изображены с использованием только двухэлектронных, двухцентровых связей и требуют, вместо этого, двухэлектронных, трех (или более) центральных связей. В этих ионах два электрона делокализованы более чем на два атома, что делает эти центры связи настолько электронно-дефицитными, что они позволяют насыщенным алканам участвовать в электрофильных реакциях.[1] Открытие сверхкоординированных карбокатионов вызвало споры о неклассических ионах в 1950-х и 60-х годах. Из-за медленной шкалы времени 1H-ЯМР, быстро уравновешивающие положительные заряды на атомах водорода, вероятно, останутся незамеченными. Тем не мение, ИК-спектроскопия, Рамановская спектроскопия, и 1313 C ЯМР был использован для исследования мостиковых карбокатионных систем. Один спорный катион, норборнил-катион, был обнаружен в нескольких средах, в том числе в Magic acid.[5]
Мостиковый атом углерода метилена пентакоординирован, с тремя двухэлектронными двухцентровыми связями и одной двухэлектронной трехцентровой связью с оставшейся sp.3 орбитальный. Квантово-механические расчеты также показали, что классическая модель не является энергетическим минимумом.[5]
Реакции с алканами
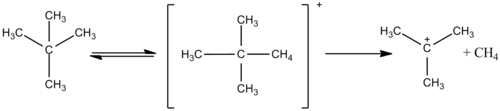
Волшебная кислота способна протонировать алканы. Например, метан реагирует с образованием CH+
5 ион при 140 ° C и атмосферном давлении, хотя некоторые ионы углеводородов с большей молекулярной массой также образуются как побочные продукты. Еще одним побочным продуктом реакции является газообразный водород.
В присутствии ФСО3D, а не FSO3H, метан, как было показано, обменивает атомы водорода на атомы дейтерия, и выделяется HD, а не H2. Это свидетельствует о том, что в этих реакциях метан действительно является основанием и может принимать протон из кислой среды с образованием CH+
5. Затем этот ион депротонируется, объясняя водородный обмен, или теряет молекулу водорода с образованием CH+
3 - ион карбония. Этот вид довольно реактивен и может давать несколько новых карбокатионов, показанных ниже.[6]
Алканы большего размера, такие как этан, также вступают в реакцию с магической кислотой, и оба обмениваются атомами водорода и конденсируются с образованием более крупных карбокатионов, таких как протонированный неопентан. Затем этот ион расщепляется при более высоких температурах и реагирует с выделением газообразного водорода и образует катион трет-амила при более низких температурах.
Именно на этой ноте Джордж Олах предлагает нам больше не брать в качестве синонимов названия «алкан» и «парафин». Слово «парафин» происходит от латинского «parum affinis», что означает «лишенный сродства». Он говорит: «Однако мы даем эту рекомендацию с некоторой ностальгией, поскольку« инертные газы »по крайней мере сохранили свое« благородство », поскольку их химическая реакционная способность стала очевидной, но упоминание« благородных углеводородов »было бы неуместным. "[6]
Катализ гидропероксидами
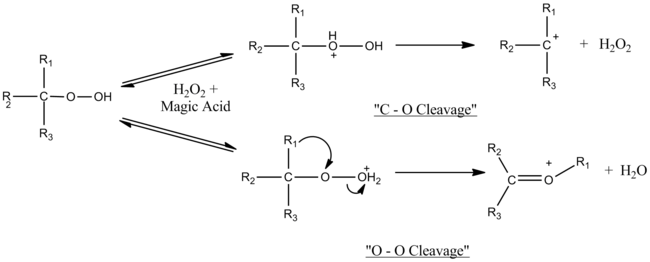
Магическая кислота катализирует реакции расщепления-перегруппировки третичных гидропероксидов и третичных спиртов. Характер экспериментов, используемых для определения механизма, а именно тот факт, что они проводились в сверхкислой среде, позволил наблюдать образование промежуточных соединений карбокатиона. Было установлено, что механизм зависит от количества используемой волшебной кислоты. Вблизи молярной эквивалентности наблюдается только расщепление O – O, но с увеличением избытка магической кислоты расщепление C – O конкурирует с расщеплением O – O. Избыток кислоты, вероятно, дезактивирует перекись водорода, образующуюся при гетеролизе C – O.[7]
Магическая кислота также катализирует электрофильное гидроксилирование ароматических соединений перекисью водорода, что приводит к получению моногидроксилированных продуктов с высоким выходом. Фенолы существуют в виде полностью протонированных частиц в суперкислотных растворах, и, когда они образуются в реакции, затем дезактивируются для дальнейшей электрофильной атаки. Протонированная перекись водорода является активным гидроксилирующим агентом.[8]
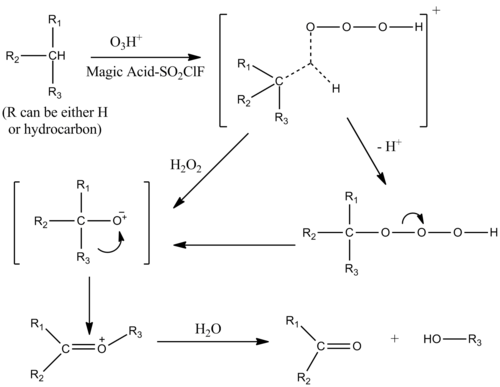
Катализ озоном
Окисление алканов может катализироваться волшебной кислотой – SO2Раствор ClF в присутствии озон. Механизм аналогичен протолизу алканов с электрофильным встраиванием в одинарные σ-связи алкана. Переходное состояние углеводород-озоновый комплекс представляет собой пентакоординированный ион.[9]
Спирты, кетоны и альдегиды насыщаются кислородом также путем электрофильного введения.[10]
Безопасность
Как и в случае со всеми сильными кислотами, особенно с суперкислотами, следует использовать соответствующие средства индивидуальной защиты. В дополнение к обязательным перчаткам и очкам также рекомендуется использовать маску для лица и респиратор, закрывающий все лицо. Как и следовало ожидать, волшебная кислота очень токсична при проглатывании и вдыхании, вызывает серьезные ожоги кожи и глаз, а также токсична для водных организмов.
Смотрите также
- Фторантимоновая кислота, сильнейшая суперкислота
Рекомендации
- ^ а б c Олах, Г. А. (2005). «Преодоление условных границ за полвека исследований». Журнал органической химии. 70 (7): 2413–2429. Дои:10.1021 / jo040285o. PMID 15787527.
- ^ Лесни, М. С. (март 2003 г.). «Основная история кислоты - от Аристотеля до Арнольда» (PDF). Сегодняшний химик за работой: 47–48.
- ^ Olah, G. A .; Пракаш, С .; Молнар, А .; Соммер, Дж. (2009). Суперкислотная химия (2-е изд.). Нью-Йорк: Джон Уайли и сыновья. п. 49. ISBN 978-0-471-59668-4.
- ^ Commeyras, A .; Олах, Г. А. (1969). "Химия в суперкислотах. II. Ядерный магнитный резонанс и лазерное рамановское спектроскопическое исследование системы растворителей пентафторид сурьмы-фтористоводородной кислоты (диоксида серы)" ("Волшебная кислота"). Влияние добавленных галогенидов, воды, спиртов и карбоновых кислот. Исследование иона гидроксония ». Журнал Американского химического общества. 91 (11): 2929–2941. Дои:10.1021 / ja01039a019.
- ^ а б Олах, Г. А. (1973). «Карбокатионы и электрофильные реакции». Angewandte Chemie International Edition. 12 (3): 173–254. Дои:10.1002 / anie.197301731.
- ^ а б Olah, G. A .; Шлосберг, Р. Х. (1968). «Химия в суперкислотах. I. Водородный обмен и поликонденсация метана и алканов в FSO.3H-SbF5 («Волшебная кислота») Раствор. Протонирование алканов и промежуточность CH+
5 и родственные ионы углеводородов. Высокая химическая активность парафинов в ионных реакциях в растворах ». Журнал Американского химического общества. 90 (10): 2726–2727. Дои:10.1021 / ja01012a066. - ^ Olah, G. A .; Паркер, Д.Г .; Yoneda, Y .; Пелицца, Ф. (1976). «Оксифункционализация углеводородов. 1. Протолитические реакции расщепления-перегруппировки третичных алкилгидропероксидов с магической кислотой». Журнал Американского химического общества. 98 (8): 2245–2250. Дои:10.1021 / ja00424a038.
- ^ Olah, G. A .; Охниши, Р. (1978). «Оксифункционализация углеводородов. 8. Электрофильное гидроксилирование бензола, алкилбензолов и галогенбензолов перекисью водорода в суперкислотах». Журнал органической химии. 43 (5): 865–867. Дои:10.1021 / jo00399a014.
- ^ Olah, G. A .; Yonena, N .; Охниши, Р. (1976). «Оксифункционализация углеводородов. 6. Электрофильное оксигенация алифатических спиртов, кетонов и альдегидов озоном в суперкислотах. Получение бифункциональных производных». Журнал Американского химического общества. 98 (23): 7341–7345. Дои:10.1021 / ja00439a038.
- ^ Olah, G. A .; Yoneda, N .; Паркер, Д. Г. (1976). «Оксифункционализация углеводородов. 3. Окисление алканов, катализируемое сверхкислотой, озоном с участием протонированного озона, O3ЧАС+". Журнал Американского химического общества. 98 (17): 5261–5268. Дои:10.1021 / ja00433a035.