WikiDer > Митохондриальный биогенез
Митохондриальный биогенез это процесс увеличения клеток митохондриальный масса.[1][2] Впервые он был описан Джоном Холлоши в 1960-х годах, когда было обнаружено, что физическое тренировка на выносливость индуцировал более высокий уровень содержания митохондрий, что привело к большему поглощению глюкозы мышцами.[3] Митохондриальный биогенез активируется множеством различных сигналов во время клеточного стресса или в ответ на раздражители окружающей среды, такие как упражнение аэробики.[1][2][4]
Фон
Способность митохондрии к самовоспроизведению коренится в ее эволюционной истории. Принято считать, что митохондрии происходят от клеток, которые сформировали эндосимбиотический отношения с α-протобактерии, у них есть собственный геном для репликации.[5] Однако недавние данные свидетельствуют о том, что митохондрии могли развиваться без симбиоза.[6] Митохондрия является ключевым регулятором метаболической активности клетки, а также важной органеллой как в производстве, так и в деградации свободных радикалов.[7] Предполагается, что более высокое число копий митохондрий (или более высокая митохондриальная масса) защищает клетку.
Митохондрии образуются в результате транскрипции и трансляции генов как в ядерном геноме, так и в митохондриальный геном. Большая часть митохондриального белка происходит из ядерного генома, в то время как митохондриальный геном кодирует части электронная транспортная цепь вместе с митохондриальной рРНК и тРНК. Биогенез митохондрий увеличивает метаболические ферменты для гликолиза, окислительного фосфорилирования и, в конечном итоге, увеличивает метаболическую способность митохондрий. Однако в зависимости от доступных энергетических субстратов и РЕДОКС-состояния клетки клетка может увеличивать или уменьшать количество и размер митохондрий.[8] Важно отметить, что количество и морфология митохондрий варьируются в зависимости от типа клеток и контекстно-зависимой потребности, при этом баланс между слиянием / делением митохондрий регулирует распределение, морфологию и функцию митохондрий.[9][8]
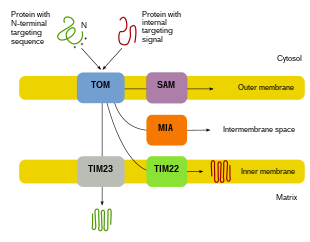
Импорт белка
Поскольку большая часть митохондриального белка поступает из ядерного генома, белки должны быть правильно нацелены и транспортироваться в митохондрии для выполнения своих функций.[8][10][11] Сначала мРНК транслируется в цитозоле клетки.[10][11] Полученные в результате развернутые белки-предшественники затем смогут достичь своих соответствующих митохондриальных компартментов.[11][10] Белки-предшественники будут транспортироваться в одну из четырех областей митохондрий, которые включают внешнюю мембрану, внутреннюю мембрану, межмембранное пространство и матрикс.[10][11] Все белки попадут в митохондрии с помощью транслоказы на внешней митохондриальной мембране (TOM).[11][10][12] Некоторые белки будут иметь N-концевой направленный сигнал, и эти белки будут обнаружены и транспортированы в матрицу, где они затем будут расщепляться и складываться.[13][11][10] Другие белки могут иметь информацию о нацеливании в своих последовательностях и не будут включать N-концевой сигнал.[11][10] За последние два десятилетия исследователи обнаружили более тридцати белков, которые участвуют в импорте митохондриальных белков.[11] По мере того как исследователи узнают больше об этих белках и о том, как они достигают соответствующих митохондриальных компартментов, которые их используют, становится очевидным, что существует множество процессов, которые работают вместе в клетке, обеспечивая митохондриальный биогенез.[11][8]
Синтез и деление
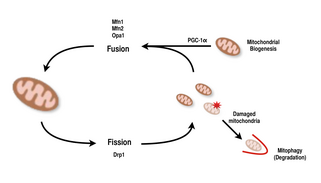
Митохондрии очень универсальны и способны изменять свою форму в результате деления и слияния.[9][8] Определенно, деление - это событие разрыва одного объекта, тогда как слияние - это событие объединения двух или более объектов в единое целое.[8] Процессы деления и слияния противостоят друг другу и позволяют митохондриальной сети постоянно реконструировать себя.[9][8] Если стимул вызывает изменение баланса деления и слияния в клетке, он может значительно изменить митохондриальную сеть.[9][14] Например, увеличение деления митохондрий привело бы к образованию множества фрагментированных митохондрий, что, как было показано, полезно для устранения поврежденных митохондрий и для создания митохондрий меньшего размера для эффективной транспортировки в энергоемкие области.[14][15] Следовательно, достижение баланса между этими механизмами позволяет клетке иметь правильную организацию своей митохондриальной сети во время биогенеза и может играть важную роль в адаптации мышц к физиологическому стрессу.[14]
У млекопитающих слияние и деление митохондрий контролируются GTPases семейства динаминов.[8][14] Процесс деления митохондрий направляется Drp1, член семейства цитозольных динаминов.[8][9] Этот белок образует спираль вокруг митохондрий и сжимается, разрушая как внешнюю, так и внутреннюю мембраны органеллы.[15] С другой стороны, процесс слияния направляется разными заякоренными в мембранах белками динамина на разных уровнях митохондрий.[14] Слияние на уровне внешней митохондриальной мембраны опосредуется Mfn1 и Mfn2 (Митофузины 1 и 2),[16] а слияние на уровне внутренней митохондриальной мембраны опосредуется Opa1.[8][13][14] Многочисленные исследования показали коррелированное увеличение дыхательной способности митохондрий с экспрессией генов Mfn1, Mnf2 и Drp1 после упражнений на выносливость.[15][16] Таким образом, предполагается, что реорганизация митохондриальной сети в мышечных клетках играет важную роль в ответ на упражнения.[4][14][16]
Регулирование
PGC-1α, член семейства рецепторов, активируемых пролифератором пероксисом гамма (PGC) коактиваторы транскрипции, это главный регулятор митохондриального биогенеза.[1][2][17] Известно, что он коактивирует ядерный респираторный фактор 2. (NRF2 / GABPA), и вместе с NRF-2 коактивирует ядерный респираторный фактор 1 (NRF1).[16][17] NRF, в свою очередь, активируют митохондриальный фактор транскрипции А. (tfam), который непосредственно отвечает за транскрипцию кодируемых ядром митохондриальных белков.[16][17] Сюда входят как структурные митохондриальные белки, так и белки, участвующие в транскрипция, трансляция и восстановление мтДНК.[17] PGC-1β, белок, структурно похожий на PGC-1α, также участвует в регуляции митохондриального биогенеза, но отличается тем, что не увеличивается в ответ на упражнения.[12][18][17] Хотя было обнаружено значительное увеличение митохондрий в тканях, в которых сверхэкспрессируется PGC-1α, поскольку кофактор взаимодействует с этими ключевыми факторами транскрипции, нокаутные мыши с нарушенным PGC-1α все еще жизнеспособны и показывают нормальное количество митохондрий.[18][12][17] Таким образом, PGC-1α не требуется для нормального развития митохондрий у мышей, но в условиях физиологического стресса эти мыши проявляют пониженную толерантность по сравнению с мышами с нормальным уровнем PGC-1α.[12][17][18] Точно так же у мышей с нокаутом с нарушенным PGC-1β у мышей в основном наблюдались нормальные уровни митохондриальной функции с пониженной способностью адаптироваться к физиологическому стрессу.[19][12] Однако эксперимент с двойным нокаутом PGC-1α / β привел к появлению мышей, которые умерли в основном в течение 24 часов из-за дефектов созревания митохондрий сердечной ткани.[20] Эти данные свидетельствуют о том, что хотя и PGC-1α, и PGC-1β не определяют способность клетки самостоятельно выполнять митохондриальный биогенез, вместе они могут дополнять друг друга для оптимального созревания и функционирования митохондрий в периоды физиологического стресса.[20][12][18]
AMP-активированная киназа (AMPK) также регулирует митохондриальный биогенез путем фосфорилирования и активации PGC-1α при ощущении дефицита энергии в мышцах.[12][17] Было показано, что у мышей со сниженным соотношением АТФ / АМФ, которое может происходить во время упражнений, истощение энергии коррелирует с активацией AMPK.[12][19][17] Затем активация AMPK продолжала активировать PGC-1α и NRF у этих мышей, и митохондриальный биогенез стимулировался.[12][19][17]
Старение
Было показано, что способность митохондрий к биогенезу снижается с возрастом, и такое снижение митохондриальной функции было связано с диабетом и сердечно-сосудистыми заболеваниями.[21][22][23] Старение и болезнь могут вызывать изменения в уровнях экспрессии белков, участвующих в механизмах деления и слияния митохондрий, создавая таким образом дисфункциональные митохондрии.[24][25] Одна из гипотез о пагубных последствиях старения связана с потерей теломеры, концевые сегменты хромосом, которые защищают генетическую информацию от деградации.[22][25] Утрата теломер также связана со снижением функции митохондрий.[25][22] Дефицит обратная транскриптаза теломеразы (TERT)Фермент, который играет роль в сохранении теломер, коррелирует с активированным p53, белком, который подавляет PGC-1α.[25][24][22] Следовательно, потеря теломер и TERT, связанная со старением, связана с нарушением биогенеза митохондрий.[22][24][25] Экспрессия AMPK также снижается с возрастом, что также может способствовать подавлению митохондриального биогенеза.[12][25]
Рекомендации
- ^ а б c Валеро Т (2014). «От редакции (тематический выпуск: биогенез митохондрий: фармакологические подходы)». Текущий фармацевтический дизайн. 20 (35): 5507–5509. Дои:10.2174/138161282035140911142118. HDL:10454/13341. PMID 24606795.
- ^ а б c Санчис-Гомар Ф., Гарсиа-Хименес Дж. Л., Гомес-Кабрера М.С., Паллардо Ф.В. (2014). «Митохондриальный биогенез в здоровье и болезни. Молекулярные и терапевтические подходы». Текущий фармацевтический дизайн. 20 (35): 5619–33. Дои:10.2174/1381612820666140306095106. PMID 24606801.
- ^ Holloszy JO (апрель 2011 г.). «Регуляция митохондриального биогенеза и экспрессия GLUT4 с помощью упражнений». Комплексная физиология. 1 (2): 921–40. Дои:10.1002 / cphy.c100052. ISBN 9780470650714. PMID 23737207.
- ^ а б Бушель Р., Лундби С., Квортруп К., Сахлин К. (октябрь 2014 г.). «Митохондриальная пластичность при тренировках и экстремальных условиях». Обзоры упражнений и спортивных наук. 42 (4): 169–74. Дои:10.1249 / JES.0000000000000025. PMID 25062000.
- ^ Жорнайваз Ф. Р., Шульман Г. И. (2010). «Регуляция митохондриального биогенеза». Очерки биохимии. 47: 69–84. Дои:10.1042 / bse0470069. ЧВК 3883043. PMID 20533901.
- ^ Хариш А., Курляндская CG (декабрь 2017 г.). «Митохондрии - это не бактерии в неволе». Журнал теоретической биологии. 434: 88–98. Дои:10.1016 / j.jtbi.2017.07.011. PMID 28754286.
- ^ Bevilacqua L, Ramsey JJ, Hagopian K, Weindruch R, Harper ME (май 2004 г.). «Влияние краткосрочного и среднесрочного ограничения калорий на утечку митохондриальных протонов в мышцах и производство активных форм кислорода». Американский журнал физиологии. Эндокринология и метаболизм. 286 (5): E852-61. Дои:10.1152 / ajpendo.00367.2003. PMID 14736705.
- ^ а б c d е ж грамм час я j Мишра П., Чан, округ Колумбия (февраль 2016 г.). «Метаболическая регуляция митохондриальной динамики». Журнал клеточной биологии. 212 (4): 379–87. Дои:10.1083 / jcb.201511036. ЧВК 4754720. PMID 26858267.
- ^ а б c d е Bertholet AM, Delerue T., Millet AM, Moulis MF, David C, Daloyau M, et al. (Июнь 2016). «Динамика слияния / деления митохондрий в нейродегенерации и нейрональной пластичности». Нейробиология болезней. 90: 3–19. Дои:10.1016 / j.nbd.2015.10.011. PMID 26494254.
- ^ а б c d е ж грамм Дудек Дж., Релинг П., Ван дер Лаан М. (февраль 2013 г.). «Импорт митохондриального белка: общие принципы и физиологические сети». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1833 (2): 274–85. Дои:10.1016 / j.bbamcr.2012.05.028. PMID 22683763.
- ^ а б c d е ж грамм час я Бейкер MJ, Фрейзер AE, Gulbis JM, Ryan MT (сентябрь 2007 г.). «Митохондриальный механизм импорта белка: коррелирующая структура с функцией». Тенденции в клеточной биологии. 17 (9): 456–64. Дои:10.1016 / j.tcb.2007.07.010. PMID 17825565.
- ^ а б c d е ж грамм час я j Жорнайваз Ф. Р., Шульман Г. И. (2010). «Регуляция митохондриального биогенеза». Очерки биохимии. 47: 69–84. Дои:10.1042 / bse0470069. ЧВК 3883043. PMID 20533901.
- ^ а б Вентура-Клапье Р., Гарнье А., Векслер В. (июль 2008 г.). «Транскрипционный контроль митохондриального биогенеза: центральная роль PGC-1alpha». Сердечно-сосудистые исследования. 79 (2): 208–17. Дои:10.1093 / cvr / cvn098. PMID 18430751.
- ^ а б c d е ж грамм Youle RJ, van der Bliek AM (август 2012 г.). «Митохондриальное деление, слияние и стресс». Наука. 337 (6098): 1062–5. Дои:10.1126 / наука.1219855. ЧВК 4762028. PMID 22936770.
- ^ а б c Бо Х, Чжан И, Джи Л.Л. (июль 2010 г.). «Новое определение роли митохондрий в упражнениях: динамическое ремоделирование». Летопись Нью-Йоркской академии наук. 1201: 121–8. Дои:10.1111 / j.1749-6632.2010.05618.x. PMID 20649548.
- ^ а б c d е Картони Р., Леже Б., Хок М.Б., Праз М., Креттенанд А., Пич С. и др. (Август 2005 г.). «Экспрессия митофузинов 1/2 и ERRalpha увеличивается в скелетных мышцах человека после физических упражнений». Журнал физиологии. 567 (Pt 1): 349–58. Дои:10.1113 / jphysiol.2005.092031. ЧВК 1474174. PMID 15961417.
- ^ а б c d е ж грамм час я j Джохри А., Чандра А., Флинт Бил М. (сентябрь 2013 г.). «PGC-1α, митохондриальная дисфункция и болезнь Хантингтона». Свободная радикальная биология и медицина. 62: 37–46. Дои:10.1016 / j.freeradbiomed.2013.04.016. ЧВК 3722269. PMID 23602910.
- ^ а б c d Lin J, Wu PH, Tarr PT, Lindenberg KS, St-Pierre J, Zhang CY и др. (Октябрь 2004 г.). «Дефекты адаптивного энергетического метаболизма с гиперактивностью, связанной с ЦНС, у мышей без PGC-1alpha». Клетка. 119 (1): 121–35. Дои:10.1016 / j.cell.2004.09.013. PMID 15454086.
- ^ а б c Scarpulla RC (июль 2011 г.). «Метаболический контроль митохондриального биогенеза через регуляторную сеть семейства PGC-1». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1813 (7): 1269–78. Дои:10.1016 / j.bbamcr.2010.09.019. ЧВК 3035754. PMID 20933024.
- ^ а б Лай Л., Леоне Т.К., Зехнер К., Шеффер П.Дж., Келли С.М., Фланаган Д.П. и др. (Июль 2008 г.). «Коактиваторы транскрипции PGC-1alpha и PGC-lbeta контролируют перекрывающиеся программы, необходимые для перинатального созревания сердца». Гены и развитие. 22 (14): 1948–61. Дои:10.1101 / gad.1661708. ЧВК 2492740. PMID 18628400.
- ^ Handy DE, Loscalzo J (июнь 2012 г.). «Редокс-регуляция митохондриальной функции». Антиоксиданты и редокс-сигналы. 16 (11): 1323–67. Дои:10.1089 / ars.2011.4123. ЧВК 3324814. PMID 22146081.
- ^ а б c d е Дэвид Р. (апрель 2011 г.). «Старение: митохондрии и теломеры соединяются». Обзоры природы. Молекулярная клеточная биология. 12 (4): 204. Дои:10.1038 / nrm3082. PMID 21407239.
- ^ Hagen TM, Wehr CM, Ames BN (ноябрь 1998 г.). «Митохондриальный распад при старении. Обращение вспять через добавление ацетил-L-карнитина и N-трет-бутил-альфа-фенилнитрона». Летопись Нью-Йоркской академии наук. 854: 214–23. Дои:10.1111 / j.1749-6632.1998.tb09904.x. PMID 9928432.
- ^ а б c Сахин Э., Колла С., Лиза М., Мослехи Дж., Мюллер Флорида, Гуо М. и др. (Февраль 2011 г.). «Дисфункция теломер вызывает метаболические и митохондриальные нарушения». Природа. 470 (7334): 359–65. Дои:10.1038 / природа09787. ЧВК 3741661. PMID 21307849.
- ^ а б c d е ж Сахин Э., ДеПиньо РА (май 2012 г.). «Ось старения: теломеры, р53 и митохондрии». Обзоры природы. Молекулярная клеточная биология. 13 (6): 397–404. Дои:10.1038 / nrm3352. ЧВК 3718675. PMID 22588366.
дальнейшее чтение
- Смит Дж. А., Сталлонс Л. Дж., Коллиер Дж. Б., Чавин К. Д., Шнельманн Р. Г. (февраль 2015 г.). «Подавление митохондриального биогенеза через толл-подобный рецептор 4-зависимой митоген-активируемой протеинкиназы киназы / регулируемой внеклеточными сигналами киназы при остром поражении почек, вызванном эндотоксином». Журнал фармакологии и экспериментальной терапии. 352 (2): 346–57. Дои:10.1124 / jpet.114.221085. ЧВК 4293437. PMID 25503387.
- Кэмерон РБ, Бисон СС, Шнельманн Р.Г. (декабрь 2016 г.). «Разработка терапевтических средств, которые индуцируют биогенез митохондрий для лечения острых и хронических дегенеративных заболеваний». Журнал медицинской химии. 59 (23): 10411–10434. Дои:10.1021 / acs.jmedchem.6b00669. ЧВК 5564430. PMID 27560192.
- Уитакер RM, Corum D, Beeson CC, Schnellmann RG (2016). «Митохондриальный биогенез как фармакологическая мишень: новый подход к острым и хроническим заболеваниям». Ежегодный обзор фармакологии и токсикологии. 56: 229–49. Дои:10.1146 / annurev-pharmtox-010715-103155. PMID 26566156.