WikiDer > Фенилуксусная кислота
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Фенилуксусная кислота | |
| Систематическое название ИЮПАК Фенилэтановая кислота | |
| Идентификаторы | |
3D модель (JSmol) | |
| 3DMet | |
| 1099647 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.002.862 |
| Номер ЕС |
|
| 68976 | |
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C8ЧАС8О2 | |
| Молярная масса | 136,15 г / моль |
| Плотность | 1,0809 г / см3 |
| Температура плавления | От 76 до 77 ° C (от 169 до 171 ° F, от 349 до 350 K) |
| Точка кипения | 265,5 ° С (509,9 ° F, 538,6 К) |
| 15 г / л | |
| Кислотность (пKа) | 4,31 (H2O)[1] |
| -82.72·10−6 см3/ моль | |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H318, H319 | |
| P264, P280, P305 + 351 + 338, P310, P337 + 313 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные соединения | Бензойная кислота, Фенилпропановая кислота, Коричная кислота |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
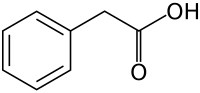
Фенилуксусная кислота (PAA; сопряженное основание фенилацетат), также известный как различные синонимы, является органическое соединение содержащий фенил функциональная группа и карбоновая кислота функциональная группа. Это белое твердое вещество с сильным медовым оттенком. запах. Эндогенно, это катаболит из фенилаланин. Как коммерческий химикат, потому что его можно использовать для незаконного производства фенилацетон (используется при изготовлении замещенные амфетамины), это подлежит контроль в странах, включая Соединенные Штаты и Китай.[2]
Имена
Синонимы включают α-толуиловая кислота, бензолуксусная кислота, альфа-толиловая кислота, 2-фенилуксусная кислота, и β-фенилуксусная кислота.
Вхождение
Было обнаружено, что фенилуксусная кислота является активным ауксин (тип гормон растения),[3] найдены преимущественно в фрукты. Однако его действие намного слабее, чем действие основной молекулы ауксина. индол-3-уксусная кислота. Кроме того, молекула естественным образом вырабатывается метаплевральной железой большинства видов муравьев и используется в качестве противомикробного средства. Это также продукт окисления фенэтиламин у людей после метаболизма моноаминоксидаза и последующий метаболизм промежуточного продукта, фенилацетальдегид, посредством альдегиддегидрогеназа фермент; эти ферменты также обнаружены во многих других организмах.
Подготовка
Это соединение может быть получено гидролиз из бензилцианид:[4][5]
Приложения
Фенилуксусная кислота используется в некоторых духи, так как он обладает медовый-подобно запах даже в низком концентрации. Он также используется в пенициллин G производство и диклофенак производство. Он также используется для лечения гипераммониемии II типа, чтобы помочь уменьшить количество аммиака в кровотоке пациента за счет образования фенилацетил-КоА, который затем вступает в реакцию с богатым азотом глутамином с образованием фенилацетилглютамин. Затем это соединение выводится из организма пациента. Он также используется в незаконном производстве фенилацетон, который используется при изготовлении метамфетамин.
Натрий соль фенилуксусной кислоты, фенилацетат натрия, используется в качестве фармацевтического препарата для лечения нарушения цикла мочевины, в том числе как комбинированный препарат фенилацетат натрия / бензоат натрия (Аммонул).[6]
Фенилуксусная кислота используется при приготовлении нескольких фармацевтических препаратов, в том числе Камилофин, бендазол, триафунгин, фенацемид, лоркаинид, фениндион, и циклопентолат.[нужна цитата]
Смотрите также
Рекомендации
- ^ Хейнс, Уильям М., изд. (2016). CRC Справочник по химии и физике (97-е изд.). CRC Press. п. 5–89. ISBN 978-1498754286.
- ^ «Список регулируемых химических веществ-прекурсоров в Китае». Архивировано из оригинал 17 августа 2015 г.. Получено 27 апреля 2015.
- ^ Wightman, F .; Лайти, Д. Л. (1982). «Идентификация фенилуксусной кислоты как природного ауксина в побегах высших растений». Physiologia Plantarum. 55 (1): 17–24. Дои:10.1111 / j.1399-3054.1982.tb00278.x.
- ^ Адамс Р .; Тал, А. Ф. (1922). «Фенилуксусная кислота». Органический синтез. 2: 59.CS1 maint: несколько имен: список авторов (ссылка на сайт); Коллективный объем, 1, п. 436
- ^ Веннер, В. (1952). «Фенилацетамид». Органический синтез. 32: 92.; Коллективный объем, 4, п. 760
- ^ «Монография по фенилацетату и бензоату натрия для профессионалов». Drugs.com. Получено 16 ноября 2019.


