WikiDer > Реакции медьорганических реагентов
Реакции медьорганических реагентов вовлекать разновидность содержащие медь-углеродные связи, действующие как нуклеофилы в присутствии органических электрофилы. Медьорганические реагенты теперь широко используются в органический синтез как мягкие, селективные нуклеофилы для реакций замещения и конъюгированного присоединения.[1]
С момента открытия, что галогениды меди (I) катализировать сопряженное добавление Реактивы Гриньяра в 1941 г.,[2] Медьорганические реагенты возникли как слабоосновные, нуклеофильные реагенты для реакций замещения и присоединения. Состав медьорганических соединений зависит от метода их получения, и различные виды медьорганических реагентов проявляют разные свойства. профили реактивности. В результате диапазон реакций с участием медьорганических реагентов чрезвычайно широк.
- Медноорганические комплексы (RCu) образуются при объединении галогенида меди (I) и литийорганического соединения. В сочетании с Льюис кислый добавки, такие как трифторид бора эфират, эти реагенты используются для реакций присоединения конъюгатов.[3]
- Купраты низшего порядка (Р2CuLi, также известный как Реактивы Гилмана) результат обработки медьорганических комплексов эквивалентом литийорганический. Альтернативно, они могут быть образованы обработкой галогенида меди (I) двумя эквивалентами литийорганического соединения. Они претерпевают реакции замещения, сопряженного присоединения и карбокупрации в присутствии соответствующих органических субстратов.[4] Смешанные реагенты Гилмана состоят из двух разных R-групп, одна из которых обычно является непередаваемой «фиктивной» группой.
- Цианокупраты низшего порядка (RCu (CN) Li) аналогичным образом получают из литийорганического соединения и цианид меди (I); однако промежуточные медноорганические комплексы не образуются во время этой реакции, и поэтому необходим только один эквивалент литийорганического реагента.[1] Цианокупраты подвергаются SN2 'замещение в присутствии аллильных электрофилов и реакции сопряженного присоединения в присутствии Enones.
- Цианокупраты высшего порядка (Р2Cu (CN) Li2) образуются при взаимодействии двух эквивалентов литийорганического соединения с цианид меди (I). Эти реагенты более реактивны по отношению к замещению, чем соответствующие цианокупраты более низкого порядка.[5]
Механизм и стереохимия
Реакции замещения
Механизм нуклеофильного замещения органокупратами низшего порядка во многом зависит от структуры субстрата, органокупрата и условий реакции. Ранние данные предполагали, что прямая SN2 смещения происходили;[6] однако более поздние результаты предполагают, что имеет место обратное окислительное присоединение меди (I) к связи уходящей углеродной группы с образованием промежуточного соединения меди (III), которое затем подвергается восстановительному отщеплению с образованием связанного продукта.[7] Оба эти механизма предсказывают инверсию электрофильного углерода, которая наблюдается в ряде случаев.[8] С другой стороны, эксперименты с радикальными ловушками и наблюдение рацемизация во время замещения предполагают радикальный механизм.[9]
(1)

Реакции сопряженного добавления
В 1941 году Хараш обнаружил, что Реактивы Гриньяра добавляют к циклогексенону в присутствии Cu (I), что приводит к 1,4-присоединению вместо 1,2-присоединения.[10] Эта работа предвещала обширные исследования сопряженные добавки к Enones с органокупратами. Обратите внимание, что если Реактив Гриньяра (например, RMgBr), реакция с еноном вместо этого будет протекать через 1,2-присоединение. Механизм 1,4-присоединения купратов к енонам заключается в нуклеофильном присоединении разновидностей Cu (I) к бета-углероду алкена с образованием промежуточного соединения Cu (III) с последующим восстановительным отщеплением Cu (I).[11] В исходной статье, описывающей эту реакцию, метилмагнийбромид реагирует с изофорон с добавлением 1 мольного процента и без него хлорид меди (I) (см. рисунок).[10]
Без добавления соли основные продукты алкоголь B (42%) из нуклеофильное присоединение к карбонильной группе и диен C (48%) как его реакция дегидратации товар. С добавлением соли основным продуктом является 1,4-аддукт. А (82%) с некоторыми C (7%).
Также возможно 1,6-добавление, например, на одной стадии промышленного производства фулвестрант:[12]
Энантиоселективные варианты
Реакции диастереоселективного присоединения конъюгатов хиральных органокупратов обеспечивают β-функционализированные кетоны с высоким выходом и диастереоселективностью. Недостатком этих реакций является необходимость полного эквивалента энантиочистка исходный материал.[13]
(3)

Совсем недавно были разработаны каталитические энантиоселективные методы, основанные на катализируемом медью (I) сопряженном присоединении реакций Гриньяра к енонам. Предлагаемый механизм включает трансметалляцию из реактива Гриньяра в медь, добавление конъюгата и определяющее скорость восстановительное удаление (см. Аналогичный верхний путь в уравнении (2)).[14]
(4)
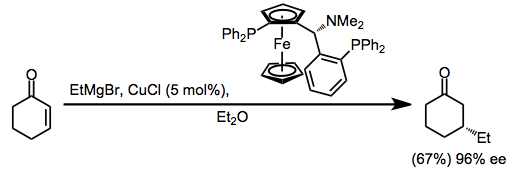
Каталитические реакции
Виниловый и арильный реагенты Гриньяра связываются с первичными алкилгалогенидами в присутствии каталитического количества галогенидной соли меди (I). Использование Ли2CuCl4 Вместо простых солей галогенида меди (I) (CuX) выход этих реакций сочетания улучшается.[15]
(5)

Добавление реактивов Гриньяра к алкинам облегчается каталитическим количеством галогенида меди. Трансметалляция до меди и карбокупрация сопровождаются трансметаллированием продукта. алкен вернуться к магний. Дополнение син если координирующая группа не находится поблизости в субстрате, в этом случае добавление становится анти и урожайность улучшается.[16]
(6)

Стехиометрические реакции
Пропаргилметансульфинаты являются полезными субстратами для синтеза аллены из стехиометрических медноорганических комплексов. В этом случае комплексы образовывались на месте через комбинацию реактива Гриньяра, бромида меди (I) и бромида лития. Медноорганические комплексы очень часто требуют активации кислотой Льюиса для эффективной реакции; бромид магния генерируется на месте в этом случае служит активирующей кислотой Льюиса.[17]
(7)
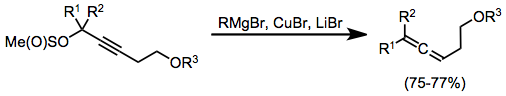
Комплексы алкенил-меди, легко образующиеся посредством карбокупрации, полезны для введения винильной группы в β-положение карбонильного соединения. В этом случае, как указано выше, бромид магния служит в качестве активирующей кислоты Льюиса.[18]
(8)

Эпоксид открытие органокупратов очень избирательно для менее затрудненного положения. Замещение происходит при полной инверсии конфигурации электрофильного углерода.[19]
(9)
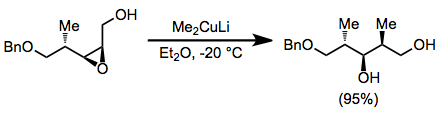
Обычно органокупраты реагируют с аллильными электрофилами в анти SN2 мода. В приведенной ниже реакции наблюдалась почти полная инверсия конфигурации, несмотря на присутствие второго стереоцентра в кольце.[20]
(10)

Сопряженное добавление органокупратов широко используется в органическом синтезе. Купраты винилового эфира служат в качестве удобных ацильный анион эквиваленты в реакциях сопряженного присоединения к енонам. Полученные простые эфиры енола могут быть гидролизованы до 1,4-дикетонов, которые трудно получить с помощью традиционной химии карбонила.[21]
(11)

Использование добавок в сочетании со стехиометрическим количеством медноорганических комплексов увеличивает скорость и выход многих реакций. В частности, медноорганические комплексы медленно реагируют в отсутствие кислоты Льюиса. Хотя бромид магния генерирует на месте от реакции реактивов Гриньяра и галогенидов меди (I) эту роль могут выполнять (см. выше), также могут использоваться внешние кислоты Льюиса. В присутствии эфирата трифторида бора медноорганические комплексы могут добавляться к стерически перегруженным енонам с умеренным выходом (осуществление такого же преобразования с органокупратом было бы затруднительно).[22]
(12)
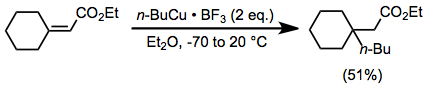
Эфират трифторида бора также полезен в качестве добавки в реакциях цианкупратов более высокого порядка. Использование 2-тиенильной группы в качестве «фиктивного» заместителя в цианокупрате позволяет сохранить потенциально ценный литийорганический реагент, используемый для образования цианкупрата (поскольку в медьсодержащих побочных продуктах присутствует только фиктивная группа). В отсутствие эфирата трифторида бора в этом случае реакции не наблюдали.[23]
(13)
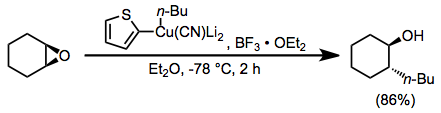
Реакции присоединения конъюгатов цианокупратов высшего порядка представляют собой еще одно полезное применение эфирата трифторида бора. Виниловая группа в этой реакции переносится избирательно; это отличается от реакций замещения с использованием того же реагента, которые приводят к селективному переносу метильной группы.[24]
(14)

Алкилирование аминов
Вторичные амины можно алкилировать купратами. Реакция основана на окислительном связывании амида лития-алкилмеди, который, как сообщается, образуется in situ во время реакции между диалкилкупратами лития и первичными или вторичными амидами.[25]
Синтетические приложения
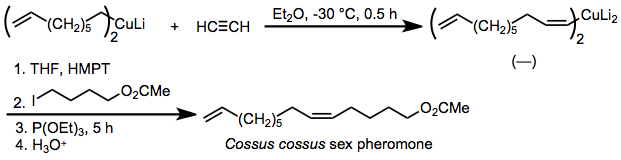
Поскольку стереоселективность карбокупрации чрезвычайно высока, эта реакция была применена для синтеза феромоны в котором геометрическая чистота двойные связи имеет решающее значение. Одним из примеров является феромон насекомых Cossus Cossus, который синтезируется син-селективная карбокупрация ацетилен и алкилирование полученного органокупрата в присутствии добавленного фосфита.[26]
(15)
Рекомендации
- ^ а б Lipshutz, B.H .; Сенгупта, С. Орг. Реагировать. 1992, 41, 135. Дои:10.1002 / 0471264180.or041.02
- ^ Kharasch, M. S .; Тоуни, П. О. Варенье. Chem. Soc. 1941, 63, 2308.
- ^ Кансал, В. К .; Тейлор, Р. Дж. К. J. Chem. Soc. Perkin Trans. 1 1984, 703.
- ^ Познер, Г. Х. Орг. Реагировать. 1975, 22, 253.
- ^ Lipshutz, B.H .; Wilhelm, R. S .; Флойд, Д. М. Варенье. Chem. Soc. 1981, 103, 7672.
- ^ Тамура, М .; Кочи, Дж. К. J. Organomet. Chem. 1972, 42, 205.
- ^ Кори, Э. Дж .; Боаз, Н.В. Tetrahedron Lett. 1984, 25, 3059.
- ^ Johnson, C. R .; Дутра, Г.А. Варенье. Chem. Soc. 1973, 95, 7777.
- ^ Ashby, E.C .; Коулман, Д. J. Org. Chem. 1987, 52, 4554.
- ^ а б c Kharasch, M. S .; Тоуни, П. О. (1941). «Факторы, определяющие протекание и механизмы реакций Гриньяра. II. Влияние металлических соединений на реакцию между изофороном и метилмагнием бромидом». Журнал Американского химического общества. 63 (9): 2308–2316. Дои:10.1021 / ja01854a005. ISSN 0002-7863.
- ^ Накамура, Эйити; Мори, Сейджи (2000). «Зачем ты медь? Структуры и механизмы реакции кластеров купратов в органической химии». Angewandte Chemie. 39 (21): 3750–3771. Дои:10.1002 / 1521-3773 (20001103) 39:21 <3750 :: AID-ANIE3750> 3.0.CO; 2-L. PMID 11091452.
- ^ Фулвестрант: от лаборатории к производству в промышленных масштабах Ева Дж. Брейзер, Филип Дж. Хоган, Чиу В. Люнг, Энн О'Керни-Макмаллан, Элисон К. Нортон, Лин Пауэлл, Грэм Э. Робинсон и Эмир Г. Уильямс Исследования и разработки органических процессов 2010, 14, 544 –552 Дои:10.1021 / op900315j
- ^ Malmberg, H .; Nilsson, M .; Уллениус, К. Tetrahedron Lett. 1982, 23, 3823.
- ^ Арутюнян, С .; Лопес, Ф .; Браун, В .; Correa, A .; Peña, D .; Badorrey, R .; Meetsma, A .; Minnaard, A .; Феринга, Б.Л. Варенье. Chem. Soc. 2006, 128, 9103.
- ^ Нуномото, S .; Kawakami, Y .; Ямасита, Ю. J. Org. Chem. 1983, 48, 1912.
- ^ Жуссом, B. Ph.D. Диссертация, Университет Бордо, Франция, 1977 г.
- ^ Kleijn, H .; Elsevier, C.J .; Westmijze, H .; Meijer, J .; Вермеер, П. Tetrahedron Lett. 1979, 3101.
- ^ Марфат, А .; McGuirk, P.R .; Хелквист, П. J. Org. Chem. 1979, 44, 3888.
- ^ Johnson, M. R .; Наката, Т .; Киши, Y. Tetrahedron Lett. 1979, 4343.
- ^ Геринг, Х.Л .; Кантнер, С.С. J. Org. Chem. 1981, 46, 2144.
- ^ Boeckman, R.K .; Рамая, М. J. Org. Chem. 1977, 42, 1581.
- ^ Yamamoto, Y .; Ямамото, S .; Yatagai, S .; Ishihara, Y .; Маруяма, К. J. Org. Chem. 1982, 47, 119.
- ^ Lipshutz, B.H .; Паркер, Д. А .; Козловски, Дж. А .; Нгуен, С.Л. Tetrahedron Lett. 1984, 25, 5959.
- ^ Lipshutz, B.H .; Wilhelm, R. S .; Козловский, Ю.А. J. Org. Chem. 1984, 49, 3938.
- ^ Yamamoto, H .; Марука, К. (1980). «Новое N-алкилирование аминов медьорганическими реагентами». J. Org. Chem. 45: 2739–2740. Дои:10.1021 / jo01301a048.
- ^ Cahiez, G .; Алексакис, А .; Норман, Дж. Ф. Tetrahedron Lett. 1978, 2027.
![Добавление метилмагнийбромида к изофорону. [10]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/97/Coppercatalyzedenonegrignardaddition.png/400px-Coppercatalyzedenonegrignardaddition.png)

