WikiDer > Карбонат рубидия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Карбонат рубидия | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.008.666 |
PubChem CID | |
| Номер RTECS |
|
| |
| |
| Характеристики | |
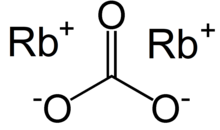
| Руб.2CO3 | |
| Молярная масса | 230,945 г / моль |
| Внешность | Белый порошок, очень гигроскопичный |
| Температура плавления | 837 ° С (1539 ° F, 1110 К)[1] |
| Точка кипения | 900 ° С (1650 ° F, 1170 К) (разлагается) |
| Очень растворим | |
| −75.4·10−6 см3/ моль | |
| Опасности | |
| Главный опасности | Раздражающий |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другой катионы | Карбонат лития Карбонат натрия Карбонат калия Карбонат цезия |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Карбонат рубидия, Руб.2CO3, представляет собой удобное соединение рубидий; он стабилен, не обладает особой реакционной способностью и легко растворяется в воде, и является формой, в которой рубидий обычно продается.
Подготовка
Его можно приготовить, добавив карбонат аммония к гидроксид рубидия.[2]
Использует
Он используется в некоторых видах стеклоделия, повышая стабильность и долговечность, а также снижая его проводимость. Он также используется как часть катализатора для получения короткоцепочечных спиртов из исходного газа.[3]
Рекомендации
- ^ Прадёт Патнаик. Справочник неорганических химикатов. Макгроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Чисхолм, Хью, изд. (1911). . Британская энциклопедия. 23 (11-е изд.). Издательство Кембриджского университета. п. 809.
- ^ Патенты Канады
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |