WikiDer > Тиоацеталь
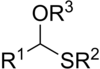
Тиоацетали являются сера аналоги из ацетали. Есть два класса: монотиоацетали и дитиоацетали. Монотиоацетали встречаются реже, имеют функциональную группу RC (OR ') (SR ") H. Дитиоацетали имеют формулу RC (SR ')2H (симметричные дитиоацетали) и RC (SR ') (SR ") H (асимметричные дитиоацетали).[1]
Симметричные дитиоацетали относительно обычны. Их получают путем конденсации тиолы или дитиолы с альдегидами. Эти реакции протекают через посредство гемитиоацетали:
- Добавление тиола с образованием гемитиоацеталя: RSH + R'CH (O) → R'CH (SR) (OH)
- Добавление тиола с потерей воды с образованием дитиоацеталя: RSH + R'CH (OH) SR → R'CH (SR)2 + H2О
В таких реакциях обычно используется либо Кислота Льюиса или Кислота Бренстеда так как катализатор.
Дитиоацетали, полученные из альдегидов и либо 1,2-этандитиол или 1,3-пропандитиол особенно распространены среди этого класса молекул для использования в органический синтез.[2]
Карбонильный углерод альдегида равен электрофильный и поэтому подвержены атакам со стороны нуклеофилы, тогда как аналогичный центральный углерод дитиоацеталя не является электрофильным. В результате дитиоацетали могут служить защитные группы для альдегидов.
Этот углерод не только не инертный, но и в реакции, отличной от реакции альдегидов. депротонированный чтобы сделать его нуклеофильным:
- R'CHS2C2ЧАС4 + R2NLi → R'CLiS2C2ЧАС4 + R2NH
Инверсия полярности между R '(H) Cδ += Oδ− и R'CLi (SR)2 упоминается как умполунг. Реакцию обычно проводят с использованием 1,3-дитиан. Литированный промежуточный продукт может быть использован для различных реакций образования нуклеофильных связей, а затем дитиокетальный гидролизованный обратно в его карбонильную форму. Этот общий процесс, Реакция Кори-Зеебаха, дает синтетический эквивалент ацильного аниона.
Смотрите также
использованная литература
- ^ ИЮПАК, Сборник химической терминологии2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "тиоацетали". Дои:10.1351 / goldbook.T06348
- ^ P. Stütz и P.A. Stadler "3-алкилированные и 3-ацилированные индолы из общего предшественника: 3-бензилиндол и 3-бензоилиндол" Org. Synth. 1977, 56, 8.Дои:10.15227 / orgsyn.056.0008