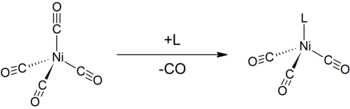WikiDer > Электронный параметр Толмана
В Электронный параметр Толмана (ТЭП) является мерой отдачи и отвода электронов лиганд. Определяется путем измерения частоты A1 C-O колебательная мода (ν (CO)) (псевдо) -C3в симметричный комплекс, [LNi (CO)3] к ИК-спектроскопия, где L - интересующий лиганд. [LNi (CO)3] был выбран в качестве модельного соединения, поскольку такие комплексы легко получить из тетракарбонилникель (0).[1][2] Сдвиг ν (CO) используется для вывода электронных свойств лиганда, которые могут помочь в понимании его поведения в других комплексах. Анализ был введен Чедвик А. Толмен.
А1 Карбонильная полоса редко закрывается другими полосами в инфракрасном спектре аналита. Карбонил - небольшой лиганд, поэтому стерические факторы не усложняют анализ. При координации CO с металлом ν (CO) обычно уменьшается от 2143 см−1 свободного CO. Этот сдвиг можно объяснить π обратное соединение: металл образует π-связь с карбонильным лигандом, отдавая электроны через свои d-орбитали в пустые π * антисвязывающие орбитали на CO. Это взаимодействие усиливает связь металл-углерод, но также ослабляет связь углерод-кислород, в результате более низкая частота колебаний. Если другие лиганды увеличивают плотность π-электронов на металле, связь C-O ослабляется и ν (CO) дополнительно уменьшается; и наоборот, если другие лиганды конкурируют с CO за обратное связывание π, ν (CO) увеличивается.
| L | ν (CO) см−1 |
|---|---|
| П (т-Бу)3 | 2056.1 |
| P (NMe2)3 | 2061.9 |
| PMe3 | 2064.1 |
| ПК6ЧАС4OMe)3 | 2066 |
| PPh3 | 2068.9 |
| ПК6ЧАС4F)3 | 2071.3 |
| Поэт)3 | 2076.3 |
| PCl3 | 2097.0 |
| ПФ3 | 2110.8 |
В Угол конуса Толмана и TEP использовались для характеристики стерических и электронных свойств фосфины, которые являются популярными лигандами для катализаторы.
При лечении, аналогичном анализу ТЕР, донорские свойства N-гетероциклический карбен (NHC) лиганды были ранжированы в соответствии с данными ИК, записанными на цис- [RhCl (NHC) (CO)2] комплексы.[3][4]
Смотрите также
Рекомендации
- ^ Роберт Х. Крэбтри (2005). Карбонилы, фосфиновые комплексы и реакции замещения лигандов. С. 87–124. Дои:10.1002 / 0471718769.ch4.
- ^ а б Толман, К. А. (1977). «Стерические эффекты фосфорных лигандов в металлоорганической химии и гомогенном катализе». Chem. Ред. 77 (3): 313–348. Дои:10.1021 / cr60307a002.
- ^ Нонненмахер, Майкл; Бак, Доминик М; Кунц, Дорис (23 августа 2016 г.). «Экспериментальные и теоретические исследования высокоэлектронодонорного характера пиридо-аннелированных N-гетероциклических карбенов». Журнал органической химии Байльштейна. 12: 1884–1896. Дои:10.3762 / bjoc.12.178. ЧВК 5082490.
- ^ Хюинь, Хан Винь (30 марта 2018 г.). «Электронные свойства N-гетероциклических карбенов и их экспериментальное определение». Химические обзоры. 118 (19): 9457–9492. Дои:10.1021 / acs.chemrev.8b00067.
дальнейшее чтение
- Тоннер, Ральф; Френкинг, Гернот (2009). "Электронные параметры Толмена для соединений двухвалентного углерода (0)". Металлоорганические соединения. 28 (13): 3901–3905. Дои:10.1021 / om900206w.
- Гусев, Дмитрий Г. (2009). «Электронные и стерические параметры 76 N-гетероциклических карбенов в Ni (CO)»3(NHC) ". Металлоорганические соединения. 28 (22): 6458–6461. Дои:10.1021 / om900654g.