WikiDer > Винилогия
Винилогия передача электронные эффекты через сопряженный органическая система склеивания.[1] Концепция была представлена в 1926 году компанией Людвиг Клайзен для объяснения кислотных свойств формилацетона и родственных кетоальдегидов.[2] Его прилагательная форма, винилогичный, используется для описания функциональные группы в котором стандартные фрагменты группы разделены двойной углерод-углеродной связью. Например, карбоновая кислота с двойной связью углерод-углерод (-HC = CH-, a "винил"фрагмент; фактически виниленовая группа) между карбонил группа и гидроксил группа упоминается как винилогичный карбоновая кислота.
Благодаря передаче электронной информации посредством спряжения, винилогичный функциональные группы часто обладают "аналогичный«реакционная способность или химические свойства по сравнению с исходной функциональной группой. Следовательно, винилогия является полезным эвристический для предсказания поведения систем, которые структурно подобны, но содержат промежуточные связи C = C, которые сопряжены с присоединенными функциональными группами. Например, ключевым свойством карбоновых кислот является их кислотность по Бренстеду. Простейшая карбоновая кислота, муравьиная кислота (HC (= O) –OH), представляет собой умеренно сильную органическую кислоту с pKа из 3.7. Мы ожидаем, что винилогичные карбоновые кислоты будут иметь аналогичную кислотность. Действительно, винилог муравьиной кислоты, 2-формил-1-этен-1-ола, HC (= O) –CH = CH – OH, имеет значительную кислотность по Бренстеду с оценкой pKа ~ 5–6. В частности, винилогенные карбоновые кислоты являются значительно более сильными кислотами, чем типичные енолы (стр.Kа ~ 12). Витамин С (аскорбиновая кислота, Смотри ниже) является биологически важным примером винилогенной карбоновой кислоты.
Вставка о- или же п-фенилен (т.е. бензольное кольцо в 1,2- или 1,4-ориентации) также приводит к некоторому сходству в реакционной способности (так называемой «фенилогии»), хотя эффект обычно слабее, поскольку конъюгация через арильное кольцо требует рассмотрения резонансных форм или промежуточных продуктов, в которых нарушена ароматичность.[3][4]

Винилогистая реакционная способность
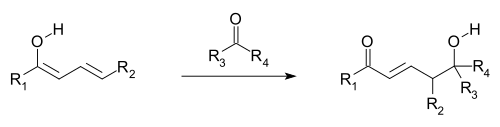
Считается, что винилогичные реакции возникают, когда орбитали двойных связей винильной группы и присоединенной электроноакцепторной группы (EWG; π-орбитали) выровнены и поэтому могут перекрываться и смешиваться (т.е. сопряженный). Электрон делокализация позволяет EWG получать электронную плотность за счет участия сопряженной системы. Винилогичные реакции также включают: сопряженные добавки, где нуклеофил реагирует на виниловом конце, а также на винилогичную вариацию альдольная реакция, где электрофил атакован нуклеофильным винилогидом энолировать (см. первое и следующее изображение). Винилогичный енолят реагирует в конечном положении системы двойных связей (γ-углерод), а не α-углерод, непосредственно примыкающий к карбонилу, как простой енолят. Аллильный электрофилы часто реагируют винилогичной атакой нуклеофила, а не прямым присоединением.
Еще один пример винилогичной реактивности: аскорбиновая кислота (Витамин C) ведет себя как винилогенная карбоновая кислота за счет участия ее карбонильной части, винильной группы внутри кольца и неподеленной пары на гидроксильной группе, действующей как сопряженная система. Кислотность гидроксильного протона на конце винильной группы в аскорбиновой кислоте более сопоставима с типичной карбоновой кислотой, чем с кислотностью. алкоголь потому что два основных резонансные структуры стабилизировать отрицательный заряд на сопряженное основание аскорбиновой кислоты (центральная и правая структуры на последнем изображении), аналогичные двум резонансным структурам, которые стабилизируют отрицательный заряд на анионе, который возникает в результате удаления протона из простой карбоновой кислоты (см. первое изображение).
дальнейшее чтение
- Лиссабон, Марилда П .; Hoang, Tung T .; Дадли, Грегори Б. (2011). «Тандемное нуклеофильное добавление / фрагментация винилогенных ацилтрифлатов: 2-метил-2- (1-оксо-5-гептинил) -1,3-дитиан». Органический синтез. 88: 353. Дои:10.15227 / orgsyn.088.0353.
Рекомендации
- ^ Реакция винилогичного альдола: ценный, но недооцененный маневр образования углерод-углеродных связей Джованни Казираги, Франка Занарди, Джованни Аппендино и Глория Рассу Chem. Ред. 2000; 100 (6) стр. 1929–1972; (Рассмотрение) Дои:10.1021 / cr990247i
- ^ Zu den O-Alkylderivated des Benzoyl-acetons und den aus ihnen entstehenden Isoxazolen. (Entgegnung an Hrn. O. Weygand.) Berichte der deutschen chemischen Gesellschaft (серии A и B), том 59, выпуск 2, дата: 10 февраля 1926 г., страницы: 144-153 L. Claisen. Дои:10.1002 / cber.19260590206
- ^ Ямасаки, Рю; Икеда, Хирокадзу; Масу, Хьюма; Адзумая, Исао; Сайто, Шиничи (2012-10-07). «Синтез и свойства фениловых амидов». Тетраэдр. 68 (40): 8450–8456. Дои:10.1016 / j.tet.2012.07.084. ISSN 0040-4020.
- ^ Лоуренс, Энтони Дж .; Хатчингс, Майкл Дж .; Кеннеди, Алан Р .; Макдуалл, Джозеф Дж. У. (05.02.2010). «Бензодифурантрион: стабильный фенилогенный енол». Журнал органической химии. 75 (3): 690–701. Дои:10.1021 / jo9022155. ISSN 0022-3263.
