WikiDer > Александр Дианин - Википедия
Александр Дианин | |
|---|---|
 | |
| Родившийся | 20 апреля 1851 г. |
| Умер | 6 декабря 1918 г. (67 лет) |
| Национальность | русский |
| Альма-матер | Йенский университет (кандидат наук по химии, 1877 г.) Императорская Медико-Хирургическая Академия в Санкт-Петербурге (MD, 1882) |
| Известен | Бисфенол А Соединение Дианина |
| Научная карьера | |
| Поля | Органическая химия |
| Учреждения | Императорская Медико-Хирургическая Академия в Санкт-Петербурге |
| Влияния | Александр Бородин Николай Зинин |
| Под влиянием | Фебус Левен[1] |
Александр Павлович Дианин (русский: Александр Павлович Дианин; 20 апреля 1851 г. - 6 декабря 1918 г.) русский химик из Санкт-Петербург. Он проводил исследования по фенолы и открыл фенол производная теперь известен как бисфенол А[2][3] и соответственно названный Соединение Дианина.[4] Был женат на приемной дочери коллеги-химика. Александр Бородин. В 1887 году Дианин сменил тестя на должности заведующего химическим отделением Императорской медико-хирургической академии в Санкт-Петербурге (ныне С.М. Кировская военно-медицинская академия).
Бисфенол А и соединение Дианина
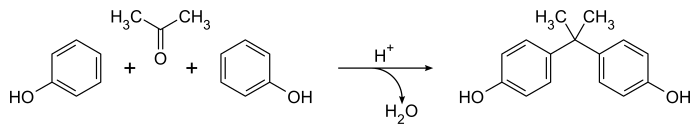
Способ приготовления Дианина бисфенол А с 1891 г.[2] остается наиболее широко известным подходом к этому важному соединению,[5] хотя этот метод был усовершенствован для синтеза в промышленном масштабе.[6] Это включает катализированный конденсация смеси 2: 1 фенол и ацетон в присутствии концентрированных соляная кислота или же серная кислота. Реакция легко протекает при комнатной температуре с образованием сырого продукта, содержащего большое количество побочных продуктов (включая Соединение Дианина) в считанные часы.[5] Общее уравнение простое, с водой как единственной побочный продукт:
Механически кислотный катализатор превращает ацетон в ион карбения который проходит электрофильное ароматическое замещение реакция с фенолом с образованием преимущественно параграф-замещенный товары. Вторая разновидность карбения образуется в результате протонирования и потери алифатического гидроксил группа, приводящая к бисфенолу А (4,4'-изопропилидендифенол) после второй реакции ароматического замещения. Процесс не очень селективный, известно большое количество второстепенных продуктов и побочных реакций.[5]
Побочные продукты, которые изомеры бисфенола А в результате образования орто-замещенные продукты и включают 2,2'- и 2,4'-изомеры изопропилидендифенола. Другие побочные реакции включают образование трифенол I, 4,4 '- (4-гидрокси-м-фенилендиизопропилиден) дифенол, от действия карбения электрофил на молекулу бисфенола А и образование трифенол II, 4,4 ', 4' '- (2-метил-2-пентанил-4-илиден) трифенол, когда реакция элиминации превращает карбений в реактивный олефин.[5] Катализированный димеризация ацетона через альдольная конденсация хорошо известно, и дает диацетоновый спирт и (по обезвоживание) оксид мезитила в обоих кислых[7] и основные условия.[8][9] В на месте при образовании мезитилоксида к смеси добавляется еще один реакционноспособный олефин. В случаях, когда олефиновый часть может взаимодействовать с фенольной гидроксильной группой (обычно в результате орто-замена), быстрый циклизация реакции, производящие флаваны и хроманы происходить.[5] Это источник соединения Дианина в смеси, и впоследствии Дианин продемонстрировал, что это соединение может быть получено с гораздо большим выходом путем непосредственной реакции фенола с мезитилоксидом.[4] Более поздняя работа показала, что производство бисфенола A можно сделать гораздо более селективным, если использовать реакционную смесь со значительным избытком фенола, а не с стехиометрический Состав 2: 1, сильно подавляющий побочные реакции.[6]
Рекомендации
- ^ Типсон, Р. Стюарт (1957). Вольфром, М.Л. (ред.). Феб Аарон Теодор Левен: 1869–1940. Некролог. Достижения в химии углеводов. 12. Нью-Йорк: Academic Press. С. 1–12. ISBN 9780080562711.
- ^ а б Дианин, А. П. (1891). "О продуктах конденсации кетонов с фенолами" [Конденсация кетонов с фенолами]. Журнал Русского Физико-Химического общества (J. Russ. Phys. Chem. Soc.) (на русском). 23: 488–517, 523–546, 601–611.
- ^ Зинке, Теодор (1905). "Ueber die Einwirkung von Brom und von Chlor auf Phenole: Substitutionsprodukte, Pseudobromide und Pseudochloride" [О действии брома и хлора на фенолы: продукты замещения, псевдобромиды и псевдохлориды]. Юстус Либигс Аннален дер Хеми (на немецком). 343: 75–99. Дои:10.1002 / jlac.19053430106.
- ^ а б Дианин, А. П. (1914). «Конденсация фенола с непредельными кетонами. Конденсация фенола с мезитилоксидом». Журнал Русского Физико-Химического общества (J. Russ. Phys. Chem. Soc.) (на русском). 36: 1310–1319.
- ^ а б c d е МакКетта, Джон Дж., изд. (1977). «Бисфенол А». Асфальтовая эмульсия для смешивания. Энциклопедия химической обработки и дизайна. 4. Марсель Деккер. С. 406–430. ISBN 9780824724542.
- ^ а б Фиеге, Гельмут; Фогес, Хайнц-Вернер; Хамамото, Тошиказу; Умемура, Сумио; Ивата, Тадао; Мики, Хисая; Фудзита, Ясухиро; Буйш, Ханс-Йозеф; Гарбе, Доротея; Паулюс, Уилфрид (2000). «Производные фенола». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a19_313. ISBN 3527306730.
- ^ Вайссермель, Клаус; Арпе, Ханс-Юрген (2003). «Вторичные продукты из ацетона». Промышленная органическая химия (4-е изд.). Джон Уайли и сыновья. С. 281–288. ISBN 9783527305780.
- ^ Конант, Джеймс Б.; Таттл, Нил (1921). «Диацетоновый спирт (2-пентан, 4-гидрокси-4-метил)». Орг. Synth. 1: 45. Дои:10.15227 / orgsyn.001.0045.; Coll. Vol., 1, п. 199
- ^ Конант, Джеймс Б.; Таттл, Нил (1921). «Мезитил оксид». Орг. Synth. 1: 53. Дои:10.15227 / orgsyn.001.0053.; Coll. Vol., 1, п. 345
дальнейшее чтение
- Дианин, Сергей Александрович (1980). Бородин. Вестпорт: Гринвуд Пресс. ISBN 9780313225291. OCLC 247826062.
- Фигуровский Николай Александрович; Соловьев, Юрий Иванович (1988). Александр Порфирьевич Бородин: биография химика. Нью-Йорк: Springer-Verlag. п. 22. ISBN 9780387178882. OCLC 16647830.