WikiDer > Цифровая микрофлюидика
Цифровая микрофлюидика (DMF) это еще одна платформа для систем «лаборатория на кристалле», основанная на манипуляции с микрокаплями. Капли распределяются, перемещаются, хранятся, смешиваются, реагируют или анализируются на платформе с набором изолированных электродов.[1][2] Цифровая микрофлюидика может использоваться вместе с процедурами аналитического анализа, такими как масс-спектрометрия, колориметрия, электрохимия и электрохемилюминесценция.[1]
Обзор
По аналогии с цифровой микроэлектроникой, цифровые микрофлюидные операции можно комбинировать и повторно использовать в рамках иерархических структур проектирования, чтобы сложные процедуры (например, химический синтез или биологические анализы) можно создавать шаг за шагом. И в отличие от проточного микрофлюидика, цифровая микрофлюидика[3] работает почти так же, как и традиционные настольные протоколы, только с гораздо меньшими объемами и гораздо более высокой степенью автоматизации. Таким образом, широкий спектр установленных химических процедур и протоколов может быть легко перенесен в нанолитр формат капли. Электросмачивание, диэлектрофорез, и потоки несмешивающейся жидкости - три наиболее часто используемых принципа, которые использовались для создания микрокапель и управления ими в цифровом микрофлюидном устройстве.
Настройка цифрового микрофлюидного (DMF) устройства зависит от используемых подложек, электродов, конфигурации этих электродов, использования диэлектрического материала, толщины этого диэлектрического материала, гидрофобных слоев и приложенного напряжения.[4][5]
Обычно используется подложка из стекла. В зависимости от того, является ли система открытой или закрытой, может быть один или два слоя стекла. Нижний слой устройства содержит набор индивидуально управляемых электродов с рисунком.[4] При взгляде на замкнутую систему обычно имеется непрерывный заземляющий электрод, проходящий через верхний слой, обычно изготовленный из оксида индия и олова (ITO). В диэлектрик Этот слой находится вокруг электродов в нижнем слое устройства и важен для накопления зарядов и градиентов электрического поля на устройстве.[5] На верхний слой системы наносится гидрофобный слой, чтобы уменьшить поверхностную энергию, с которой капля будет контактировать.[5] Приложенное напряжение активирует электроды и позволяет изменять смачиваемость капли на поверхности устройства. Чтобы переместить капля, элемент управления Напряжение применяется к электрод рядом с каплей, и в то же время электрод, находящийся прямо под каплей, отключается. Изменяя электрический потенциал вдоль линейного ряда электродов, электросмачивание может использоваться для перемещения капель по этой линии электродов.[6]
Модификации этого фундамента также могут быть включены в базовую конструкцию. Одним из примеров этого является добавление электрохемилюминесценция детекторы в слое оксида индия и олова (заземляющий электрод в замкнутой системе), которые помогают обнаруживать люминофоры в каплях.[7] В общем, для замены основных компонентов системы DMF могут также использоваться различные материалы, такие как использование PDMS вместо стекла для подложки.[8] В замкнутую систему можно добавлять жидкие материалы, такие как масло или другое вещество, для предотвращения испарения материалов и уменьшения поверхностного загрязнения.[6][9] Также системы DMF могут быть совместимы с ионная жидкость капель с использованием масла в закрытом устройстве или с использованием катены (подвешенной проволоки) над открытым устройством DMF.[9]
Цифровая микрофлюидика может быть активирована светом. Оптоэлектронное смачивание можно использовать для перевозки сидячие капли вокруг поверхности, содержащей узор фотопроводники.[10] В фотоэлектросмачивание эффект[11] может также использоваться для достижения переноса капель на кремниевой пластине без необходимости создания узорчатых электродов.[12]
Принцип работы
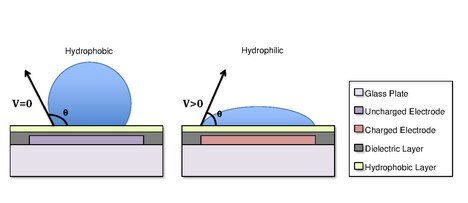
Капли образуются с помощью поверхностное натяжение свойства жидкости. Например, вода, помещенная на гидрофобную поверхность, такую как вощеная бумага, будет образовывать сферические капли, чтобы минимизировать ее контакт с поверхностью.[13] Различия в гидрофобности поверхностей влияют на способность жидкости растекаться и «смачивать» поверхность за счет изменения угол контакта.[14] Поскольку гидрофобность поверхности увеличивается, угол контакта увеличивается, а способность капли смачивать поверхность уменьшается. Изменение краевого угла смачивания и, следовательно, смачивания регулируется уравнением Юнга-Липпмана.[4][15][5]
куда угол контакта с приложенным напряжением ; - угол контакта без напряжения; относительный диэлектрическая проницаемость диэлектрика; это диэлектрическая проницаемость свободного пространства; - поверхностное натяжение жидкость / наполнитель; - толщина диэлектрика.[5]
В некоторых случаях гидрофобность подложки можно контролировать с помощью электрических полей. Имеется в виду явление Электросмачивание На диэлектрике (EWOD).[3][4][5] Например, когда к электроду не приложено электрическое поле, поверхность останется гидрофобной, и капля жидкости будет образовывать более сферическую каплю с большим углом контакта. При приложении электрического поля создается поляризованная гидрофильная поверхность. Затем капля воды становится плоской, и угол смачивания уменьшается. Контролируя локализацию этой поляризации, мы можем создать градиент межфазного натяжения, который позволяет контролировать перемещение капли по поверхности устройства DMF.[6]
Образование капель
Есть два способа сделать новые капли с помощью цифрового микрофлюидного устройства. Либо существующую каплю можно разделить на две части, либо новую каплю можно сделать из резервуара материала.[16] Оба процесса работают только на закрытых устройствах,[15][17] хотя часто это не проблема, поскольку верхние панели устройств DMF обычно съемные,[18] поэтому открытое устройство можно временно закрыть, если возникнет необходимость в образовании капель.
Из существующей капли
Каплю можно разделить, заряжая два электрода на противоположных сторонах капли на незаряженном электроде. Таким же образом капля на незаряженном электроде будет двигаться к соседнему заряженному электроду,[6] эта капля будет двигаться к обоим активным электродам. Жидкость движется в обе стороны, в результате чего середина капли оказывается на шее.[16] Для капли того же размера, что и электроды, расщепление произойдет примерно при , так как шея будет самой тонкой.[16] это радиус кривизны из мениски на шее, что отрицательно для вогнутой кривой, и - радиус кривизны менисков на удлиненных концах капли. Этот процесс прост и постоянно приводит к образованию двух капель равного объема.[16][19]
Обычный метод[20][16] разделение существующей капли простым включением и выключением разделяющих электродов дает новые капли относительно равного объема. Однако новые капли, образованные обычным способом, имеют значительную разницу в объеме.[21][22] Эта разница вызвана локальными возмущениями из-за быстрого переноса массы.[22] Несмотря на то, что в некоторых приложениях разница незначительна, она может создавать проблемы в приложениях, которые очень чувствительны к изменениям громкости.[23][24] такие как иммуноанализ[25] и амплификация ДНК.[26] Чтобы преодолеть ограничение обычного метода, существующую каплю можно разделить, постепенно изменяя потенциал электродов в области разделения, вместо того, чтобы просто включать и выключать их.[22] При использовании этого метода сообщалось о заметном улучшении вариации объема капель с примерно 10% вариации объема до менее 1% вариации объема.[22]
Из водоема
Создание новой капли из резервуара с жидкостью может быть выполнено аналогично разделению капли. В этом случае резервуар остается неподвижным, в то время как последовательность электродов используется для откачивания жидкости из резервуара. Эта втянутая жидкость и резервуар образуют горлышко жидкости, подобное горлышку разделяющейся капли, но более длинное, и при сжатии этой горловины образуется распределенная капля из вытянутой жидкости.[16][27] Однако, в отличие от разделения, нанесение капель таким способом несовместимо по масштабу и результатам. Нет надежного расстояния, на которое нужно будет вытянуть жидкость из резервуара, чтобы горлышко схлопнулось, если оно вообще разрушится.[28] Поскольку это расстояние варьируется, объемы распыляемых капель также будут различаться в одном устройстве.[28]
Из-за этих несоответствий были использованы и предложены альтернативные методы дозирования капель, включая вытягивание жидкости из резервуаров с геометрией, которая заставляет более тонкую горловину,[16][29] с использованием постоянного и пополняемого канала электросмачивания,[23] и перемещение резервуаров в углы, чтобы разрезать резервуар посередине.[19][29] Многократные итерации последнего могут создавать капли более управляемого размера.
Манипуляции с каплями
Слияние капель
Поскольку существующая капля может быть разделена на отдельные капли с помощью электродов (см. Из существующей капли),[20][16] Капли также могут быть объединены в одну с помощью электродов.[30][16] Используя ту же концепцию, которая применяется для создания новых капель путем разделения существующей капли электродами, водная капля, покоящаяся на незаряженном электроде, может перемещаться к заряженному электроду, где капли соединяются и сливаются в одну каплю.[30][16] Однако объединенная капля не всегда может образовывать круглую форму даже после завершения процесса объединения из-за поверхностного натяжения.[16] Эта проблема может быть решена путем создания супергидрофобной поверхности между каплями и электродами.[30] Таким же образом можно объединить масляные капли, но масляные капли будут двигаться к незаряженным электродам, в отличие от водных капель.[31]
Транспортировка капель
Дискретные капли могут транспортироваться строго контролируемым образом с помощью набора электродов.[32][33][31] Таким же образом капли перемещаются от незаряженного электрода к заряженному электроду, или наоборот, капли могут непрерывно перемещаться вдоль электродов путем последовательной подачи энергии на электроды.[34][31][16] Поскольку транспортировка капель включает в себя массив электродов, можно запрограммировать несколько электродов для выборочного приложения напряжения к каждому электроду для лучшего контроля над транспортировкой нескольких капель.[34]
Смещение электростатическим возбуждением
Приведение в действие трехмерных капель стало возможным благодаря реализации замкнутой системы; эта система содержит каплю размером мкл в несмешивающейся жидкой среде. Затем капля и среда помещаются между двумя электромагнитными пластинами, создавая электромагнитное поле между двумя пластинами.[35][36] Целью этого метода является перенос капли с нижней плоской поверхности на верхнюю параллельную плоскую поверхность и обратно вниз с помощью электростатических сил.[35][37] Физику такого срабатывания частиц и перпендикулярного движения можно понять из ранних работ Н. Н. Лебедева и И. П. Скальской.[38] В своих исследованиях они попытались смоделировать электрический заряд Максвелла, приобретаемый идеально круглой проводящей частицей в присутствии однородного магнитного поля, вызванного идеально проводящей и бесконечно растягивающейся поверхностью.[38] Их модель помогает предсказать движение микрокапель в устройстве в направлении Z, поскольку она указывает на величину и направление сил, действующих на микрокаплю. Это можно использовать для точного прогнозирования и коррекции нежелательного и неконтролируемого движения частиц. Модель объясняет, почему отсутствие диэлектрического покрытия на одной из двух поверхностей вызывает изменение заряда внутри капли при контакте с каждым электродом и, в свою очередь, вызывает неконтролируемое отскакивание капель между электродами.
Цифровая микрофлюидика (ДМФ) уже была легко адаптирована во многих биологических областях.[39]</ref>[40][41] Обеспечивая трехмерное движение в DMF, эту технологию можно еще более широко использовать в биологических приложениях, поскольку она может более точно имитировать трехмерное микроокружение. Большое преимущество использования этого типа метода заключается в том, что он позволяет получить доступ к двум различным средам для капли, что можно использовать, разделив микрофлюидные задачи между двумя поверхностями. Например, в то время как нижняя плоскость может использоваться для перемещения капель, верхняя пластина может выполнять необходимые химические и / или биологические процессы.[35] Это преимущество может быть воплощено в протоколах практических экспериментов в биологическом сообществе, таких как связывание с амплификацией ДНК.[42][37] Это также позволяет уменьшить размер чипа и предоставить исследователям больше свободы при разработке платформ для анализа микрокапель.[35]
Внедорожное срабатывание капель (ATDA)
Вездеходная микрофлюидика - это метод, используемый для транспортировки жидких капель по нетрадиционным поверхностям.[43] В отличие от традиционной платформы микрофлюидики, которая обычно ограничивается плоскими и горизонтальными поверхностями, ATDA позволяет управлять каплями на изогнутых, негоризонтальных и перевернутых поверхностях.[43] Это стало возможным благодаря включению в поверхность гибких тонких листов меди и полиимида с помощью метода быстрого прототипирования.[43][44] Это устройство очень хорошо работает со многими жидкостями, включая водные буферы, растворы белков и ДНК, а также неразбавленную бычью сыворотку.[43] ATDA совместим с силиконовым маслом или добавками плюроника, такими как F-68, которые уменьшают неспецифическое всасывание и биообрастание при работе с биологическими жидкостями, такими как белки, биологические сыворотки и ДНК.[43][45] Недостатком такой установки является ускоренное испарение капель.[43] ATDA - это форма открытой цифровой микрофлюидики, поэтому устройство должно быть помещено во влажную среду, чтобы минимизировать испарение капель.[46]
Выполнение
В одном из различных вариантов микрожидкостных биочипов на основе EWOD, впервые исследованных Cytonix в 1987 г. [1] и впоследствии коммерциализированный Advanced Liquid Logic, это две параллельные стеклянные пластины. Нижняя пластина содержит узорчатый массив индивидуально контролируемых электроды а верхняя пластина покрыта непрерывным заземляющий электрод. А диэлектрик изолятор покрытый гидрофобный добавляется к пластинам, чтобы уменьшить смачиваемость поверхности и добавить емкость между каплей и контрольным электродом. Капля, содержащая биохимические образцы и наполнитель, такой как силиконовое масло, фторированное масло или воздух зажаты между пластинами, и капли перемещаются внутри наполнителя. Чтобы переместить капля, элемент управления Напряжение применяется к электрод рядом с каплей, и в то же время электрод, находящийся прямо под каплей, отключается. Изменяя электрический потенциал вдоль линейного ряда электродов, электросмачивание может использоваться для перемещения капель по этой линии электродов.
Приложения
Разделение и экстракция
Цифровой микрофлюидика может использоваться для разделения и извлечения целевых аналитов. Эти методы включают использование магнитных частиц,[47][48][49][50][51][52][53][54] жидкость-жидкостная экстракция,[55] оптический пинцет,[56] и гидродинамические эффекты.[57]
Магнитные частицы
Для разделения магнитных частиц капля раствора, содержащего интересующий аналит, помещается на цифровой микрожидкостный датчик. электродная решетка и двигались изменениями зарядов электродов. Капля перемещается к электроду с магнитом на одной стороне массива с магнитными частицами, функционализированными для связывания с аналитом. Затем он перемещается по электроду, магнитное поле снимается, и частицы взвешиваются в капле. Капля закручивается на электродной решетке для обеспечения перемешивания. Магнит снова вводится, частицы иммобилизуются, а капля удаляется. Этот процесс повторяется с буферами для промывки и элюирования для извлечения аналита.[47][48][49][50][51][52][53][54]
Магнитные частицы, покрытые античеловеческим сывороточный альбумин Антитела были использованы для выделения сывороточного альбумина человека в качестве доказательства работы концепции иммунопреципитации с использованием цифровой микрофлюидики.5 Извлечение ДНК из образца цельной крови также выполнялось с помощью цифровой микрофлюидики.3 Процедура следует общей методологии, как и для магнитных частиц, но включает предварительную обработку на цифровой микрофлюидной платформе для лизировать клетки до экстракции ДНК.[49]
Жидкостно-жидкостная экстракция
Жидкостно-жидкостные экстракции может выполняться на цифровом микрофлюидном устройстве с использованием несмешивающихся жидкостей.9 Две капли, одна из которых содержит аналит в водной фазе, а другая - несмешивающуюся ионную жидкость, присутствуют на электродной решетке. Две капли смешиваются, и ионная жидкость извлекает аналит, и капли легко отделяются.[55]
Оптический пинцет
Оптический пинцет также использовались для разделения клеток на капли. Две капли смешиваются на электродной решетке: одна содержит клетки, а другая - питательные вещества или лекарства. Капли смешиваются, а затем с помощью оптического пинцета перемещаются клетки с одной стороны от более крупной капли, прежде чем она разделится.[58][56] Для более подробного объяснения основных принципов см. Оптический пинцет.
Гидродинамическое разделение
Частицы применялись для использования вне магнитной сепарации, с гидродинамическими силами для отделения частиц от основной массы капли.[57] Это выполняется на решетках электродов с центральным электродом и окружающими его «срезами» электродов. Капли добавляются к матрице и закручиваются по кругу, а гидродинамические силы завихрения заставляют частицы агрегироваться на центральном электроде.[57]
Химический синтез
Цифровая микрофлюидика (ДМФ) позволяет точно управлять и координировать мелкомасштабные реакции химического синтеза благодаря своей способности контролировать микромасштабные объемы жидких реагентов, что позволяет в целом сократить использование реагентов и количество отходов.[59] Эта технология может быть использована при синтезе таких соединений, как пептидомиметики и ДОМАШНИЙ ПИТОМЕЦ трассеры.[60][61][62] ДОМАШНИЙ ПИТОМЕЦ Для индикаторов требуются количества в нанограммах, и поэтому DMF позволяет автоматически и быстро синтезировать индикаторы с эффективностью 90-95% по сравнению с традиционными методами макромасштабирования.[61][63]
Органические реагенты обычно не используются в DMF, потому что они имеют тенденцию смачивать устройство DMF и вызывать затопление; однако синтез органических реагентов может быть осуществлен с помощью методов ДМФА путем переноса органических реагентов через каплю ионной жидкости, что предотвращает затопление органического реагента устройства ДМФ.[64] Капельки объединяются, вызывая противоположные заряды, притягивая их друг к другу.[65] Это позволяет автоматизировать смешивание капель. Смешивание капель также используется для нанесения Минфин кристаллы для печати путем доставки реагентов в лунки и испарения растворов для осаждения кристаллов.[66] Этот метод Минфин осаждение кристаллов относительно дешево и не требует обширного роботизированного оборудования.[66]
Культура клеток
Подключение микросхемы DMF для использования в полевых условиях или интерфейсов между микросхемой осуществлялось с помощью ручных насосов и резервуаров, которые доставляют микробы, клетки и среду на устройство.[67] Отсутствие обширных насосов и клапанов позволяет использовать сложные многоступенчатые приложения, в которых задействованы элементы, выполняемые в простой и компактной системе.[68] В одном применении микробные культуры были перенесены на чип и позволили им расти с использованием стерильных процедур и температуры, необходимой для инкубации микробов. Чтобы подтвердить, что это жизнеспособное пространство для роста микробов, анализ трансформации было выполнено в устройстве.[67] Это предполагает разоблачение Кишечная палочка к вектору и нагревают бактерии до тех пор, пока они не захватят ДНК. Затем следует запуск ДНК гель чтобы убедиться, что разыскиваемый вектор был поглощен бактериями. Это исследование показало, что ДНК действительно была поглощена бактериями и выражена, как и предполагалось.
Клетками человека также манипулировали в Digital Microfluidic. Иммуноцитохимия in Single Cells (DISC), где платформы DMF использовались для культивирования и использования антител для мечения фосфорилированных белков в клетке.[69] Затем культивированные клетки удаляют и снимают с чипа для скрининга. Другой метод позволяет синтезировать гидрогели на платформах DMF. В этом процессе используются электроды для доставки реагентов для получения гидрогельи доставка реагентов клеточных культур для абсорбции в гель.[62][45] В гидрогели являются улучшением по сравнению с 2D-культурой клеток, потому что 3D-культура клеток имеет повышенные межклеточные взаимодействия и взаимодействия межклеточного матрикса.[45] Сферические клеточные культуры - еще один метод, разработанный на основе способности DMF доставлять капли в клетки. Применение электрического потенциала позволяет автоматизировать перенос капель непосредственно в культуру висящих клеток.[62]][70] Это полезно, так как трехмерная культура клеток и сфероиды лучше имитировать ткань in vivo, позволяя создавать более биологически релевантные культуры, клетки которых растут во внеклеточном матриксе, аналогичном таковому в организме человека.[70] Еще одно применение платформ DMF в культуре клеток - это способность проводить in vitro бесклеточное клонирование с использованием одной молекулы ПЦР внутри капель.[71] ПЦР Затем амплифицированные продукты подтверждают трансфекцией в дрожжевые клетки и идентификацией белка вестерн-блоттингом.[71]
Проблемы, возникающие при применении в клеточных культурах с использованием DMF, включают белок адсорбция на пол устройства, и цитотоксичность в клетки. Чтобы предотвратить адсорбцию белка на полу платформы, поверхностно-активное вещество Стабилизированное силиконовое масло или гексан использовалось для покрытия поверхности устройства, а капли обрабатывались поверх масла или гексана.[69] Позже гексан был быстро испарен из культур, чтобы предотвратить токсическое действие на культуры клеток.[72] Другой подход к решению проблемы адгезии белков - добавление Плюроник добавки к каплям в аппарате.[73] Добавки плюроника обычно не цитотоксичны, но было показано, что некоторые из них вредны для культур клеток.[46]
Биологическая совместимость настройки устройства важна для биологических анализов. Наряду с поиском добавок Плюроника, которые не являются цитотоксическими, было выполнено создание устройства, напряжение и разрушающее движение которого не повлияли бы на жизнеспособность клеток. Посредством считывания анализов живых / мертвых было показано, что ни Напряжение требуется для перемещения капель, и движение движущихся культур не влияет на жизнеспособность клеток.[46]
Биологическая добыча
Биологическое разделение обычно включает пробы большого объема с низкой концентрацией. Это может стать проблемой для цифровой микрофлюидики из-за необходимого небольшого объема пробы.[50] Цифровые микрофлюидные системы можно комбинировать с макрожидкостными системами, предназначенными для уменьшения объема пробы, что, в свою очередь, увеличивает концентрацию аналита.[50] Он следует тем же принципам, что и магнитные частицы для разделения, но включает в себя перекачивание капли для циркуляции большего объема жидкости вокруг магнитных частиц.[50]Также сообщалось об извлечении аналитов из высушенных образцов мочи. Капля экстракционного растворителя, в данном случае метанола, многократно пропускается через образец высушенного образца мочи, затем перемещается к конечному электроду, где жидкость извлекается через капилляр и затем анализируется с помощью масс-спектрометрии.[74]
Иммуноанализы
Расширенные возможности цифровой микрофлюидики (DMF) для обработки жидкостей позволяют использовать DMF в качестве иммуноанализ Платформа, поскольку устройства DMF могут точно манипулировать небольшими количествами жидких реагентов. Как гетерогенные иммуноанализы (антигены, взаимодействующие с иммобилизованными антителами), так и гомогенные иммуноанализы (антигены, взаимодействующие с антителами в растворе) были разработаны с использованием платформы DMF.[75] Что касается гетерогенных иммуноанализов, DMF может упростить расширенные и интенсивные этапы процедуры, выполняя все этапы доставки, смешивания, инкубации и промывки на поверхности устройства (на чипе). Кроме того, существующие методы и методы иммуноанализа, такие как анализы на основе магнитных шариков, ELISA, и электрохимическое обнаружение, были включены в платформы иммуноанализа DMF.[76][77][78][79]
Включение анализов на основе магнитных шариков в платформу иммуноанализа DMF было продемонстрировано для обнаружения нескольких аналитов, таких как человеческий инсулин, Ил-6, кардиальный маркер тропонин I (cTnI), тиреотропный гормон (TSH), sTNF-RI и 17β-эстрадиол.[78][80][81][82] Например, подход на основе магнитных шариков был использован для обнаружения cTnI в цельной крови менее чем за 8 минут.[77] Вкратце, магнитные шарики, содержащие первичные антитела, смешивали с мечеными вторичными антителами, инкубировали и иммобилизовали с помощью магнита для этапов промывки. Затем капля смешивалась с хемилюминесцентным реагентом, и обнаружение сопутствующей ферментативной реакции измерялось на чипе с помощью фотоумножитель трубка.
Матрица ELISA, обычно используемая для проведения иммуноанализов и других биохимических анализов на основе ферментов, была адаптирована для использования с платформой DMF для обнаружения аналитов, таких как IgE и IgG.[83][84] В одном примере[76] Была проведена серия биоанализов для определения возможностей количественной оценки устройств DMF, включая иммуноферментный анализ на основе ELISA для обнаружения IgE. Суперпарамагнитные наночастицы были иммобилизованы анти-IgE-антителами и флуоресцентно меченными аптамерами для количественного определения IgE с использованием матрицы ELISA. Аналогичным образом, для обнаружения IgG, IgG можно иммобилизовать на чипе DMF, конъюгировать с IgG, меченным пероксидазой хрена (HRP), а затем количественно оценить путем измерения изменения цвета, связанного с образованием продукта реакции между HRP и тетраметилбензидином.[83]
Для дальнейшего расширения возможностей и применения иммуноанализа DMF за пределы колориметрический обнаружения (например, ELISA, анализы на основе магнитных шариков), инструменты электрохимического обнаружения (например, микроэлектроды) были включены в чипы DMF для обнаружения аналитов, таких как TSH и вирус краснухи.[79][85][86] Например, Rackus et al.[85] интегрировали микроэлектроды на поверхность чипа DMF и заменили ранее описанный хемилюминесцентный иммуноанализ IgG[87] с электроактивными видами, что позволяет обнаруживать вирус краснухи. Они покрыли магнитные шарики вирусом краснухи, IgG против краснухи и IgG человека в сочетании с щелочной фосфатазой, которая, в свою очередь, катализировала реакцию переноса электрона, которую детектировали встроенные микроэлектроды.
Масс-спектрометрии
Связь цифровой микрофлюидики (DMF) и Масс-спектрометрии в значительной степени можно разделить на косвенный автономный анализ, прямой автономный анализ и оперативный анализ[18] и основными преимуществами этого сочетания являются сокращение использования растворителей и реагентов, а также сокращение времени анализа.[88]
Косвенный автономный анализ - это использование устройств DMF для объединения реагентов и выделения продуктов, которые затем удаляются и вручную переносятся в масс-спектрометр. Этот подход использует ДМФА на этапе подготовки образца, но также создает возможности для загрязнения, поскольку для переноса образца требуется ручное вмешательство. В одном из примеров этой техники Трехкомпонентная конденсация Grieco проводили на чипе и снимали с чипа микропипеткой для гашения и дальнейшего анализа.[64]
Прямой автономный анализ - это использование устройств DMF, которые были изготовлены и частично или полностью встроены в масс-спектрометр. Этот процесс по-прежнему считается автономным, однако некоторые постреакционные процедуры могут выполняться вручную (но на микросхеме) без использования цифровых возможностей устройства. Такие устройства чаще всего используются в сочетании с МАЛДИ-МС. В устройствах прямого отключения на основе MALDI капля должна быть высушена и перекристаллизована вместе с матрицей - операции, которые часто требуют вакуумных камер.[18][89] Затем чип с кристаллизованным аналитом помещается в MALDI-MS для анализа. Одна проблема, возникающая при связывании MALDI-MS с DMF, заключается в том, что матрица, необходимая для MALDI-MS, может быть очень кислой, что может мешать реакциям на кристалле.[90]
Встроенный анализ - это использование устройств, которые подключаются непосредственно к масс-спектрометрам, что исключает любые ручные манипуляции. Для встроенного анализа могут потребоваться специально изготовленные устройства и соединительное оборудование между устройством и масс-спектрометром.[18] Встроенный анализ часто сочетается с ионизация электрораспылением. В одном примере микросхема DMF была изготовлена с отверстием, ведущим к микроканалу.[91] Этот микроканал, в свою очередь, был подключен к ионизатору с электрораспылением, который излучал непосредственно в масс-спектрометр. Интегрированные методы ионизации в окружающей среде, при которых ионы образуются вне масс-спектрометра с небольшой обработкой или без нее, хорошо сочетаются с открытой или полуоткрытой микрофлюидной природой ДМФ и обеспечивают легкое взаимодействие между системами ДМФ и МС. Методы окружающей ионизации, такие как ионизация поверхностными акустическими волнами (ПАВ), генерируют поверхностные волны на плоской пьезоэлектрической поверхности, которые передают достаточно акустической энергии на границу раздела с жидкостью, чтобы преодолеть поверхностное натяжение и десорбировать ионы с чипа в масс-анализатор.[92][18] В некоторых муфтах используется внешний источник высоковольтных импульсов на физическом входе в масс-спектрометр. [93] но истинная роль таких дополнений неясна.[94]
Существенным препятствием для широкой интеграции ДМФА с масс-спектрометрией является биологическое загрязнение, часто называемое биологическим обрастанием.[95] Высокопроизводительный анализ является значительным преимуществом при использовании систем DMF.[88] но это означает, что они особенно подвержены перекрестному заражению между экспериментами. В результате связывание ДМФА с масс-спектрометрией часто требует интеграции множества методов для предотвращения перекрестного загрязнения, таких как несколько этапов промывки,[96][97] биологически совместимые поверхностно-активные вещества,[98] и / или супергидрофобные поверхности для предотвращения адсорбции капель.[99][100] В одном примере снижение сигнала перекрестного загрязнения во время характеристики аминокислоты потребовало 4-5 этапов промывки между каждой каплей образца, чтобы интенсивность загрязнения упала ниже предела обнаружения.[97]
Миниатюрные масс-спектрометры
Обычные масс-спектрометры часто бывают крупными, а также чрезмерно дорогими и сложными в эксплуатации, что привело к повышенной привлекательности миниатюрных масс-спектрометров (MMS) для множества приложений. MMS оптимизированы с точки зрения доступности и простоты эксплуатации, часто не требующие наличия опытных технических специалистов, имеют низкую стоимость производства и достаточно малы по размеру, чтобы обеспечить передачу сбора данных из лаборатории в поле.[101] Эти преимущества часто достигаются за счет снижения производительности, когда разрешение MMS, а также пределы обнаружения и количественного определения часто недостаточны для выполнения специализированных задач. Интеграция DMF с MMS имеет потенциал для значительного улучшения систем MMS за счет увеличения пропускной способности, разрешения и автоматизации при одновременном снижении стоимости растворителя, что позволяет проводить лабораторный анализ при гораздо меньших затратах. В одном примере использование специальной системы DMF для тестирования мочи на наркотики позволило создать прибор весом всего 25 кг с производительностью, сопоставимой со стандартным лабораторным анализом.[102]
Спектроскопия ядерного магнитного резонанса
Спектроскопия ядерного магнитного резонанса (ЯМР) может использоваться вместе с цифровой микрофлюидикой (DMF) за счет использования микрокатушек ЯМР, которые представляют собой электромагнитные проводящие катушки размером менее 1 мм. Из-за своего размера эти микрокатушки имеют несколько ограничений, напрямую влияющих на чувствительность механизмов, в которых они работают.
Интерфейсы микроканал / микрокатушка, предшествовавшие цифровой микрофлюидике, имели несколько недостатков, например, в том, что многие из них создавали большое количество отходов растворителя и были легко загрязнены.[103][104] Таким образом, использование цифровой микрофлюидики и ее способности управлять синглетными каплями является многообещающим.
Интерфейс между цифровой микрофлюидикой и ЯМР релаксометрия привела к созданию систем, таких как те, которые используются для обнаружения и количественного определения концентраций определенных молекул в микромасштабе.[104] с некоторыми такими системами, использующими двухступенчатые процессы, в которых устройства DMF направляют капли к месту обнаружения ЯМР.[105] Также были разработаны вводные системы высокопольного ЯМР и 2D ЯМР в сочетании с микрофлюидикой.[103] В этих системах используются однопластинчатые устройства с ДМФА с ЯМР-микрокатушками вместо второй пластины.
Рекомендации
- ^ а б Шамси М.Х., Чой К., Нг А.Х., Чемберлен, доктор медицины, Уиллер А.Р. (март 2016 г.). «Электрохемилюминесценция на цифровой микрофлюидике для анализа микроРНК». Биосенсоры и биоэлектроника (Представлена рукопись). 77: 845–52. Дои:10.1016 / j.bios.2015.10.036. PMID 26516684.
- ^ "Duke Microfluidics Lab". microfluidics.ee.duke.edu. Получено 2017-05-22.
- ^ Ким CJ (ноябрь 2001 г.). Микронасос электросмачиванием. Proc. ASME Int. Конгресс-выставка машиностроения. Нью-Йорк, штат Нью-Йорк. IMECE2001 / HTD-24200.
- ^ а б c Джайн В., Деварасетти В., Патрикар Р. (июнь 2017 г.). «Влияние геометрии электрода на скорость капель в открытом устройстве на основе EWOD для цифровых микрофлюидических приложений». Журнал электростатики. 87: 11–18. Дои:10.1016 / j.elstat.2017.02.006.
- ^ а б c d е ж Чой К., Нг АХ, Фобель Р., Уиллер А.Р. (2012). «Цифровая микрофлюидика». Ежегодный обзор аналитической химии. 5: 413–40. Bibcode:2012ARAC .... 5..413C. Дои:10.1146 / annurev-anchem-062011-143028. PMID 22524226.
- ^ а б c d Ярмарка РБ, Хлыстов А., Портной Т.Д., Иванов В., Эванс Р.Д., Сринивасан В. и др. (2007-01-01). «Химические и биологические применения цифровых микрофлюидных устройств». Дизайн и тестирование компьютеров IEEE. 24 (1): 10–24. CiteSeerX 10.1.1.559.1440. Дои:10.1109 / MDT.2007.8. S2CID 10122940.
- ^ Шамси М.Х., Чой К., Нг А.Х., Чемберлен, доктор медицины, Уиллер А.Р. (март 2016 г.). «Электрохемилюминесценция на цифровой микрофлюидике для анализа микроРНК». Биосенсоры и биоэлектроника. 77: 845–52. Дои:10.1016 / j.bios.2015.10.036. PMID 26516684.
- ^ Чжао Ю., Сюй Т., Чакрабарти К. (01.07.2011). "Широковещательная адресация электродов и методы планирования для цифровых микрожидкостных биочипов с фиксированным штифтом". IEEE Transactions по автоматизированному проектированию интегральных схем и систем. 30 (7): 986–999. Дои:10.1109 / TCAD.2011.2116250. ISSN 0278-0070. S2CID 4159209.
- ^ а б Бертье Дж (2008). Микрокапли и цифровая микрофлюидика. Уильям Эндрю Паб. ISBN 9780815515449. OCLC 719878673.
- ^ Chiou PY, Moon H, Toshiyoshi H, Kim CJ, Wu MC (май 2003 г.). «Легкое срабатывание жидкости оптоэлектросмачиванием». Датчики и исполнительные механизмы A: физические. 104 (3): 222–8. Дои:10.1016 / S0924-4247 (03) 00024-4.
- ^ Арскотт S (2011). «Движение жидкостей со светом: фотоэлектросмачивание полупроводников». Научные отчеты. 1: 184. arXiv:1108.4935. Bibcode:2011НатСР ... 1Е.184А. Дои:10.1038 / srep00184. ЧВК 3240946. PMID 22355699.
- ^ Пальма С., Диган Р. Д. (март 2018 г.). «Капельный перевод, активируемый Photoelectrowetting». Ленгмюр: журнал ACS о поверхностях и коллоидах. 34 (10): 3177–3185. Дои:10.1021 / acs.langmuir.7b03340. PMID 29457909.
- ^ Гудман Дж. «Капли воды: сцепление и адгезия воды». www.appstate.edu. Получено 2017-05-21.
- ^ «Смачивание». web.mit.edu. Получено 2017-05-21.
- ^ а б Бертье Дж (2008). Микрокапли и цифровая микрофлюидика. Уильям Эндрю Паб. ISBN 9780815515449. OCLC 719878673.
- ^ а б c d е ж грамм час я j k л Чо СК, Мун Х, Ким СиДжей (февраль 2003 г.). «Создание, транспортировка, резка и слияние капель жидкости с помощью срабатывания на основе электросмачивания для цифровых микрожидкостных схем» (PDF). Журнал микроэлектромеханических систем. 12 (1): 70–80. Дои:10.1109 / JMEMS.2002.807467.
- ^ Чанг Дж., Ким Д., Пак Дж. Дж. (02.05.2011). «Упрощенное однопластинчатое электросмачивающее устройство наземного типа для транспортировки капель». Журнал электротехники и технологий. 6 (3): 402–407. Дои:10.5370 / JEET.2011.6.3.402. ISSN 1975-0102.
- ^ а б c d е Кирби А.Э., Уиллер А.Р. (июль 2013 г.). «Цифровая микрофлюидика: новая платформа подготовки проб для масс-спектрометрии». Аналитическая химия. 85 (13): 6178–84. Дои:10.1021 / ac401150q. PMID 23777536.
- ^ а б Те SY, Лин Р., Хунг Л. Х., Ли А. П. (февраль 2008 г.). «Капельная микрофлюидика». Лаборатория на чипе. 8 (2): 198–220. Дои:10.1039 / B715524G. PMID 18231657.
- ^ а б Поллак, Майкл Дж .; Ярмарка, Ричард Б .; Шендеров, Александр Д. (2000-09-11). «Электросмачивание срабатываний капель жидкости для микрофлюидных приложений». Письма по прикладной физике. 77 (11): 1725–1726. Дои:10.1063/1.1308534. ISSN 0003-6951.
- ^ Nikapitiya, N. Y. Jagath B .; Нахар, Мун Ман; Мун, Хеджин (16.06.2017). «Точное, последовательное и быстрое разделение и дозирование капель при электросмачивании диэлектрической цифровой микрофлюидики». Письма о микро- и нано-системах. 5 (1). Дои:10.1186 / s40486-017-0058-6. ISSN 2213-9621.
- ^ а б c d Банерджи, Ананда; Лю, Югуан; Хайкенфельд, Джейсон; Папаутский, Ян (2012). «Детерминированное расщепление объемов жидкости в электросмачивающей микрофлюидике». Лаборатория на чипе. 12 (24): 5138. Дои:10.1039 / c2lc40723j. ISSN 1473-0197. PMID 23042521.
- ^ а б Лю, Югуан; Банерджи, Ананда; Папаутский, Ян (10.01.2014). «Точное измерение объема капель и измерение объема на основе электродов в цифровой микрофлюидике». Микрофлюидика и нанофлюидика. 17 (2): 295–303. Дои:10.1007 / s10404-013-1318-2. ISSN 1613-4982. S2CID 16884950.
- ^ Вергаув, Николас; Виттерс, Даан; Аталай, Егермал Т .; Verbruggen, Bert; Вермейр, Стивен; Джейссенс, Фредерик; Пуэрс, Роберт; Ламмертин, Йерун (26 января 2011 г.). «Контроль изменчивости размера капель в цифровой лаборатории на чипе для повышения эффективности биологических анализов». Микрофлюидика и нанофлюидика. 11 (1): 25–34. Дои:10.1007 / s10404-011-0769-6. ISSN 1613-4982. S2CID 93039641.
- ^ Shamsi, Mohtashim H .; Чой, Кихван; Ng, Alphonsus H.C .; Уиллер, Аарон Р. (2014). «Цифровой микрофлюидный электрохимический иммуноанализ». Лабораторный чип. 14 (3): 547–554. Дои:10.1039 / c3lc51063h. ISSN 1473-0197. PMID 24292705.
- ^ Чанг И-Сянь; Ли, Гво-Бин; Хуанг, Фу-Чун; Чен И-Ю; Лин, младший-Лунг (20 мая 2006 г.). «Интегрированные микросхемы полимеразной цепной реакции с использованием цифровой микрофлюидики». Биомедицинские микроустройства. 8 (3): 215–225. Дои:10.1007 / s10544-006-8171-y. ISSN 1387-2176. PMID 16718406. S2CID 21275449.
- ^ Ши-Кан Фан, Хаши К., Чанг-Джин Ким (2003). «Управление множеством капель на сетке N / spl times / M с помощью перекрестной ссылки на схему управления EWOD и упаковку при контакте с давлением». IEEE, шестнадцатая ежегодная международная конференция по микроэлектромеханическим системам, 2003 г. MEMS-03 Киото: 694–697. Дои:10.1109 / MEMSYS.2003.1189844. S2CID 108612930.
- ^ а б Эльвира К.С., Лезербарроу Р., Эдель Дж., Демелло А. (июнь 2012 г.). «Дозирование капель в цифровых микрожидкостных устройствах: оценка долгосрочной воспроизводимости». Биомикрофлюидика. 6 (2): 22003–2200310. Дои:10.1063/1.3693592. ЧВК 3360711. PMID 22655007.
- ^ а б Никапития Н.Дж., Ю С.М., Луна Х (2014). «Дозирование и разделение капель электросмачиванием на диэлектрической цифровой микрофлюидике». 2014 IEEE 27-я Международная конференция по микроэлектромеханическим системам (МЭМС): 955–958. Дои:10.1109 / MEMSYS.2014.6765801. ISBN 978-1-4799-3509-3. S2CID 45003766.
- ^ а б c Аккардо, Анджело; Мекарини, Федерико; Леончини, Марко; Брэнди, Фернандо; Ди Кола, Эмануэла; Бургхаммер, Манфред; Рикель, Кристиан; Ди Фабрицио, Энцо (2013). «Быстрое, активное взаимодействие капель: коалесценция и реактивное перемешивание, контролируемое с помощью электросмачивания на супергидрофобной поверхности». Лабораторный чип. 13 (3): 332–335. Дои:10.1039 / c2lc41193h. ISSN 1473-0197. PMID 23224020.
- ^ а б c Ванга, Вт; Джонс, Т. Б. (23.06.2011). «Микрожидкостное срабатывание капель изоляционной жидкости в устройстве с параллельными пластинами». Journal of Physics: Серия конференций. 301: 012057. Дои:10.1088/1742-6596/301/1/012057. ISSN 1742-6596.
- ^ Ши-Кан Фань; Хаши, C .; Чанг-Джин Ким (2003). «Манипулирование множеством капель на сетке N × M с помощью перекрестной ссылки на схему управления EWOD и упаковку при контакте с давлением». Шестнадцатая ежегодная международная конференция по микроэлектромеханическим системам, 2003. MEMS-03 Киото. IEEE. IEEE: 694–697. Дои:10.1109 / memsys.2003.1189844. ISBN 0-7803-7744-3. S2CID 108612930.
- ^ Ярмарка, Ричард Б .; Хлыстов Андрей; Портной, Тина Д .; Иванов, Владислав; Evans, Randall D .; Шринивасан, Виджай; Pamula, Vamsee K .; Поллак, Майкл Дж .; Гриффин, Питер Б .; Чжоу, Джек (январь 2007 г.). «Химические и биологические применения цифровых микрофлюидных устройств». Дизайн и тестирование компьютеров IEEE. 24 (1): 10–24. Дои:10.1109 / MDT.2007.8. HDL:10161/6987. ISSN 0740-7475. S2CID 10122940.
- ^ а б Банерджи, Ананда; Но, Джу; Лю, Югуан; Стойка, Филипп; Папаутский, Ян (22.01.2015). «Программируемое электросмачивание с каналами и каплями». Микромашины. 6 (2): 172–185. Дои:10.3390 / mi6020172. ISSN 2072-666X.
- ^ а б c d Roux JM, Fouillet Y, Achard JL (март 2007 г.). «Трехмерное смещение капель в микрофлюидных системах электростатическим возбуждением» (PDF). Датчики и исполнительные механизмы A: физические. 134 (2): 486–93. Дои:10.1016 / j.sna.2006.05.012.
- ^ Fouillet Y, Achard JL (июнь 2004 г.). "Microfluidique discrète et biotechnologie" (PDF). Comptes Rendus Physique. 5 (5): 577–88. Bibcode:2004CRPhy ... 5..577F. Дои:10.1016 / j.crhy.2004.04.004.
- ^ а б Колар П., Ярмарка РБ (2001). Бесконтактное электростатическое тиснение для синтеза ДНК микрочипов (плакат). Труды SmallTalk2001. Сан-Диего, США.
- ^ а б Лебедев Н.Н., Скальская И.П. (1962). «Сила, действующая на проводящую сферу в области параллельного пластинчатого конденсатора». Советская физ. Tech. Phys. 7: 268–270.
- ^ Велев О.Д., Прево Б.Г., Бхатт К.Х. (декабрь 2003 г.). «Встроенное манипулирование свободными каплями». Природа. 426 (6966): 515–6. Bibcode:2003Натура 426..515В. Дои:10.1038 / 426515a. PMID 14654830. S2CID 21293602.
- ^ Gascoyne PR, Vykoukal JV, Schwartz JA, Anderson TJ, Vykoukal DM, Current KW, McConaghy C, Becker FF, Andrews C (август 2004 г.). «Программируемые жидкостные процессоры на основе диэлектрофореза». Лаборатория на чипе. 4 (4): 299–309. Дои:10.1039 / b404130e. PMID 15269795.
- ^ Танигучи Т., Тории Т., Хигучи Т. (февраль 2002 г.). «Химические реакции в микрокаплях при электростатическом воздействии на капли в жидких средах». Лаборатория на чипе. 2 (1): 19–23. Дои:10.1039 / b108739h. PMID 15100855.
- ^ Коэльо, Беатрис; Вейгас, Бруно; Фортунато, Эльвира; Мартинс, Родриго; Агуас, Хьюго; Игреджа, Руи; Баптиста, Педро В. (2017). «Цифровая микрофлюидика для амплификации нуклеиновых кислот». Датчики. 17 (7): 1495. Дои:10,3390 / с17071495. ЧВК 5539496. PMID 28672827.
- ^ а б c d е ж Абдельгавад М., Фрейре С.Л., Ян Х., Уиллер А.Р. (май 2008 г.). «Вездеход капельного срабатывания». Лаборатория на чипе. 8 (5): 672–7. Дои:10.1039 / b801516c. PMID 18432335.
- ^ Абдельгавад М., Уилер А.Р. (январь 2007 г.). «Быстрое прототипирование на медных подложках для цифровой микрофлюидики». Современные материалы. 19 (1): 133–7. Дои:10.1002 / adma.200601818.
- ^ а б c Джордж С.М., Луна Х (март 2015 г.). «Цифровая микрофлюидная трехмерная клеточная культура и платформа для химического скрининга с использованием альгинатных гидрогелей». Биомикрофлюидика. 9 (2): 024116. Дои:10.1063/1.4918377. ЧВК 4401805. PMID 25945142.
- ^ а б c Барбулович-Над I, Ян Х., Парк П.С., Уилер А.Р. (апрель 2008 г.). «Цифровая микрофлюидика для клеточных анализов». Лаборатория на чипе. 8 (4): 519–26. Дои:10.1039 / b717759c. PMID 18369505.
- ^ а б Ван И, Чжао И, Чо С.К. (1 октября 2007 г.). «Эффективное капельное разделение магнитных частиц для цифровой микрофлюидики». Журнал микромеханики и микротехники. 17 (10): 2148–2156. Bibcode:2007JMiMi..17.2148W. Дои:10.1088/0960-1317/17/10/029.
- ^ а б Vergauwe N, Vermeir S, Wacker JB, Ceyssens F, Cornaglia M, Puers R, Gijs MA, Lammertyn J, Witters D (июнь 2014 г.). «Высокоэффективный протокол экстракции магнитных частиц на цифровом микрофлюидном чипе». Датчики и исполнительные механизмы B: химические. 196: 282–291. Дои:10.1016 / j.snb.2014.01.076.
- ^ а б c Сил Б., Лам К., Ракус Д.Г., Чемберлен, доктор медицины, Лю С., Уиллер А.Р. (октябрь 2016 г.). «Цифровая микрофлюидика для иммунопреципитации». Аналитическая химия. 88 (20): 10223–10230. Дои:10.1021 / acs.analchem.6b02915. PMID 27700039.
- ^ а б c d е Шах Г.Дж., Ким СС (апрель 2009 г.). «Высокоэффективный магнитный сбор и разделение с помощью мениска для микрофлюидики капель EWOD». Журнал микроэлектромеханических систем. 18 (2): 363–375. Дои:10.1109 / JMEMS.2009.2013394. S2CID 24845666.
- ^ а б Джебраил MJ, Sinha A, Vellucci S, Renzi RF, Ambriz C, Gondhalekar C и др. (Апрель 2014 г.). «Интерфейс между миром и цифровым микрофлюидом, позволяющий извлекать и очищать РНК из цельной крови человека». Аналитическая химия. 86 (8): 3856–62. Дои:10.1021 / ac404085p. PMID 24479881.
- ^ а б Хун П, Цзян П, Ли Э, Фан С., Лу И (апрель 2015 г.). «Извлечение геномной ДНК из цельной крови с использованием цифровой микрофлюидной (DMF) платформы с магнитными шариками». Микросистемные технологии. 23 (2): 313–320. Дои:10.1007 / s00542-015-2512-9. S2CID 137531469.
- ^ а б Чой К., Нг А.Х., Фобель Р., Чанг-Йен Д.А., Ярнелл Л.Е., Пирсон Е.Л. и др. (Октябрь 2013). «Автоматизированная цифровая микрофлюидная платформа для иммуноанализов на основе магнитных частиц с оптимизацией дизайна экспериментов». Аналитическая химия. 85 (20): 9638–46. Дои:10.1021 / ac401847x. PMID 23978190.
- ^ а б Чой К., Бояджи Э., Ким Дж., Сил Б., Баррера-Арбелаез Л., Павлишин Дж., Уилер А. Р. (апрель 2016 г.). «Цифровой микрофлюидный интерфейс между твердофазной микроэкстракцией и жидкостной хроматографией-масс-спектрометрией». Журнал хроматографии А. 1444: 1–7. Дои:10.1016 / j.chroma.2016.03.029. PMID 27048987.
- ^ а б Wijethunga PA, Nanayakkara YS, Kunchala P, Armstrong DW, Moon H (март 2011 г.). «Микроэкстракция жидкости по каплям на кристалле в сочетании с техникой мониторинга концентрации в реальном времени». Аналитическая химия. 83 (5): 1658–64. Дои:10.1021 / ac102716s. PMID 21294515.
- ^ а б Shah GJ, Ohta AT, Chiou EP, Wu MC, Kim CJ (июнь 2009 г.). «Микрожидкостное устройство, управляемое EWOD, интегрированное с оптоэлектронным пинцетом в качестве автоматизированной платформы для выделения и анализа клеток». Лаборатория на чипе. 9 (12): 1732–9. Дои:10.1039 / b821508a. PMID 19495457.
- ^ а б c Nejad HR, Samiei E, Ahmadi A, Hoorfar M (2015). «Гидродинамическое разделение частиц под действием силы тяжести в цифровых микрофлюидных системах». RSC Adv. 5 (45): 35966–35975. Дои:10.1039 / C5RA02068A.
- ^ Нойман К.С., Блок С.М. (сентябрь 2004 г.). «Оптический треппинг». Обзор научных инструментов. 75 (9): 2787–809. Bibcode:2004RScI ... 75.2787N. Дои:10.1063/1.1785844. ЧВК 1523313. PMID 16878180.
- ^ Гэн Х, Фенг Дж, Стабрыла Л.М., Чо СК (март 2017 г.). «Манипуляции со смачиванием диэлектриком для цифровой микрофлюидики: создание, транспортировка, расщепление и слияние капель». Лаборатория на чипе. 17 (6): 1060–1068. Дои:10.1039 / c7lc00006e. PMID 28217772.
- ^ Джебраил М.Дж., Ассем Н., Мудрик Дж.М., Драйден М.Д., Лин К., Юдин А.К., Уиллер А.Р. (01.08.2012). «Комбинаторный синтез пептидомиметиков с использованием цифровой микрофлюидики». Журнал химии потока. 2 (3): 103–107. Дои:10.1556 / JFC-D-12-00012. S2CID 34049157.
- ^ а б Chen S, Javed MR, Kim HK, Lei J, Lazari M, Shah GJ и др. (Март 2014 г.). «Нанесение радиоактивной метки на различные индикаторы позитронно-эмиссионной томографии (ПЭТ) с использованием одного цифрового микрожидкостного чипа реактора». Лаборатория на чипе. 14 (5): 902–10. Дои:10.1039 / c3lc51195b. PMID 24352530.
- ^ а б c Джавед М.Р., Чен С., Ким Х.К., Вей Л., Чернин Дж., Ким С.Дж. и др. (Февраль 2014). «Эффективный радиосинтез 3'-дезокси-3'-18F-фтортимидина с использованием электронного микрожидкостного чипа на диэлектрике». Журнал ядерной медицины. 55 (2): 321–8. Дои:10.2967 / jnumed.113.121053. ЧВК 4494735. PMID 24365651.
- ^ Keng PY, Chen S, Ding H, Sadeghi S, Shah GJ, Dooraghi A и др. (Январь 2012 г.). «Микрохимический синтез молекулярных зондов на электронном микрофлюидном устройстве». Труды Национальной академии наук Соединенных Штатов Америки. 109 (3): 690–5. Bibcode:2012ПНАС..109..690К. Дои:10.1073 / pnas.1117566109. ЧВК 3271918. PMID 22210110.
- ^ а б Дюбуа П., Маршан Дж., Фуйе Й., Бертье Дж., Дуки Т., Хассин Ф. и др. (Июль 2006 г.). «Капля ионной жидкости как электронный микрореактор». Аналитическая химия. 78 (14): 4909–17. Дои:10.1021 / ac060481q. PMID 16841910.
- ^ Эм Т, Хун Дж, Им ду Дж, Ли СДжей, Кан И.С. (август 2016 г.). «Электроуправляемый синтез микрочастиц и цифровое микрожидкостное манипулирование с помощью индуцированного электрическим полем распределения капель в несмешивающиеся жидкости». Научные отчеты. 6 (1): 31901. Bibcode:2016НатСР ... 631901U. Дои:10.1038 / srep31901. ЧВК 4989170. PMID 27534580.
- ^ а б Виттерс Д., Вергаув Н., Амелут Р., Вермейр С., Де Вос Д., Пуэрс Р. и др. (Март 2012 г.). «Цифровая микрофлюидная высокопроизводительная печать одиночных металлоорганических каркасных кристаллов». Современные материалы. 24 (10): 1316–20. Дои:10.1002 / adma.201104922. PMID 22298246.
- ^ а б Моазами Э., Перри Дж. М., Соффер Дж., Хассер М.С., Ши СК (апрель 2019 г.). «Интеграция интерфейсов« мир-чип »с цифровой микрофлюидикой для бактериальной трансформации и ферментативных анализов». Аналитическая химия. 91 (8): 5159–5168. Дои:10.1021 / acs.analchem.8b05754. PMID 30945840.
- ^ Нг АХ, Ли ББ, Чемберлен, доктор медицины, Уиллер А.Р. (07.12.2015). «Цифровая микрофлюидная клеточная культура». Ежегодный обзор биомедицинской инженерии. 17 (1): 91–112. Дои:10.1146 / annurev-bioeng-071114-040808. PMID 26643019.
- ^ а б Нг А. Х., Дин Чемберлен М., Ситу Х, Ли В., Уиллер А. Р. (июнь 2015 г.). «Цифровая микрофлюидная иммуноцитохимия в единичных клетках». Nature Communications. 6 (1): 7513. Bibcode:2015НатКо ... 6.7513N. Дои:10.1038 / ncomms8513. ЧВК 4491823. PMID 26104298.
- ^ а б Айджиан А.П., Гаррелл Р.Л. (июнь 2015 г.). «Цифровая микрофлюидика для автоматизированной культуры сфероидов висячих капель». Журнал автоматизации лабораторий. 20 (3): 283–95. Дои:10.1177/2211068214562002. PMID 25510471. S2CID 23720265.
- ^ а б Бен Йехезкель Т., Соперник А, Раз О, Коэн Р., Маркс З., Камара М. и др. (Февраль 2016). «Синтез и бесклеточное клонирование библиотек ДНК с использованием программируемой микрофлюидики». Исследования нуклеиновых кислот. 44 (4): e35. Дои:10.1093 / нар / gkv1087. ЧВК 4770201. PMID 26481354.
- ^ Fan SK, Hsu YW, Chen CH (август 2011). «Капсулированные капли с дозируемыми и удаляемыми масляными оболочками с помощью электросмачивания и диэлектрофореза». Лаборатория на чипе. 11 (15): 2500–8. Дои:10.1039 / c1lc20142e. PMID 21666906.
- ^ «Millipore и HyClone образуют альянс в области биотехнологий». Мембранные технологии. 2004 (3): 1 марта 2004 г. Дои:10.1016 / s0958-2118 (04) 00087-4. ISSN 0958-2118.
- ^ Кирби А.Е., Лафреньер Н.М., Сил Б., Хендрикс П.И., Кук Р.Г., Уиллер А.Р. (июнь 2014 г.). «Анализ на ходу: количественное определение злоупотребления наркотиками в сухой моче с помощью цифровой микрофлюидики и миниатюрной масс-спектрометрии». Аналитическая химия. 86 (12): 6121–9. Дои:10.1021 / ac5012969. PMID 24906177.
- ^ Нг АХ, Уддаясанкар У, Уиллер А.Р. (июнь 2010 г.). «Иммуноанализы в микрофлюидных системах. Аналитическая и биоаналитическая химия». Аналитическая и биоаналитическая химия. 397 (3): 991–1007. Дои:10.1007 / s00216-010-3678-8. PMID 20422163. S2CID 30670634.
- ^ а б Vergauwe N, Witters D, Ceyssens F, Vermeir S, Verbruggen B, Puers R, Lammertyn J (апрель 2011 г.). «Универсальная цифровая микрофлюидная платформа на основе электросмачивания для количественных однородных и гетерогенных биологических анализов». Журнал микромеханики и микротехники. 21 (5): 054026. Bibcode:2011JMiMi..21e4026V. Дои:10.1088/0960-1317/21/5/054026.
- ^ а б Систа Р., Хуа З., Твар П., Сударсан А., Сринивасан В., Экхард А., Поллак М., Памула V (декабрь 2008 г.). «Разработка цифровой микрофлюидальной платформы для тестирования на месте». Лаборатория на чипе. 8 (12): 2091–104. Дои:10.1039 / b814922d. ЧВК 2726010. PMID 19023472.
- ^ а б Нг АХ, Чой К., Луома Р.П., Робинсон Дж. М., Уиллер А. Р. (октябрь 2012 г.). «Цифровая микрофлюидная магнитная сепарация для иммуноанализов на основе частиц». Аналитическая химия. 84 (20): 8805–12. Дои:10.1021 / ac3020627. PMID 23013543.
- ^ а б Шамси М.Х., Чой К., Нг А.Х., Уиллер А.Р. (февраль 2014 г.). «Цифровой микрофлюидный электрохимический иммуноанализ». Лаборатория на чипе. 14 (3): 547–54. Дои:10.1039 / c3lc51063h. PMID 24292705.
- ^ Систа Р.С., Экхардт А.Е., Сринивасан В., Поллак М.Г., Паланки С., Памула В.К. (декабрь 2008 г.). «Гетерогенные иммуноанализы с использованием магнитных шариков на цифровой микрофлюидной платформе». Лаборатория на чипе. 8 (12): 2188–96. Дои:10.1039 / b807855f. ЧВК 2726047. PMID 19023486.
- ^ Цалоглоу М.Н., Джейкобс А., Морган Х. (сентябрь 2014 г.). «Флуорогенный гетерогенный иммуноферментный анализ cTnI тропонина сердечной мышцы на цифровом микрофлюидном устройстве». Аналитическая и биоаналитическая химия. 406 (24): 5967–76. Дои:10.1007 / s00216-014-7997-z. PMID 25074544. S2CID 24266593.
- ^ Хуанг CY, Tsai PY, Lee IC, Hsu HY, Huang HY, Fan SK, Yao DJ, Liu CH, Hsu W. (январь 2016 г.). «Высокоэффективный метод экстракции шариков с низким числом шариков для цифрового микрофлюидного иммуноанализа». Биомикрофлюидика. 10 (1): 011901. Дои:10.1063/1.4939942. ЧВК 4714987. PMID 26858807.
- ^ а б Чжу Л., Фэн Й, Е X, Фэн Дж, Ву И, Чжоу З. (сентябрь 2012 г.). «Чип ELISA на основе микрофлюидной платформы EWOD». Журнал адгезионных наук и технологий. 26 (12–17): 2113–24. Дои:10.1163 / 156856111x600172. S2CID 136668522.
- ^ Миллер Э.М., Нг А.Х., Уддаясанкар У., Уиллер А.Р. (январь 2011 г.). «Цифровой микрофлюидный подход к гетерогенным иммуноанализам». Аналитическая и биоаналитическая химия. 399 (1): 337–45. Дои:10.1007 / s00216-010-4368-2. PMID 21057776. S2CID 2809777.
- ^ а б Ракус Д.Г., Драйден М.Д., Ламанна Дж., Сарагоса А., Лам Б., Келли С.О., Уиллер А.Р. (2015). «Цифровое микрофлюидное устройство со встроенными наноструктурированными микроэлектродами для электрохимических иммуноанализов». Лаборатория на чипе. 15 (18): 3776–84. Дои:10.1039 / c5lc00660k. PMID 26247922.
- ^ Диксон К., Нг А.Х., Фобель Р., Милтенбург МБ, Уиллер А.Р. (ноябрь 2016 г.). «Цифровое микрофлюидное устройство с рулонным покрытием и струйной печатью для недорогих миниатюрных диагностических тестов» (PDF). Лаборатория на чипе. 16 (23): 4560–4568. Дои:10.1039 / c6lc01064d. PMID 27801455.
- ^ Нг АХ, Ли М., Чой К., Фишер А.Т., Робинсон Дж. М., Уиллер А. Р. (февраль 2015 г.). «Цифровая микрофлюидная платформа для выявления инфекции краснухи и иммунитета: доказательство концепции». Клиническая химия. 61 (2): 420–9. Дои:10.1373 / Clinchem.2014.232181. PMID 25512641.
- ^ а б Ван Х, Йи Л., Мухитов Н., Шрелл А.М., Дхумпа Р., Ропер М.Г. (февраль 2015 г.). «Микрофлюидика-масс-спектрометрия: обзор методов и приложений сочетания». Журнал хроматографии А. Выбор редакции IX. 1382: 98–116. Дои:10.1016 / j.chroma.2014.10.039. ЧВК 4318794. PMID 25458901.
- ^ Чаттерджи Д., Иттерберг А.Дж., Сон С.У., Лу Дж.А., Гаррелл Р.Л. (март 2010 г.). «Интеграция этапов обработки белка на платформе капельной микрофлюидики для анализа MALDI-MS». Аналитическая химия. 82 (5): 2095–101. Дои:10.1021 / ac9029373. PMID 20146460.
- ^ Кюстер С.К., Фагерер С.Р., Вербокет П.Е., Эйер К., Ефимов К., Зеноби Р., Диттрих П.С. (февраль 2013 г.). «Взаимодействие капельной микрофлюидики с матричной лазерной десорбцией / ионизационной масс-спектрометрией: анализ содержания отдельных капель без этикеток». Аналитическая химия. 85 (3): 1285–9. Дои:10.1021 / ac3033189. PMID 23289755.
- ^ Джебраил М.Дж., Ян Х., Мудрик Дж.М., Лафреньер Н.М., МакРобертс С., Аль-Дирбаши О.Ю. и др. (Октябрь 2011 г.). «Цифровой микрофлюидный метод анализа сухих пятен крови». Лаборатория на чипе. 11 (19): 3218–24. Дои:10.1039 / c1lc20524b. PMID 21869989.
- ^ Йео Ли, друг-младший (январь 2009 г.). «Сверхбыстрая микрофлюидика с использованием поверхностных акустических волн». Биомикрофлюидика. 3 (1): 12002. Дои:10.1063/1.3056040. ЧВК 2717600. PMID 19693383.
- ^ Heron SR, Wilson R, Shaffer SA, Goodlett DR, Cooper JM (май 2010 г.). «Распыление пептидов поверхностными акустическими волнами как микрофлюидный интерфейс для масс-спектрометрии». Аналитическая химия. 82 (10): 3985–9. Дои:10.1021 / ac100372c. ЧВК 3073871. PMID 20364823.
- ^ Хо Дж, Тан М.К., Го ДБ, Йео ЛЙ, друг-младший, Чанг ХК (май 2011 г.). «Бумажная микрофлюидная доставка образца поверхностных акустических волн и источник ионизации для быстрой и чувствительной масс-спектрометрии окружающей среды». Аналитическая химия. 83 (9): 3260–6. Дои:10.1021 / ac200380q. PMID 21456580.
- ^ Кирби, Андреа Э .; Уиллер, Аарон Р. (18.06.2013). «Цифровая микрофлюидика: новая платформа для подготовки образцов для масс-спектрометрии». Аналитическая химия. 85 (13): 6178–6184. Дои:10.1021 / ac401150q. ISSN 0003-2700. PMID 23777536.
- ^ Чжао, Ян; Чакрабарти, Кришненду (июнь 2010 г.). «Синхронизация операций промывки с маршрутизацией капель для предотвращения перекрестного загрязнения цифровых микрожидкостных биочипов». Конференция по автоматизации проектирования: 635–640.
- ^ а б Ши, Стив С.C .; Ян, Хао; Jebrail, Mais J .; Фобел, Райан; Макинтош, Натан; Аль-Дирбаши, Усама Й .; Чакраборти, Пранеш; Уиллер, Аарон Р. (13 марта 2012 г.). «Анализ сухих пятен крови с помощью цифровой микрофлюидики в сочетании с масс-спектрометрией с ионизацией наноэлектроспреем». Аналитическая химия. 84 (8): 3731–3738. Дои:10.1021 / ac300305s. ISSN 0003-2700. PMID 22413743.
- ^ Aijian, Andrew P .; Чаттерджи, Дебалина; Гаррелл, Робин Л. (19.06.2012). «Обработка белков с фторированной жидкостью и кристаллизация с помощью поверхностно-активных веществ для полностью in situ цифрового микрофлюидного анализа MALDI-MS». Лаборатория на чипе. 12 (14): 2552–2559. Дои:10.1039 / C2LC21135A. ISSN 1473-0189. PMID 22569918.
- ^ Самией, Эхсан; Тебризиан, Марьям; Хоорфар, Мина (22.06.2016). «Обзор цифровой микрофлюидики как портативных платформ для приложений« лаборатория на кристалле »». Лаборатория на чипе. 16 (13): 2376–2396. Дои:10.1039 / C6LC00387G. ISSN 1473-0189. PMID 27272540.
- ^ Лапьер, Флориан; Пирет, Гаэль; Дробек, Эрве; Мельник, Олег; Гробовщик, Янник; Томи, Винсент; Бухерруб, Рабах (07.05.2011). «Высокочувствительный безматричный масс-спектрометрический анализ пептидов с использованием цифрового микрофлюидного устройства на основе кремниевых нанопроволок». Лаборатория на чипе. 11 (9): 1620–1628. Дои:10.1039 / C0LC00716A. ISSN 1473-0189. PMID 21423926.
- ^ Оуян, Чжэн; Повара, Р. Грэм (19 июля 2009 г.). «Миниатюрные масс-спектрометры». Ежегодный обзор аналитической химии. 2 (1): 187–214. Дои:10.1146 / annurev-anchem-060908-155229. ISSN 1936-1327. PMID 20636059.
- ^ Кирби, Андреа Э .; Lafrenière, Nelson M .; Сил, Брендон; Хендрикс, Пол I; Повара, Р. Грэм; Уиллер, Аарон Р. (17.06.2014). «Анализ на ходу: количественное определение злоупотребления наркотиками в сухой моче с помощью цифровой микрофлюидики и миниатюрной масс-спектрометрии». Аналитическая химия. 86 (12): 6121–6129. Дои:10.1021 / ac5012969. ISSN 0003-2700.
- ^ а б Свайер И., Сунг Р., Драйден, доктор медицины, Фей М., Маас В.Е., Симпсон А., Уилер А.Р. (ноябрь 2016 г.). «Взаимодействие цифровой микрофлюидики с высокополевой спектроскопией ядерного магнитного резонанса». Лаборатория на чипе. 16 (22): 4424–4435. Дои:10.1039 / c6lc01073c. PMID 27757467.
- ^ а б Лей К.М., Мак П.И., Закон М.К., Мартиньш Р.П. (август 2015 г.). «Микро-ЯМР-релаксометр размером с ладонь с использованием цифрового микрофлюидного устройства и полупроводникового трансивера для химической / биологической диагностики». Аналитик. 140 (15): 5129–37. Bibcode:2015Ана ... 140.5129л. Дои:10.1039 / c5an00500k. PMID 26034784.
- ^ Лей К.М., Мак П.И., Закон М.К., Мартиньш Р.П. (декабрь 2014 г.). «ЯМР-ДМФ: модульная система ядерно-магнитного резонанса и цифровой микрофлюидики для биологических анализов». Аналитик. 139 (23): 6204–13. Bibcode:2014Ana ... 139.6204L. Дои:10.1039 / c4an01285b. PMID 25315808.