WikiDer > Гамма-глутамилкарбоксилаза - Википедия
| GGCX | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | GGCX, VKCFD1, гамма-глутамилкарбоксилаза, гамма-глутамилкарбоксилаза; GGCX | ||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 137167 MGI: 1927655 ГомолоГен: 639 Генные карты: GGCX | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ансамбль | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (мРНК) | |||||||||||||||||||||||||
| RefSeq (белок) | |||||||||||||||||||||||||
| Расположение (UCSC) | Chr 2: 85,54 - 85,56 Мб | н / д | |||||||||||||||||||||||
| PubMed поиск | [2] | [3] | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Гамма-глутамилкарбоксилаза является фермент что у людей кодируется GGCX ген, расположен на хромосома 2 при 2п12.[4]
Функция
Гамма-глутамилкарбоксилаза - это фермент, который катализирует посттрансляционная модификация из витамин К-зависимые белки. Многие из этих витамин К-зависимых белков участвуют в коагуляция поэтому функция закодированного фермента важна для гемостаза.[5] Наиболее домен gla-содержащие белки зависят от этой реакции карбоксилирования для посттрансляционная модификация.[6] У людей фермент гамма-глутамилкарбоксилаза наиболее сильно экспрессируется в печени.
Каталитическая реакция
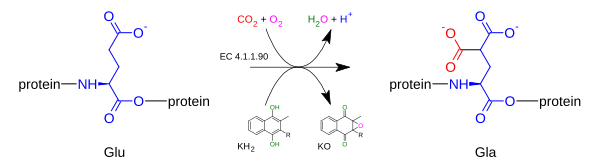
Гамма-глутамилкарбоксилаза окисляет Витамин К гидрохинон к эпоксиду витамина К 2,3 при одновременном добавлении CO2 к белкам глютаминовая кислота (аббревиатура = Glu) с образованием гамма-карбоксиглутаминовой кислоты (также называемой гамма-карбоксиглутамат, аббревиатура = Gla). Наличие двух карбоксилатных групп вызывает хелатирование Ca2 +, что приводит к изменению третичной структуры белка и его активации. Реакция карбоксилирования будет протекать только в том случае, если фермент карбоксилаза способен одновременно окислять гидрохинон витамина К до эпоксида витамина К. реакции карбоксилирования и эпоксидирования называются сопряженными реакциями.[7][8][9]
2) + CO
2 + кислород → [белок] 4-карбокси-L-глутамат (Gla) + 2,3-эпоксид витамина K (KO) + ЧАС+
+ ЧАС
2О
Клиническое значение
Мутации в этом гене связаны с витамин К-зависимым дефектом свертывания крови и PXE-подобное расстройство с недостаточностью множественных факторов свертывания крови.[5][10]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000115486 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ву С.М., Чунг В.Ф., Фрейзер Д., Стаффорд Д.В. (декабрь 1991 г.). «Клонирование и экспрессия кДНК гамма-глутамилкарбоксилазы человека». Наука. 254 (5038): 1634–6. Дои:10.1126 / science.1749935. PMID 1749935.
- ^ а б "Энтрез Джин: GGCX".
- ^ Бреннер Б., Тавори С., Зивелин А., Келлер С. Б., Сатти Дж. В., Татарский И., Селигсон Ю. (август 1990 г.). «Наследственный дефицит всех витамин К-зависимых прокоагулянтов и антикоагулянтов». Br. J. Haematol. 75 (4): 537–42. Дои:10.1111 / j.1365-2141.1990.tb07795.x. PMID 2145029. S2CID 24679257.
- ^ Сатти Дж. В. (1985). «Витамин К-зависимая карбоксилаза». Анну. Преподобный Biochem. 54 (1): 459–77. Дои:10.1146 / annurev.bi.54.070185.002331. PMID 3896125.
- ^ Преснелл С.Р., Стаффорд Д.В. (2002). «Витамин К-зависимая карбоксилаза». Тромб. Haemost. 87 (6): 937–46. Дои:10.1055 / с-0037-1613115. PMID 12083499.
- ^ Сильва П.Дж., Рамос М.Дж. (2007). «Механизм реакции витамин К-зависимой глутаматкарбоксилазы: компьютерное исследование». J Phys Chem B. 111 (44): 12883–7. Дои:10.1021 / jp0738208. PMID 17935315.
- ^ Ванаккер О.М., Мартин Л., Гедуцци Д., Лерой Б.П., Лойс Б.Л., Гуэрчи В.И., Маттис Д., Терри С.Ф., Кук П.Дж., Паскуали-Рончетти И., Де Паэпе А. (март 2007 г.). «Псевдоксантомоподобный фенотип с cutis laxa и множественным дефицитом факторов свертывания крови представляет собой отдельную генетическую сущность». J. Invest. Дерматол. 127 (3): 581–7. Дои:10.1038 / sj.jid.5700610. PMID 17110937.
дальнейшее чтение
- Bandyopadhyay PK (2008). «Витамин К-зависимое гамма-глутамилкарбоксилирование: древняя посттрансляционная модификация». Витам. Horm. Витамины и гормоны. 78: 157–84. Дои:10.1016 / S0083-6729 (07) 00008-8. ISBN 9780123741134. PMID 18374194.
- Беркнер К.Л. (2008). «Витамин К-зависимое карбоксилирование». Витам. Horm. Витамины и гормоны. 78: 131–56. Дои:10.1016 / S0083-6729 (07) 00007-6. ISBN 9780123741134. PMID 18374193.
- Ольденбург Дж., Маринова М, Мюллер-Рибле С., Вацка М (2008). «Цикл витамина К». Витам. Horm. Витамины и гормоны. 78: 35–62. Дои:10.1016 / S0083-6729 (07) 00003-9. ISBN 9780123741134. PMID 18374189.
- Беркнер К.Л. (2005). «Витамин К-зависимая карбоксилаза». Анну. Преподобный Нутр. 25 (1): 127–49. Дои:10.1146 / annurev.nutr.25.050304.092713. PMID 16011462.
- Чжан Б., Гинзбург Д. (сентябрь 2004 г.). «Семейная недостаточность множественных факторов свертывания крови: новый биологический взгляд на редкие генетические нарушения свертывания крови». J. Thromb. Haemost. 2 (9): 1564–72. Дои:10.1111 / j.1538-7836.2004.00857.x. HDL:2027.42/74529. PMID 15333032. S2CID 7437035.
- Валлин Р., Хатсон С.М. (июль 2004 г.). «Варфарин и витамин К-зависимая система гамма-карбоксилирования». Тенденции Мол Мед. 10 (7): 299–302. Дои:10.1016 / молмед.2004.05.003. PMID 15242675.
- Беркнер К.Л. (август 2000 г.). «Витамин К-зависимая карбоксилаза». J. Nutr. 130 (8): 1877–80. Дои:10.1093 / jn / 130.8.1877. PMID 10917896.
- Преснелл С.Р., Стаффорд Д.В. (июнь 2002 г.). «Витамин К-зависимая карбоксилаза». Тромб. Haemost. 87 (6): 937–46. Дои:10.1055 / с-0037-1613115. PMID 12083499.
- Бендер, Дэвид А. (2003). Биохимия питания витаминов. Кембридж, Великобритания: Издательство Кембриджского университета. ISBN 0-521-80388-8.
- Болл, Джордж Э. (2004). Витамины: их роль в организме человека. Оксфорд: Blackwell Science. ISBN 0-632-06478-1.
- Комбс, Джеральд Ф. (1998). Витамины: фундаментальные аспекты питания и здоровья. Бостон: Academic Press. ISBN 0-12-183492-1.
внешняя ссылка
- глутамил + карбоксилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.