WikiDer > Гексадегидро реакция Дильса – Альдера
В органическая химия, то гексадегидро-Дильса – Альдера (HDDA) реакция - это органическая химическая реакция между Diyne (2 алкин функциональные группы, расположенные в сопряженная система) и алкин с образованием реактивного бензин виды, через [4 + 2] циклоприсоединение реакция.[1][2][3] Этот промежуточный бензин затем реагирует с подходящим улавливающим агентом с образованием замещенного ароматный товар. Эта реакция является производной от установленного Реакция Дильса – Альдера и происходит через аналогичный механизм [4 + 2] циклоприсоединения. Реакция HDDA особенно эффективна для образования сильно функционализированных ароматических систем и множественных кольцевых систем на одной стадии синтеза.
Механизм реакции
В зависимости от выбранного субстрата, реакция HDDA может быть инициирована термически или добавлением подходящего катализатор, часто переходный металл.[1][2][4][5] Преобладающим механизмом термически инициируемой реакции HDDA является [4 + 2] циклоприсоединение между конъюгированным диином (1,3-диалкином) и алкином (часто называемым диинофил по аналогии с Дильсом – Альдером диенофил) сформировать орто-бензин разновидность.[1][2] Считается, что катализируемый металлами HDDA проходит аналогичный путь, образуя стабилизированный металлом бензин, который затем улавливается.
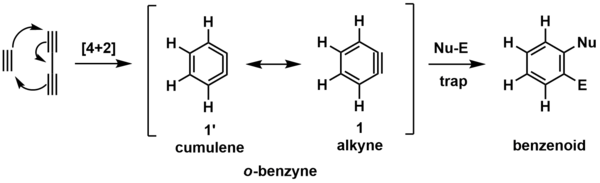
Простейшей моделью реакции HDDA является циклоприсоединение Бутадиин и ацетилен с образованием орто-бензина (о-бензина, показанного ниже).[6] Этот реакционноспособный промежуточный продукт (обозначенный скобками) впоследствии реагирует с обобщенным улавливающим реагентом, который состоит из нуклеофильный (Nu-) и электрофильный (El-) сайт, дающий показанный бензоидный продукт.
Промежуточный о-бензин можно представить в виде двух резонанс (химия) формы, показанные выше. Наиболее часто изображаемая форма - это алкин (1), но кумулен (1’) форма может быть полезна для визуализации образования кольца посредством [4 + 2] циклоприсоединения.
Термодинамика и кинетика
Реакция HDDA часто является термодинамически выгодной (экзотермический), но может иметь значительный кинетический барьер для реакции (высокий энергия активации). Расчеты показали, что образование незамещенного о-бензина (из бутадина и ацетилена, см. Выше) имеет энергию активации 36 ккал / моль.−1, но является термодинамически выгодным, по оценкам, экзотермическим на -51 ккал моль−1.[6] В результате более высокой энергии активации некоторые реакции HDDA требуют нагрева до повышенных температур (> 100 ⁰C), чтобы начать.[1][2]
Кроме того, стадия улавливания бензина также является термодинамически выгодной, по расчетам на дополнительные -73 ккал / моль−1 для улавливания сложноэфирзамещенного о-бензина с трет-бутанол.[1]
Циклоприсоединение HDDA [4 + 2] может происходить либо через согласованный путь или ступенчатая реакция, бирадикальный путь. Эти два пути могут различаться по энергии активации в зависимости от субстрата и реакционной системы. Вычислительные исследования показали, что хотя оба пути сравнимы по энергии активации для неактивированных (незамещенных) диинофилов, ступенчатый путь имеет более низкий энергетический барьер активации, и поэтому является доминирующим путем для активированных диинофилов.[6][7]
Региохимия
Региохимия несимметричного захвата бензина на основе HDDA может быть объяснена комбинацией эффектов электронного и кольцевого искажения.[1] Вычислительно более тупой угол (а) соответствует более электронодефицитному (δ +) бензиновому углероду, что приводит к атаке нуклеофильного компонента в этом месте. Следовательно, электрофильный компонент добавляет в более богатый электронами (δ-) сайт (б).
Терминология
Реакция HDDA является производной классической реакции Дильса – Альдера и механически связана с ней. Как описано Хой и его коллегами, реакция HDDA концептуально может рассматриваться как член ряда перициклические реакции с увеличением ненасыщенность (путем постепенного удаления водород пары).[1] Дескриптор «гексадегидро» происходит из этой интерпретации, поскольку простейший продукт реакции HDDA (о-бензин, 4 атома водорода) имеет на 6 атомов водорода меньше, чем простейший продукт реакции Дильса-Альдера (циклогексен, 10 атомов водорода).
Формально реакция гексадегидро Дильса-Альдера описывает только образование бензина, но эта разновидность является нестабильным промежуточным продуктом, который легко реагирует с множеством улавливающих партнеров, включая реакцию растворители. Таким образом, на практике реакция HDDA описывает двухступенчатую каскадную реакцию образования бензина и улавливания с получением конечного продукта.
Историческое развитие
О первых примерах реакции HDDA независимо друг от друга сообщили в 1997 году группы Уэда и Джонсон.[2][8][9][10] Джонсон и его сотрудники наблюдали циклизацию 1,3,8-нонатриина в условиях мгновенного вакуумного термолиза (600 ° C, 10 ° C).−2 торр), чтобы сформировать два продукта, индан и продукт дегидрирования инден, с комбинированным выходом 95%. Маркировка дейтерием Исследования показали, что продукт был образован [4 + 2] циклоприсоединением к бензиновому промежуточному соединению с последующим восстановлением in situ с образованием наблюдаемых продуктов.[8] Уэда и его сотрудники наблюдали, что ациклические тетраины циклизуются при комнатной температуре с образованием производных 5H-флуоренола. Образование промежуточного бензина определяли исследованиями улавливания с использованием бензол или же антрацен улавливать бензин как аддукт Дильса-Альдера.[10] Уэда и его сотрудники дополнительно разработали этот метод в последующих отчетах, улавливая бензин с использованием различных нуклеофилов (на основе кислорода, азота и серы), а также синтезируя более крупные конденсированные кольца. ароматный системы.[11][12][13][14][15]
Хотя реакция HDDA известна уже более десяти лет, она не получила широкого распространения до 2012 года, когда Хой и его коллеги провели тщательное исследование масштабов и полезности этого циклоприсоединения.[1] В этой статье эта дийн-дийнофильная реакция упоминается как«Гексадегидро Дильса – Альдера (HDDA)» реакция, и с тех пор эта терминология получила более широкое распространение. С 2012 года реакция HDDA вызвала повышенный интерес и стала предметом дальнейшего изучения ряда исследовательских групп.[4][5][7][16]
Объем реакции
Одним из основных преимуществ реакции HDDA перед другими методами получения бензинов является простота реакционной системы. В результате реакции HDDA триинов или тетраинов образуются бензины без прямого образования побочных продуктов. Для сравнения, образование бензина за счет удаления орто-заместителей на аренах приводит к стехиометрическим количествам побочных продуктов из этих заместителей. Например, образование бензина из 1 моля 2-триметилсилилфенила трифторметансульфонат (тройной) производит 1 моль триметилсилил фторид и 1 моль трифлат-иона. Побочные продукты могут конкурировать с другими реагентами за улавливание бензина, вызывать побочные реакции и могут потребовать дополнительной очистки.
Кроме того, реакция HDDA может быть полезна для субстратов с чувствительной функциональностью, которые могут быть недопустимы в других условиях образования бензина (например, сильное основание). Было показано, что термически инициированная реакция HDDA переносит сложные эфиры, кетоны, защищенный амиды, эфиры, защищенный амины, арилгалогениды, алкилгалогениды, алкены, и циклопропаны.[1][4][17]
Зеленая химия
Реакция HDDA может выполнять несколько принципов зеленая химия.
- Атомная экономика - Все атомы субстрата HDDA остаются в продукте после реакции, а атомы улавливающего реагента включаются в продукт.
- Уменьшение отходов - Образование бензиновых разновидностей не дает стехиометрических побочных продуктов. Продукты часто образуются с высоким выходом и небольшим количеством побочных продуктов.
- Катализ - Реакция HDDA происходит термически или с субстехиометрическим количеством катализатор.
Синтетические приложения
Внутримолекулярный захват
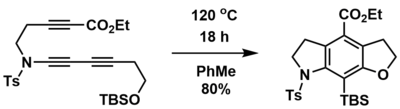
Реакция HDDA может быть использована для синтеза полициклических кольцевых систем из линейных предшественников, содержащих дин, диинофил и улавливающую группу. Например, Хой и соавторы смогли синтезировать конденсированные трициклические кольцевые системы из линейных предшественников тринов в одну стадию и с высокими выходами с помощью термически инициированной внутримолекулярной реакции HDDA.[1] Кроме того, как азот-, так и кислородсодержащие гетероциклы могут быть включены с использованием соответствующего предшественника. В этом случае подвесной илиловый эфир обеспечивал улавливающую группу через ретроспективу.Перестановка ручья.
Межмолекулярный захват
Бензины, генерируемые HDDA, также могут улавливаться межмолекулярно с помощью множества улавливающих реагентов. Тщательный выбор улавливающего реагента может добавить дополнительные функциональные возможности, включая арилгалогениды, арилгетероатомы (фенолы и анилин производные) и кратные кольцевые системы.[1][18]
Ене реакции
Реакцию HDDA можно использовать в каскадной последовательности реакций с ее реакции, такие как реакция Альдерена и реакция ароматического ена.[16][19] Бензин, образованный HDDA, может быть захвачен подходящим донором ена, который ковалентно связан с бензином. Бензин служит энофилом, а ен может быть алкеном (альдерен) или ароматическим кольцом (ароматический ен). Ли и его коллеги продемонстрировали каскадную реакцию HDDA-ольдерена, которая может давать различные продукты, включая конденсированные кольца среднего размера, спироциклы, и аллены.[16]
Хой и соавторы продемонстрировали инициируемый термически тройной каскад HDDA-ароматический ен-ольдерен, который приводит к получению сильно функционализированных продуктов за одну стадию без дополнительных реагентов или побочных продуктов.[19]
Дегидрирование
Также было показано, что бензины, производные от HDDA, дегидрогенат насыщенный алканы формировать алкены.[20] В отсутствие внешних улавливающих реагентов промежуточный бензин может выделять вицинальный (химия) атомы водорода от подходящего донора, часто реакция растворитель (Такие как тетрагидрофуран или же циклооктан). Это обесцвечивает донорный алкан, образуя алкен, и улавливает бензин в дигидробензоидный продукт. Изотопное мечение и вычислительные исследования показывают, что двойной механизм переноса водорода происходит согласованным путем и что скорость реакции сильно зависит от конформация донора алкана.[20] Эта реакция может быть использована для получения 1,2,3,4-тетразамещенных ароматических колец, схемы замещения, к которой может быть трудно получить доступ с помощью других методов синтеза.
C-H активация
Реакция HDDA также может быть использована как метод C-H активация, где кулон алкан Связь C-H улавливает металлокомплекс Арина средний. Ли и его коллеги заметили, что переходный металл катализаторы индуцировали HDDA-реакцию тетраинов, внутримолекулярно улавливаемых кулоном sp3 Связь C-H.[4] Первичные, вторичные и третичные связи C-H все были реактивными партнерами захвата, с серебро соли являются наиболее эффективными катализаторами. Маркировка дейтерием эксперименты показывают, что (sp3) Разрыв связи C-H и (sp2) Реакции образования связи C-H протекают согласованно.
Фторирование
Катализируемая серебром реакция HDDA также использовалась для синтеза фторорганический соединения с использованием фтор-содержащий противоион.[17] Ариновое промежуточное соединение с металлом может быть захвачено противоионом с образованием арильных колец с фтором, трифторметил, или же трифторметилтиол заместители. Нестабильные противоионы, такие как CF3−, может производиться на месте.
Реакция домино HDDA
Было показано, что правильно сконструированный полииновый субстрат подвергается эффективному каскадному сетевому [4 + 2] циклоприсоединению просто при нагревании.[21] Эта реакция домино-гексадегидро Дильса-Альдера инициируется образованием бензина с ограничением скорости. Проходя через промежуточные соединения нафтина, антрацина и / или тетрацина, происходит быстрый восходящий синтез высококонденсированных полициклических ароматических соединений.
Реакция аза HDDA
Нитрилы также могут участвовать в реакциях HDDA с образованием промежуточных соединений пиридина.[22] На месте захват пиридинов приводит к появлению высокозамещенных и функционализированных производных пиридина, что дополняет другие классические подходы к построению этого важного класса гетероциклов.
Рекомендации
- ^ а б c d е ж грамм час я j k Hoye, T. R .; Baire, B .; Niu, D .; Уиллоуби, П. Х .; Вудс, Б. П. Природа, 2012, 490, 208 [1]
- ^ а б c d е Holden, C .; Грини, М.Ф. Энгью. Chem. Int. Эд. Англ., 2014, 53, 5746 [2]
- ^ Yeoman, J. T. S .; Райзман, С.Э. Природа, 2012, 490, 179
- ^ а б c d Yun, S. Y .; Wang, K.-P .; Ли, Н.-К .; Mamidipalli, P .; Ли, Д. Варенье. Chem. Soc., 2013, 135, 4668 [3]
- ^ а б Вандаваси, Дж. К .; Hu, W.-P .; Hsiao, C.-T .; Senadi, G.C .; Ван, Ж.-Дж. RSC Adv., 2014, 4, 57547 [4]
- ^ а б c Аджаз, А .; Брэдли, А. З .; Burrell, R.C .; Li, W.H.H .; Дауст, К. Дж .; Bovee, L.B .; ДиРико, К. Дж .; Джонсон, Р. П. J. Org. Chem., 2011, 76, 9320 [5]
- ^ а б Liang, Y .; Hong, X .; Ага.; Хоук, К. Орг. Lett., 2014, 16, 5702 [6]
- ^ а б Брэдли, А. З .; Джонсон, Р. П. Варенье. Chem. Soc., 1997, 119, 9917 [7]
- ^ Кэхилл, К. Дж .; Аджаз, А .; Джонсон, Р. П. Aust. J. Chem., 2010, 63, 1007 [8]
- ^ а б Miyawaki, K .; Suzuki, R .; Кавано, Т .; Уэда, И. Tetrahedron Lett., 1997, 38, 3943 [9]
- ^ Ueda, I .; Sakurai, Y .; Кавано, Т .; Wada, Y .; Футаи, М. Tetrahedron Lett., 1999, 40, 319 [10]
- ^ Miyawaki, K .; Кавано, Т .; Уэда, И. Tetrahedron Lett., 2000, 41, 1447 [11]
- ^ К. Мияваки, Ф. Уэно, И. Уэда, Гетероциклы, 2001, 54, 887 [12]
- ^ Torikai, K .; Otsuka, Y .; Nishimura, M .; Сумида, М .; Kawai, T .; Сэкигучи, К .; Уэда, И. Биоорг. Med. Chem., 2008, 16, 5441 [13]
- ^ Kimura, H .; Torikai, K .; Miyawaki, K .; Уэда, И. Chem. Lett., 2008, 37, 662 [14]
- ^ а б c Кармакар, Р .; Mamidipalli, P .; Yun, S. Y .; Ли, Д. Орг. Lett., 2013, 15, 1938 [15]
- ^ а б Wang, K.-P .; Yun, S. Y .; Mamidipalli, P .; Ли, Д. Chem. Sci., 2013, 4, 3205 [16]
- ^ Niu, D .; Wang, T .; Woods, B.P .; Хойе, Т. Орг. Lett., 2014, 16, 254 [17]
- ^ а б Niu, D .; Хойе, Т. Nat. Chem., 2014, 6, 34
- ^ а б Niu, D .; Уиллоуби, П. Х .; Woods, B.P .; Baire, B .; Хойе, Т. Природа, 2013, 501, 531 [18]
- ^ Сяо, Сяо; Хой, Томас Р. (20.07.2018). «Реакция домино-гексадегидро-Дильса-Альдера превращает полинины в бензины, нафтины, антрацины, тетрацины (и не только?)». Химия природы. 10 (8): 838–844. Bibcode:2018НатЧ..10..838X. Дои:10.1038 / с41557-018-0075-у. ISSN 1755-4349. ЧВК 6284823. PMID 30030536.
- ^ Томпсон, Северин К .; Хой, Томас Р. (01.12.2019). «Реакция Аза-гексадегидро-Дильса – Альдера». Журнал Американского химического общества. 141 (50): 19575–19580. Дои:10.1021 / jacs.9b11243. ISSN 0002-7863. ЧВК 6921493. PMID 31789026.