WikiDer > Гидросилилирование - Википедия
Гидросилилирование, также называемый каталитическим гидросилированием, описывает добавление связей Si-H через ненасыщенные связи.[1] Обычно реакция проводится каталитически, и обычно субстраты ненасыщенные. органические соединения. Алкенес и алкины дать алкил и винилсиланы; альдегиды и кетоны дают силиловые эфиры. Гидросилилирование называют «самым важным применением платины в гомогенном катализе».[2]
Объем и механизм
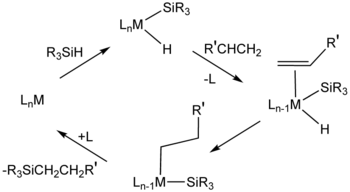
Гидросилилирование алкенов представляет собой коммерчески важный метод получения кремнийорганические соединения. Процесс механически похож на гидрирование алкенов. Фактически, подобные катализаторы иногда используются для двух каталитических процессов.
Преобладающий механизм, называемый Механизм Мела-Харрода, предполагает промежуточный металлический комплекс, содержащий гидрид, силильный лиганд (R3Si) и алкеновый субстрат. Окислительное добавление происходит за счет сигма-комплекс, в котором связь Si-H разорвана не полностью.
Гидросилилирование алкенов обычно протекает через антимарковниковское дополнение, т.е. кремний помещается на концевой углерод при гидросилилировании концевого алкена.[1] Существуют разновидности механизма Чока-Харрода. В некоторых случаях происходит введение алкена в связь M-Si с последующим восстановительным отщеплением, что противоположно последовательности в механизме Чалка-Харрода. В некоторых случаях гидросилилирование приводит к виниловым или аллильным силанам, возникающим в результате устранение бета-гидрида.[3]
Алкины также подвергаются гидросилилированию, например, добавлению триэтилсилан к дифенилацетилен:[4]
- Et3SiH + PhC≡CPh → Et3Si (Ph) C = CH (Ph)
Асимметричное гидросилилирование
С помощью хиральный фосфины как зритель лиганды, были разработаны катализаторы каталитического асимметричного гидросилирования. Хорошо изученной реакцией является добавление трихлорсилан к стирол с получением 1-фенил-1- (трихлорсилил) этана:
- Cl3SiH + PhCH = CH2 → (Ph) (CH3) CHSiCl3
Почти идеально энантиоселективность (ее) можно достичь, используя палладиевые катализаторы поддерживаются бинафтил-замещенными монофосфиновыми лигандами.[5]
Гидросилилирование поверхности
Кремниевые пластины может быть выгравирован плавиковая кислота (HF) для удаления естественного оксида и образования поверхность кремния с концевыми водородными группами. Поверхности с концевыми водородными группами подвергаются гидросилированию с помощью ненасыщенных соединений (таких как концевые алкены и алкины) с образованием стабильного монослоя на поверхности. Например:
- Si-ЧАС + H2C = CH (CH2)7CH3 → Si-CH2CHЧАС- (CH2)7CH3
Реакция гидросилилирования может быть инициирована УФ-светом при комнатной температуре или нагреванием (типичная температура реакции 120-200 ° C) в условиях отсутствия влаги и кислорода.[6] Полученный монослой, который является стабильным и инертным, препятствует окислению основного кремниевого слоя, что актуально для различных приложений устройств.[7]
Катализаторы
До введения Шпейером платиновых катализаторов гидросилилирование практически не практиковалось. Процесс, катализируемый пероксидом, был описан в академической литературе в 1947 году.[8] но введение катализатора Шпейера (ЧАС2PtCl6) был большим прорывом.
Катализатор Карстедта был представлен позже. Это липофильный комплекс, растворимый в органических субстратах, представляющих промышленный интерес.[9] Комплексы и соединения, катализирующие гидрирование, часто являются эффективными катализаторами гидросилилирования, например Катализатор Уилкинсона.
Рекомендации
- ^ а б «Гидросилилирование - всесторонний обзор последних достижений» Б. Марчинец (редактор), достижения в области науки о кремнии, Springer Science, 2009. Дои:10.1007/978-1-4020-8172-9
- ^ Renner, H .; Schlamp, G .; Kleinwächter, I .; Drost, E .; Lüschow, H.M .; Tews, P .; Panster, P .; Diehl, M .; Lang, J .; Kreuzer, T .; Knödler, A .; Starz, K. A .; Dermann, K .; Rothaut, J .; Дризельман, Р. (2002). «Металлы и соединения платиновой группы». Энциклопедия промышленной химии Ульмана. Вайли. Дои:10.1002 / 14356007.a21_075.
- ^ Troegel, D .; Сторер, Дж. (2011). «Последние достижения и актуальные проблемы в гидросилилировании олефинов, катализируемом поздними переходными металлами, с промышленной точки зрения». Coord. Chem. Rev. 255: 1440–1459. Дои:10.1016 / j.ccr.2010.12.025.
- ^ Джеймс Л. Фрай, Рональд Дж. Рахайм младший, Роберт Э. Малечка младший "Триэтилсилан", Энциклопедия реагентов для органического синтеза, Джон Уайли и сыновья, 2007. Дои:10.1002 / 047084289X.rt226.pub2
- ^ Hayashi, T .; Ямасаки, К. (2007). «Формирование связи C – E посредством асимметричного гидросилилирования алкенов». В Crabtree, Robert H .; Д. Майкл П. Мингос (ред.). Комплексная металлоорганическая химия III. Амстердам: Эльзевир. Дои:10.1016 / B0-08-045047-4 / 00140-0. ISBN 978-0-08-045047-6.
- ^ «Фотореактивность ненасыщенных соединений с кремнием с концевыми водородными группами (111)», Р. Л. Цицеро, М. Р. Линфорд, К. Э. Д. Чидси, Langmuir 16, 5688-5695 (2000)
- ^ Прямое электрическое обнаружение гибридизации ДНК на ДНК-модифицированных кремниевых поверхностях, W.Cai, J. Peck, D. van der Weide и R.J. Hamers, Biosensors and Bioelectronics 19, 1013-1019 (2004).
- ^ Sommer, L .; Pietrusza, E .; Whitmore, F. "Катализируемое пероксидом присоединение трихлорсилана к 1-октену". Варенье. Chem. Soc. 69 (1): 188. Дои:10.1021 / ja01193a508.
- ^ К. Эльшенбройх, Металлоорганические соединения (2006) Wiley and Sons-VCH: Weinheim. ISBN 978-3-527-29390-2
дальнейшее чтение
- Прикладной гомогенный катализ металлорганическими соединениями: подробный справочник: приложения, разработки. Бой Корнилс; W A. Herrmann. Издатель: Weinheim; Нью-Йорк: Wiley-VCH, © 2000.
- Подробное руководство по гидросилилированию. Богдан Марцинец. Издатель: Оксфорд [u.a.]: Pergamon Press, 1992.
- Комплексы родия как катализаторы гидросилилирования. Н.К. Скворцов. // Родий Экспресс. 1994. № 4 (май). С. 3 - 36 (англ.). [1] ISSN 0869-7876
Дополнительная специализированная литература
- «Алкильные монослои на кремнии, полученные из 1-алкенов и кремния с концевыми водородными группами», M. R. Linford, P. Fenter, P. M. Eisenberger и C. E. D. Chidsey, J. Am. Chem. Soc. 117, 3145-3155 (1995).
- «Синтез и характеристика ДНК-модифицированных поверхностей Si (111)», Т. Стротер, W. CAi, X. Zhao, R.J. Hamers, L.M. Smith, J. Am. Chem. Soc. 122, 1205-1209 (2000).
- "Т. Стротер, Р. Дж. Хамерс и Л. М. Смит," Химия поверхности ковалентного прикрепления ДНК к поверхности кремния (100) ". Langmuir, 2002, 18, 788-796.
- «Ковалентно модифицированные поверхности кремния и алмаза: устойчивость к неспецифической адсорбции белков и оптимизация для биочувствительности», T.L. Лассетер, Б. Клэр, Н. Эбботт, Р.Дж. Хамерс. Варенье. Chem. Soc. 2004, 126, 10220-10221.