WikiDer > Метилазид - Википедия
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Азидометан | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| CH3N3 | |||
| Молярная масса | 57.05 | ||
| Внешность | белый порошок | ||
| слабо растворимый | |||
| Растворимость | алкан, эфир | ||
| Взрывоопасные данные | |||
| Чувствительность к ударам | Высоко | ||
| Чувствительность к трению | Высоко | ||
| Опасности | |||
| Главный опасности | Очень взрывоопасен | ||
| Родственные соединения | |||
Родственные соединения | Гидразойная кислота, Азид хлора, Этилазид | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
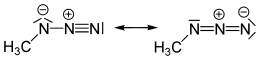
Метилазид ковалентная молекула, относящаяся к гидразойная кислота и другие алкилазиды.
Подготовка и свойства
Метилазид может быть получен метилирование из азид натрия, например, с диметилсульфат в щелочном растворе с последующим пропусканием через трубку безводного хлорид кальция или же едкий натр удалить загрязняющие гидразойная кислота.[1] О первом синтезе было сообщено в 1905 году.[2]
Он разлагается в реакция первого порядка:[3]
- CH3N3 → CH3N + N2
Метилазид может быть потенциальным прекурсором в синтезе пребиотических молекул через неравновесные реакции на межзвездные льды инициированный энергичным галактические космические лучи (GCR) и фотоны.[4]
Меры предосторожности
Метилазид стабилен при температуре окружающей среды, но может взорваться при нагревании. Присутствие Меркурий повышает чувствительность к ударам и искрам. Несовместим с метанолом и диметилмалонат.[5] При нагревании до разложения выделяет токсичные пары NO.Икс.[нужна цитата] Его можно хранить неограниченно долго в темноте при температуре −80 ° C.[1]
Рекомендации
- ^ а б Чэ, Чонхён (2008-03-14), «Метил Азид», в John Wiley & Sons, Ltd (ред.), Энциклопедия реагентов для органического синтеза, Чичестер, Великобритания: John Wiley & Sons, Ltd, стр. Rn00795, Дои:10.1002 / 047084289x.rn00795, ISBN 978-0-471-93623-7
- ^ Dimroth, O .; Wislicenus, W. (1905). "Убер дас метилазид". Berichte der Deutschen Chemischen Gesellschaft. 38 (2): 1573–1576. Дои:10.1002 / cber.19050380254.
- ^ О'Делл, М. С .; Дарвент, Б. (1970). «Термическое разложение метилазида». Канадский химический журнал. 48 (7): 1140–1147. Дои:10.1139 / v70-187.
- ^ Quinto-Hernandez, A .; Wodtke, A.M .; Bennett, C.J .; Kim, Y. S .; Кайзер, Р. И. (2011). «О взаимодействии метилазида (CH3N3) Лед с ионизирующим излучением: образование метанимина (CH2NH), цианистый водород (HCN) и изоцианид водорода (HNC) ». Журнал физической химии A. 115 (3): 250–264. Дои:10.1021 / jp103028v. PMID 21162584.
- ^ Урбен, П. Г., изд. (2006). Справочник Бретерика по опасностям, связанным с химически активными веществами (7-е изд.). Эльзевир. ISBN 9780123725639.
внешняя ссылка
- Graner, G .; Hirota, E .; Иидзима, Т .; Kuchitsu, K .; Ramsay, D.A .; Vogt, J .; Фогт, Н. (1999). "CH3N3 Метилазид ». В Kuchitsu, K. (ed.). Молекулы и радикалы группы II: числовые данные и функциональные взаимосвязи в науке и технологиях. Ландольт-Бернштейн - молекулы и радикалы группы II. 25 млрд. п. 1. Дои:10.1007/10653318_320. ISBN 3-540-63645-5.
- «Метилазид». Интернет-книга NIST. Национальный институт стандартов и технологий.
| HN3 | Он | ||||||||||||||||||
| LiN3 | Бен3)2 | B (N3)3 | CH3N3, C (N3)4 | N (N3)3,ЧАС2N — N3 | О | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Si (N3)4 | п | ТАК2(N3)2 | ClN3 | Ar | ||||||||||||
| КН3 | Может3)2 | Sc (N3)3 | Банка3)4 | VO (N3)3 | Cr (N3)3, CrO2(N3)2 | Mn (N3)2 | Fe (N3)2, Fe (N3)3 | Против3)2, Против3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | В качестве | Se (N3)4 | BrN3 | Kr | ||
| Руб.3 | Sr (N3)2 | Y | Zr (N3)4 | Nb | Пн | Tc | Пробег3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (N3)2 | В | Sn | Sb | Te | В3 | Xe (N3)2 | ||
| CsN3 | Ba (N3)2 | Hf | Та | W | Re | Операционные системы | Ir (N3)63− | Pt (N3)62− | Au (N3)4− | Hg2(N3)2, Hg (N3)2 | TlN3 | Pb (N3)2 | Би (N3)3 | По | В | Rn | |||
| Пт | Ra (N3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла | Ce (N3)3, Ce (N3)4 | Pr | Nd | Вечера | См | Европа | Gd (N3)3 | Tb | Dy | Хо | Э | Тм | Yb | Лу | |||||
| Ac | Чт | Па | UO2(N3)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||

