WikiDer > Азид калия
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Азид калия | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ECHA InfoCard | 100.039.997 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Свойства | |||
| КН 3 | |||
| Молярная масса | 81,1184 г / моль | ||
| Внешность | Бесцветные кристаллы[1] | ||
| Плотность | 2,038 г / см3 [1] | ||
| Температура плавления | 350 ° С (662 ° F, 623 К) (в вакууме)[1] | ||
| Точка кипения | разлагается | ||
| 41,4 г / 100 мл (0 ° С) 50,8 г / 100 мл (20 ° С) 105,7 г / 100 мл (100 ° С) | |||
| Растворимость | растворим в этиловый спирт не растворим в эфир | ||
| Термохимия | |||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -1,7 кДж / моль | ||
| Опасности | |||
| Основной опасности | Очень токсичен, взрывоопасен при сильном нагревании | ||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза) | 27 мг / кг (перорально, крыса)[2] | ||
| Родственные соединения | |||
Другой катионы | Азид натрия, азид меди (II), азид свинца (II), азид серебра | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Азид калия это неорганическое соединение имея формулу КН
3. Это белый водорастворимый поваренная соль. Он используется как реагент в лаборатории.
Было обнаружено, что он действует как ингибитор нитрификации в почве.[3]
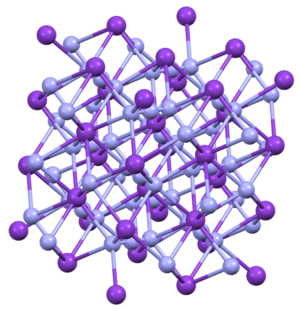
Структура
КН3, Руб.3, CsN3, и TlN3 принять те же структуры. Они кристаллизуются по форме тетрагональной формы.[4] Азид связан с восемью катионами в затменной ориентации. Катионы связаны с восемью концевыми N центрами.[5]
Синтез и реакции
КН3 готовится путем обработки карбонат калия с участием гидразойная кислота, который генерируется на месте.[6] Напротив, аналогичный азид натрия готовится (промышленным способом) компанией "Wislicenus процесс », который протекает по реакции амида натрия с оксид азота.[7]
При нагревании или облучении ультрафиолетом разлагается на металлический калий и азот газ.[8] Температуры разложения азидов щелочных металлов: NaN3 (275 ° C), кН3 (355 ° С), руб.3 (395 ° С), CsN3 (390 ° С).[9]
Опасности для здоровья
подобно азид натрия, азид калия очень токсичен. В TLV связанного азида натрия составляет 0,07 частей на миллион. Токсичность азидов обусловлена их способностью ингибировать цитохром с оксидаза.[7]
использованная литература
- ^ а б c Дейл Л. Перри; Сидни Л. Филлипс (1995). Справочник неорганических соединений. CRC Press. п. 301. ISBN 0-8493-8671-3.
- ^ http://chem.sis.nlm.nih.gov/chemidplus/rn/20762-60-1
- ^ Т. Д. Хьюз; Л. Ф. Велч (1970). «Азид калия как ингибитор нитрификации». Агрономический журнал. Американское агрономическое общество. 62: 595–599. Дои:10.2134 / agronj1970.00021962006200050013x.
- ^ Khilji, M. Y .; Sherman, W. F .; Уилкинсон, Г. Р. (1982). "Рамановские спектры азида калия при переменной температуре и давлении. КН
3". Журнал Рамановской спектроскопии. 12 (3): 300–303. Bibcode:1982JRSp ... 12..300K. Дои:10.1002 / jrs.1250120319. - ^ Ульрих Мюллер "Verfeinerung der Kristallstrukturen von KN"3, Руб.3, CsN3 и ИНН3"Zeitschrift für anorganische und allgemeine Chemie 1972, Volume 392, 159–166." Дои:10.1002 / zaac.19723920207
- ^ П. В. Шенк «Азиды щелочных металлов из карбонатов» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1. п. 475.
- ^ а б Хорст Х. Джобелиус, Ханс-Дитер Шарфф «Гидразойная кислота и азиды» в Энциклопедии промышленной химии Ульмана, 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a13_193
- ^ Tompkins, F.C .; Янг, Д. А. (1982). «Фотохимическое и термическое образование центров окраски в кристаллах азида калия». Труды Лондонского королевского общества. Серия А, Математические и физические науки. 236 (1204): 10–23.
- ^ Э. Дёнгес «Щелочные металлы» в Справочнике по препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1. п. 475.
Соли и ковалентные производные азид ион | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | Он | ||||||||||||||||||
| LiN3 | Бен3)2 | B (N3)3 | CH3N3, C (N3)4 | N (N3)3,ЧАС2N — N3 | О | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Si (N3)4 | п | ТАК2(N3)2 | ClN3 | Ar | ||||||||||||
| КН3 | Мочь3)2 | Sc (N3)3 | Банка3)4 | VO (N3)3 | Cr (N3)3, CrO2(N3)2 | Mn (N3)2 | Fe (N3)2, Fe (N3)3 | Против3)2, Против3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Так как | Se (N3)4 | BrN3 | Kr | ||
| Руб.3 | Sr (N3)2 | Y | Zr (N3)4 | Nb | Пн | Tc | Бегать3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (N3)2 | В | Sn | Sb | Te | В3 | Xe (N3)2 | ||
| CsN3 | Ba (N3)2 | Hf | Та | W | Re | Операционные системы | Ir (N3)63− | Pt (N3)62− | Au (N3)4− | Hg2(N3)2, Hg (N3)2 | TlN3 | Pb (N3)2 | Би (N3)3 | По | В | Rn | |||
| Пт | Ra (N3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла | Ce (N3)3, Ce (N3)4 | Pr | Nd | Вечера | См | ЕС | Gd (N3)3 | Tb | Dy | Хо | Э | Тм | Yb | Лу | |||||
| Ac | Чт | Па | UO2(N3)2 | Np | Пу | Am | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||

