WikiDer > Нерасхождение
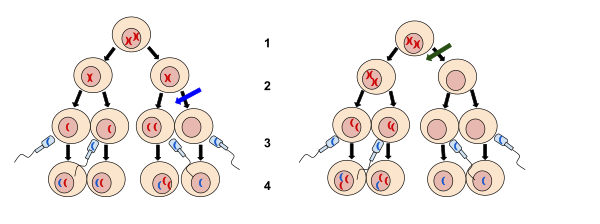
2. Мейоз II
3. Удобрение
4. Зигота
Левое изображение у синей стрелки - нерасхождение, происходящее во время мейоза II. Правое изображение у зеленой стрелки - это нерасхождение, имеющее место во время мейоза I. Нерасхождение - это когда хромосомы не могут нормально разделиться, что приводит к увеличению или уменьшению хромосом.
Нерасхождение это провал гомологичные хромосомы или сестринские хроматиды правильно разделиться во время деление клеток. Есть три формы нерасхождения: отказ пары гомологичные хромосомы разделиться в мейоз I, неспособность сестринских хроматид разделиться во время мейоз II, и неспособность сестринских хроматид разделиться во время митоз.[1][2][3] Нерасхождение приводит к дочерним клеткам с аномальным числом хромосом (анеуплоидия).
Calvin Bridges и Томас Хант Морган приписывают открытие нерасхождения в Drosophila melanogaster половые хромосомы весной 1910 года, работая в зоологической лаборатории Колумбийского университета.[4]
Типы
В общем, нерасхождение может происходить при любой форме клеточного деления, которое включает упорядоченное распределение хромосомного материала. У высших животных есть три различных формы таких клеточных делений: Мейоз I и мейоз II специализированные формы деления клеток, происходящие во время генерации гаметы (яйца и сперма) для полового размножения, митоз это форма деления клеток, используемая всеми другими клетками тела.
Мейоз II
Овулированные яйца задерживаются в метафазе II до тех пор, пока оплодотворение запускает второе деление мейоза.[5] Подобно событиям сегрегации митоз, пары сестры хроматиды в результате разделения бивалентов в мейоз I далее разделены на анафаза из мейоз II. В ооцитах одна сестринская хроматида отделена от второго полярного тельца, а другая остается внутри яйца. В течение сперматогенез, каждое мейотическое деление симметрично, так что каждое первичное сперматоцит дает начало 2 вторичным сперматоцитам после мейоза I, и в конечном итоге 4 сперматиды после мейоза II.
Нерасхождение мейоза II также может привести к анеуплоидия синдромов, но только в гораздо меньшей степени, чем сегрегация сбои в мейозе I.[6]

Осталось: Метафаза митоза. Хромосомы выстраиваются в средней плоскости, формируется митотическое веретено, а кинетохоры сестринских хроматид прикрепляются к микротрубочкам.
Правильно: Анафаза митоза, когда сестринские хроматиды разделяются, и микротрубочки тянут их в противоположных направлениях.
Хромосома, показанная на красный не может должным образом разделиться, его сестринские хроматиды слипаются и притягиваются к одной стороне, что приводит к митотическому нерасхождению этой хромосомы.
Митоз
Отдел соматический клеткам через митоз предшествует репликация генетического материала в Фаза S. В результате каждая хромосома состоит из двух сестринских хроматиды вместе в центромера. в анафаза из митоз, сестра хроматиды отделяются и мигрируют к противоположным полюсам клетки до того, как клетка делится. Нерасхождение во время митоз приводит к тому, что одна дочь получает обе сестры хроматиды пораженной хромосомы, в то время как другая не получает.[2][3] Это известно как хроматиновый мостик или анафазный мост. Митотическое нерасхождение приводит к соматическому мозаика, поскольку только дочерние клетки, происходящие из клетки, где произошло событие нерасхождения, будут иметь аномальное количество хромосомы.[3] Нерасхождение во время митоза может способствовать развитию некоторых форм рак, например ретинобластома (Смотри ниже).[7]Нерасхождение хромосом в митозе можно объяснить инактивацией топоизомераза II, конденсин, или же отделить.[8]Мейотическое нерасхождение хорошо изучено в Saccharomyces cerevisiae. Эти дрожжи претерпевают митоз, как и другие эукариоты. Хромосомные мостики возникают, когда сестринские хроматиды удерживаются вместе после репликации топологическим переплетением ДНК-ДНК и сплоченность сложный.[9] Во время анафазы когезин расщепляется сепарацией.[10] Топоизомераза II и конденсин отвечают за удаление связи.[11]
Молекулярные механизмы
Центральная роль контрольной точки сборки шпинделя
В КПП шпиндельной сборки (SAC) - это молекулярный механизм защиты, который управляет сегрегация хромосом в эукариотических клетках.[12]SAC подавляет прогрессию в анафазу до тех пор, пока все гомологичные хромосомы (биваленты или тетрады) не будут правильно выровнены с шпиндельный аппарат. Только тогда SAC прекращает свое подавление комплекс, способствующий анафазе (APC), что, в свою очередь, необратимо запускает анафазу.
Половые различия в мейозе
Обзоры случаев синдромов анеуплоидии у человека показали, что большинство из них имеют материнское происхождение.[5] Возникает вопрос: почему женский мейоз более подвержен ошибкам? Наиболее очевидное различие между женским оогенезом и мужским сперматогенезом - это длительная остановка ооцитов на поздних стадиях профаза I от многих лет до нескольких десятилетий. С другой стороны, мужские гаметы быстро проходят все стадии I и II мейоза. Еще одно важное различие между мужским и женским мейозом касается частоты рекомбинации между гомологичными хромосомами: у мужчин почти все пары хромосом соединены по крайней мере одним кроссовер, в то время как более 10% человеческих ооцитов содержат по крайней мере один бивалент без какого-либо перекрестного события. Неудачи рекомбинации или неправильно расположенные кроссоверы хорошо задокументированы как способствующие возникновению нерасхождения у людей.[5]
Из-за длительного ареста человеческих ооцитов, ослабление когезионных связей, удерживающих вместе хромосомы, и снижение активности SAC могут способствовать возрастным ошибкам матери. сегрегация контроль.[6][13]В когезин комплекс отвечает за удержание вместе сестринских хроматид и обеспечивает сайты связывания для прикрепления веретена. Когезин загружается на вновь реплицированные хромосомы в оогония во время внутриутробного развития. Зрелые ооциты имеют только ограниченную способность перезаряжать когезин после завершения Фаза S. Поэтому длительная остановка человеческих ооцитов до завершения мейоза I может со временем привести к значительной потере когезина. Предполагается, что потеря когезина способствует неправильному микротрубочка-кинетохора ошибки прикрепления и сегрегации хромосом во время мейотических делений.[6]
Последствия
Результатом этой ошибки является клетка с дисбалансом хромосом. Такая ячейка называется анеуплоид. Потеря одной хромосомы (2n-1), при которой дочерние клетки с дефектом будут иметь одну хромосому, отсутствующую в одной из своих пар, называется моносомия. Получение одной хромосомы, в которой дочерняя клетка (клетки) с дефектом будет иметь одну хромосому в дополнение к ее парам, называется трисомия.[3] В случае оплодотворения анеуплоидной гаметы может возникнуть ряд синдромов.
Моносомия
Единственная известная выживаемая моносомия у людей - это Синдром Тернера, где пораженный индивидуум моносомен для Х хромосома (Смотри ниже). Другие моносомии обычно приводят к летальному исходу на раннем этапе развития плода, и выживание возможно только в том случае, если не все клетки тела поражены в случае мозаика (см. ниже), или если нормальное количество хромосом восстанавливается посредством дупликации единственной моносомной хромосомы («спасение хромосом»).[2]
Синдром Тернера (X-моносомия) (45, X0)
Полная потеря всей Х-хромосомы составляет около половины случаев Синдром Тернера. Важность обеих Х-хромосом во время эмбрионального развития подчеркивается наблюдением, что подавляющее большинство (> 99%) плодов только с одной Х-хромосомой (кариотип 45, X0) самопроизвольно прерываются.[14]
Аутосомная трисомия
Термин аутосомная трисомия означает, что хромосома, отличная от половых хромосом X и Y, присутствует в 3 копиях вместо нормального числа 2 в диплоидных клетках.
Синдром Дауна (трисомия 21)
Синдром Дауна, трисомия хромосомы 21, является наиболее частой аномалией числа хромосом у людей.[2] Большинство случаев является результатом нерасхождения во время материнского мейоза I.[14] Трисомия встречается не менее чем у 0,3% новорожденных и почти у 25% новорожденных. самопроизвольные аборты. Это основная причина прерывания беременности и наиболее частая известная причина умственная отсталость.[15] Хорошо задокументировано, что преклонный возраст матери связан с повышенным риском мейотического нерасхождения, ведущего к синдрому Дауна. Это может быть связано с длительной остановкой мейоза ооцитов человека, которая может длиться более четырех десятилетий.[13]
Синдром Эдвардса (трисомия 18) и синдром Патау (трисомия 13)
Человеческие трисомии, совместимые с живорождением, кроме Синдром Дауна (трисомия 21), являются Синдром Эдвардса (трисомия 18) и Синдром Патау (трисомия 13).[1][2] Полная трисомия других хромосом обычно нежизнеспособна и является относительно частой причиной выкидыша. Только в редких случаях мозаика, наличие нормальной клеточной линии в дополнение к трисомной клеточной линии может поддерживать развитие жизнеспособной трисомии других хромосом.[2]
Анеуплоидия половых хромосом
Период, термин анеуплоидия половых хромосом суммирует состояния с ненормальным количеством половых хромосом, то есть отличных от ХХ (женские) или XY (мужские). Формально моносомия Х хромосомы (Синдром Тернера, см. выше) также можно отнести к одной из форм анеуплоидии половых хромосом.
Синдром Клайнфельтера (47, XXY)
Синдром Клайнфельтера является наиболее распространенной анеуплоидией половых хромосом у человека. Он представляет собой наиболее частую причину гипогонадизм и бесплодие у мужчин. Большинство случаев вызвано ошибками нерасхождения в отцовском мейозе I.[2] Около восьмидесяти процентов людей с этим синдромом имеют одну дополнительную Х-хромосому, что приводит к кариотип XXY. Остальные случаи имеют либо несколько дополнительных половых хромосом (48, XXXY; 48, XXYY; 49, XXXXY), мозаицизм (46, XY / 47, XXY), либо структурные хромосомные аномалии.[2]
XYY Мужской (47, XYY)
Заболеваемость XYY синдром составляет примерно 1 на 800–1000 новорожденных мальчиков. Многие случаи остаются невыявленными из-за их нормального внешнего вида и фертильности, а также отсутствия серьезных симптомов. Дополнительная Y-хромосома обычно является результатом нерасхождения во время отцовского мейоза II.[2]
Трисомия X (47, XXX)
Трисомия X - форма анеуплоидии половых хромосом, при которой у женщин три Х-хромосомы вместо двух. На большинство пациентов нейропсихологические и физические симптомы незначительно влияют. Исследования, изучающие происхождение дополнительной Х-хромосомы, показали, что около 58-63% случаев были вызваны нерасхождением в материнском мейозе I, 16-18% - нерасхождением в материнском мейозе II, а остальные случаи - постзиготическими, т.е. нерасхождение.[16]
Однородительская дисомия
Однородительская дисомия обозначает ситуацию, когда обе хромосомы пары хромосом унаследованы от одного и того же родителя и поэтому идентичны. Это явление, скорее всего, является результатом беременности, которая началась как трисомия из-за нерасхождения. Поскольку большинство трисомий смертельны, плод выживает только потому, что он теряет одну из трех хромосом и становится дисомным. Однородительская дисомия хромосомы 15, например, наблюдается в некоторых случаях Прадер-Вилли синдром и Синдром ангельмана.[14]
Синдромы мозаицизма
Мозаицизм синдромы могут быть вызваны митотическим нерасхождением на раннем этапе развития плода. Как следствие, организм развивается как смесь клеточных линий с разными плоидность (количество хромосом). Мозаицизм может присутствовать в одних тканях, но не в других. Пораженные люди могут иметь неоднородный или ассиметричный вид. Примеры синдромов мозаицизма включают: Синдром Паллистера-Киллиана и Гипомеланоз Ито.[14]
Мозаицизм в злокачественной трансформации

При первом попадании на ген-супрессор опухоли на одной из двух хромосом воздействует мутация, которая делает продукт гена нефункциональным. Эта мутация может возникать спонтанно как ошибка репликации ДНК или может быть вызвана агентом, повреждающим ДНК. Второе попадание удаляет оставшуюся хромосому дикого типа, например, через митотическое нерасхождение мероприятие. Существует несколько других потенциальных механизмов для каждого из двух этапов, например, дополнительная мутация, несбалансированная транслокация или делеция гена путем рекомбинации. В результате двойного поражения клетка может стать злокачественной, поскольку она больше не способна экспрессировать белок-супрессор опухоли.
Развитие рака часто связано с множественными изменениями клеточного генома (Гипотеза Кнудсона). Человек ретинобластома представляет собой хорошо изученный пример типа рака, где митотическое нерасхождение может способствовать злокачественной трансформации: мутации гена RB1, который расположен на хромосоме 13 и кодирует опухолевый супрессор белок ретинобластомы, может быть обнаружен цитогенетическим анализом во многих случаях ретинобластомы. Мутации локуса RB1 в одной копии хромосомы 13 иногда сопровождаются потерей другой хромосомы 13 дикого типа из-за митотического нерасхождения. Из-за этой комбинации поражений пораженные клетки полностью теряют экспрессию функционирующего белка-супрессора опухоли.[7]
Диагностика
Преимплантационная генетическая диагностика
Преимплантационная генетическая диагностика (PGD или PIGD) это метод, используемый для идентификации генетически нормальных эмбрионы и полезен для пар, у которых есть семейная история генетических нарушений. Это вариант для людей, которые хотят производить потомство через ЭКО. ПГД считается сложным из-за того, что она занимает много времени и имеет показатели успеха, сравнимые только с рутинным ЭКО.[17]
Кариотипирование
Кариотипирование включает выполнение амниоцентез с целью изучения клеток будущего плода в метафазе 1. Световая микроскопия может использоваться, чтобы визуально определить, является ли анеуплоидия проблемой.[18]
Диагностика полярного тела
Диагностика полярного тела (PBD) можно использовать для обнаружения материнских хромосомных анеуплоидий, а также транслокаций в ооцитах. Преимущество PBD перед PGD заключается в том, что его можно выполнить за короткое время. Это достигается с помощью зонного или лазерного сверления.[19]
Биопсия бластомера
Бластомер биопсия - это метод удаления бластомеров из zona pellucida. Обычно используется для выявления анеуплоидии.[20] После завершения процедуры проводится генетический анализ. Для оценки риска, связанного с процедурой, необходимы дополнительные исследования.[21]
Образ жизни / опасности для окружающей среды
Воздействие на сперматозоиды опасностей, связанных с образом жизни, окружающей средой и / или профессиональной деятельностью, может увеличить риск анеуплоидии. Сигаретный дым - известный aneugen (анеуплоидия индуцирующий агент). Это связано с увеличением анеуплоидии в 1,5–3,0 раза.[22][23] Другие исследования указывают на такие факторы, как употребление алкоголя,[24] профессиональное воздействие бензол,[25] и воздействие инсектицидов фенвалерат[26] и карбарил[27] также увеличивают анеуплоидию.
Рекомендации
- ^ а б Симмонс, Д. Питер Снустад, Майкл Дж. (2006). Принципы генетики (4-е изд.). Нью-Йорк, штат Нью-Йорк [u.a.]: Wiley. ISBN 9780471699392.
- ^ а б c d е ж грамм час я Bacino, C.A .; Ли, Б. (2011). «Глава 76: Цитогенетика». In Kliegman, R.M .; Стэнтон, Б.Ф .; St. Geme, J.W .; Schor, N.F .; Берман, Р. (ред.). Учебник педиатрии Нельсона, 19-е издание (19-е изд.). Филадельфия: Сондерс. С. 394–413. ISBN 9781437707557.
- ^ а б c d Страчан, Том; Прочтите, Эндрю (2011). Молекулярная генетика человека (4-е изд.). Нью-Йорк: Наука о гирляндах. ISBN 9780815341499.
- ^ Томас Хант Морган (31 августа 2012 г.). Наследование, связанное с полом у дрозофилы. Улан Пресс. С. 10–11.
- ^ а б c Нагаока, SI; Хассольд, Т.Дж.; Хант, Пенсильвания (18 июня 2012 г.). «Анеуплоидия человека: механизмы и новое понимание вековой проблемы». Природа Обзоры Генетика. 13 (7): 493–504. Дои:10.1038 / nrg3245. ЧВК 3551553. PMID 22705668.
- ^ а б c Джонс, К. Т .; Лейн, С. И. Р. (27 августа 2013 г.). «Молекулярные причины анеуплоидии в яйцах млекопитающих». Разработка. 140 (18): 3719–3730. Дои:10.1242 / dev.090589. PMID 23981655.
- ^ а б редакторы, Чарльз Р. Скрайвер ... []; и другие. (2005). Метаболические и молекулярные основы наследственных заболеваний в Интернете (8-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 9780079130358.
- ^ Кеведо, О; Гарсиа-Луис, Дж; Матос-Пердомо, Э; Арагон, L; Мачин, Ф (2012). «Нерасхождение одной хромосомы приводит к разрыву и активации контрольной точки повреждения ДНК в G2». PLOS Genetics. 8 (2): e1002509. Дои:10.1371 / journal.pgen.1002509. ЧВК 3280967. PMID 22363215.
- ^ Ваахтокари, А; Аберг, Т; Thesleff, I (январь 1996 г.). «Апоптоз в развивающемся зубе: связь с эмбриональным сигнальным центром и подавление EGF и FGF-4». Разработка. 122 (1): 121–9. PMID 8565823.
- ^ Бэнкс, П (февраль 1977 г.). «Изменения пульпы после субапикальной остеотомии передней нижней челюсти на модели приматов». Журнал челюстно-лицевой хирургии. 5 (1): 39–48. Дои:10.1016 / s0301-0503 (77) 80074-х. PMID 0403247.
- ^ Holm, C; Гото, Т; Wang, JC; Ботштейн, Д. (июнь 1985 г.). «ДНК-топоизомераза II необходима во время митоза у дрожжей». Клетка. 41 (2): 553–63. Дои:10.1016 / s0092-8674 (85) 80028-3. PMID 2985283.
- ^ Sun, S.-C .; Ким, Н.-Х. (14 ноября 2011 г.). «КПП шпиндельной сборки и ее регуляторы в мейозе». Обновление репродукции человека. 18 (1): 60–72. Дои:10.1093 / humupd / dmr044. PMID 22086113.
- ^ а б Эйхенлауб-Риттер, Урсула (2012). «Старение ооцита и его клеточная основа». Международный журнал биологии развития. 56 (10–11–12): 841–852. Дои:10.1387 / ijdb.120141ue. PMID 23417406.
- ^ а б c d Глисон, [отредактированный] Х. Уильямом Тэушем, Робертой А. Баллард, Кристиной А. (2005). Болезни Эйвери новорожденных (8-е изд.). Филадельфия, Пенсильвания: W.B. Сондерс. ISBN 978-0721693477.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Koehler, KE; Хоули, РС; Шерман, С; Хассольд, Т. (1996). «Рекомбинация и нерасхождение у человека и мух». Молекулярная генетика человека. 5 Спецификация №: 1495–504. Дои:10.1093 / hmg / 5.Supplement_1.1495. PMID 8875256.
- ^ Tartaglia, NR; Хауэлл, S; Сазерленд, А; Wilson, R; Уилсон, Л. (11 мая 2010 г.). «Обзор трисомии X (47, XXX)». Журнал редких заболеваний Orphanet. 5: 8. Дои:10.1186/1750-1172-5-8. ЧВК 2883963. PMID 20459843.
- ^ Харпер, JC; Хартон Дж. (2010). «Использование массивов в преимплантационной генетической диагностике и скрининге». Fertil Steril. 94 (4): 1173–1177. Дои:10.1016 / j.fertnstert.2010.04.064. PMID 20579641.
- ^ «Кариотипирование». Национальный институт здоровья. Получено 7 мая 2014.
- ^ Монтэг, М. ван дер Вен, К; Розинг, B; ван дер Вен, H; Розинг, B; Ван дер Вен, Х (2009). «Биопсия полярного тела: реальная альтернатива доимплантационной генетической диагностике и скринингу». Репродуктивная биомедицина онлайн. 18 Дополнение 1: 6–11. Дои:10.1016 / с 1472-6483 (10) 60109-5. PMID 19281658.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Парнес, Ю.М. (март – апрель 1989 г.). «Противоречие RCT». Журнал акушерства, гинекологии и неонатального ухода. 18 (2): 90. Дои:10.1111 / j.1552-6909.1989.tb00470.x. PMID 2709181.
- ^ Yu, Y; Чжао, Y; Li, R; Ли, Л; Чжао, H; Ли, М; Ша, Дж; Чжоу, Q; Цяо, Дж (6 декабря 2013 г.). «Оценка риска биопсии бластомера во время преимплантационной генетической диагностики на модели мышей: снижение функции яичников у самок с увеличением возраста методом протеомики». Журнал протеомных исследований. 12 (12): 5475–86. Дои:10.1021 / pr400366j. PMID 24156634.
- ^ Ши К., Ко Э, Барклай Л., Хоанг Т., Радемейкер А., Мартин Р. (2001). «Курение сигарет и анеуплоидия в сперме человека». Мол. Репродукция. Dev. 59 (4): 417–21. Дои:10.1002 / мрд.1048. PMID 11468778.
- ^ Рубес Дж., Лоу X, Мур Д., Перро С., Слот V, Эвенсон Д., Селеван С. Г., Вайробек А. Дж. (1998). «Курение сигарет связано с повышенной дисомией сперматозоидов у мужчин-подростков». Fertil. Стерил. 70 (4): 715–23. Дои:10.1016 / S0015-0282 (98) 00261-1. PMID 9797104.
- ^ Бенасси-Эванс Б., Фенек М. (2011). «Хроническое воздействие алкоголя вызывает повреждение генома, измеренное с помощью анализа цитомного микроядра с блокировкой цитокинеза, и анеуплоидию в линиях B-лимфобластоидных клеток человека». Мутагенез. 26 (3): 421–9. Дои:10.1093 / mutage / geq110. PMID 21273273.
- ^ Макхейл CM, Смит MT, Zhang L (2014). «Применение токсикогеномного профилирования для оценки воздействия бензола и формальдегида: от дрожжей до человека». Анна. Акад. Наука. 1310: 74–83. Дои:10.1111 / nyas.12382. ЧВК 3978411. PMID 24571325.
- ^ Ся Й, Бянь Q, Сюй Л., Ченг С., Сонг Л., Лю Дж., Ву В., Ван С., Ван Х (2004). «Генотоксическое воздействие на сперматозоиды человека у рабочих завода по производству пестицидов, подвергшихся воздействию фенвалерата». Токсикология. 203 (1–3): 49–60. Дои:10.1016 / j.tox.2004.05.018. PMID 15363581.
- ^ Ся И, Ченг С., Биан Кью, Сюй Л., Коллинз, доктор медицины, Чанг Х.С., Сон Л., Лю Дж., Ван С., Ван Х (2005). «Генотоксическое воздействие на сперматозоиды рабочих, подвергшихся воздействию карбарила». Toxicol. Наука. 85 (1): 615–23. Дои:10.1093 / toxsci / kfi066. PMID 15615886.