WikiDer > Окисление первичных спиртов до карбоновых кислот
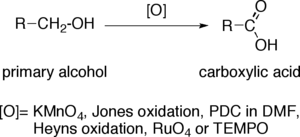
В окисление первичных спиртов до карбоновых кислот это важный окисление реакция в органическая химия.
Когда первичный спирт преобразуется в карбоновая кислота, концевой атом углерода увеличивает степень окисления на четыре. Окислители, способные выполнять эту операцию в сложных органических молекулах, содержащих другие чувствительные к окислению функциональные группы, должны обладать значительной селективностью. Наиболее распространенные окислители: перманганат калия (KMnO4), Реактив Джонса, PCC в DMF, Окисление Хейнса, четырехокись рутения (RuO4) и ТЕМП.
Перманганат калия
Перманганат калия (KMnO4) является очень сильным окислителем, способным реагировать со многими функциональными группами, такими как вторичные спирты, 1,2-диолы, альдегиды, алкены, оксимы, сульфиды и тиолы. В контролируемых условиях KMnO4 очень эффективно окисляет первичные спирты до карбоновых кислот. Эта реакция, впервые подробно описанная Фурнье,[1][2] обычно осуществляется добавлением KMnO4 к раствору или суспензии спирта в щелочном водном растворе. Полученную смесь перемешивают до полного окисления. Чтобы реакция протекала эффективно, спирт должен быть, по крайней мере, частично растворен в водном растворе. Этому может способствовать добавление органического сорастворителя, такого как диоксан, пиридин, ацетон или т-BuOH. KMnO4 будет легко реагировать с двойной связью углерод-углерод перед окислением первичного спирта.
Обычно это окисление проводят в сильных щелочных условиях, поскольку это способствует большей скорости и селективности окисления. На субстратах, чувствительных к сильному основанию, реакцию можно проводить при более низком pH - или даже в кислых условиях - за счет значительного снижения скорости реакции.

KMnO4 разлагается в воде, в результате чего образуется диоксид марганца (MnO2) и газообразный кислород. Это разложение катализируется кислотой, основанием и MnO.2. Поскольку степень этого разложения при окислении первичных спиртов трудно оценить, количество KMnO4 необходимо регулировать во время окисления, добавляя его последовательно, пока окисление не завершится.
Окисление Джонса
Так называемой Реактив Джонса готовится путем растворения триоксид хрома (CrO3) в водной серная кислота, в результате чего образуется красноватый раствор, содержащий хромовую кислоту (H2CrO4) и их олигомеры. Добавление реактива Джонса к раствору первичного спирта в ацетон (как впервые описал Джонс[4][5]) приводит к окислению спирта до карбоновой кислоты. Этот классический протокол, включающий прямое добавление, используется очень часто, несмотря на то, что часто приводит к образованию значительных количеств сложные эфиры (имеющий структуру R-CO-O-CH2-R), полученный в результате окислительной димеризации первичных спиртов. Холланд и Гилман[6] доказано, что эту побочную реакцию можно значительно подавить, следуя обратное сложение протокол, в соответствии с которым раствор первичного спирта в ацетоне медленно добавляется к реактиву Джонса в условиях, насколько возможно разбавленных.
Реагент Джонса взаимодействует со вторичными спиртами, что приводит к окислению до кетонов.[7] Обработка соединений, содержащих как первичные, так и вторичные спирты, реактивом Джонса приводит к образованию кетокислот.
Проблемы, возникающие при использовании больших количеств токсичного и опасного для окружающей среды триоксида хрома, послужили поводом для разработки Zhao [8] каталитической процедуры, включающей обработку с избытком периодная кислота (ЧАС5IO6) в присутствии около 1,2 мол.% CrO3. Процедура Чжао по использованию каталитического CrO3 очень хорошо подходит для крупномасштабных реакций.[9]

PDC в DMF (Кори и Шмидт)
Дихромат пиридиния (PDC) - ярко-оранжевое твердое тело с формулами (C5ЧАС5NH)2Cr2О7 который очень часто используется для окисления первичных и вторичных спиртов до альдегидов и кетонов соответственно. С другой стороны, в 1979 году Кори и Шмидт сообщили [11] эта реакция насыщенный первичные спирты с PDC, с использованием диметилформамида (Мне2NCHO, DMF) в качестве растворителя приводит к окислению до карбоновых кислот, а не до альдегидов. Аллиловые и бензильные первичные спирты не окисляются до карбоновых кислот. Процедура Кори и Шмидта для окисления насыщенных первичных спиртов до карбоновых кислот выполняется в практически нейтральных условиях.
Окисление Хейнса
При окислении кур окислитель представляет собой комбинацию кислорода и платина.
Четырехокись рутения
Четырехокись рутения широко используется в органической химии в качестве окислителя. Это агрессивный агент, допускающий мягкие условия реакции.
Двухступенчатое окисление спиртов до кислот через изолированные альдегиды
Поскольку многие из вышеупомянутых условий окисления первичных спиртов до кислот жесткие и несовместимы с обычными защитными группами, химики-органики часто используют двухэтапную процедуру окисления до кислот. Первичный спирт окисляется до альдегид используя одну из многих существующих процедур (например, IBX окисление, Десс – Мартин периодинан). Затем альдегид может быть подвергнут условиям Пинник окисление с помощью хлорит натрия.[12]Эта последовательность часто используется в синтезе природных продуктов, Nicolaou et al. применили его в синтезе Платенцина.[13]
Рекомендации
- ^ Фурнье, Х. (1907). "Transformation des alcools primaires saturès en acides monobasiques Соответствующие". Comptes Rendus Acad. Sci.: 331.
- ^ Фурнье, Х. (1909). Бык. Soc. Чим. Пт.: 920. Отсутствует или пусто
| название =(Помогите) - ^ Ciufolini, M.A .; Сваминатан, С. (1989). «Синтез модельного депсипептидного сегмента лузопептинов (BBM 928), мощных противоопухолевых и антиретровирусных антибиотиков». Tetrahedron Lett. 30 (23): 3027. Дои:10.1016 / S0040-4039 (00) 99393-6.
- ^ Heilbron, I .; Jones, E.R.H .; Сондхеймер, Ф. (1947). «315. Исследования ацетиленовых соединений. Часть XIV. Исследование реакций легкодоступного этинилэтиленового спирта пент-2-ен-4-ин-1-ола». J. Chem. Soc.: 1586. Дои:10.1039 / jr9470001586.
- ^ Heilbron, I .; Джонс, E.R.H. (1949). «129. Исследования по ацетиленовым соединениям. Часть XV. Окисление первичных ацетиленовых карбинолов и гликолей». J. Chem. Soc.: 604. Дои:10.1039 / jr9490000604.
- ^ Голландия, Британская Колумбия; Гилман, Н.В. (1974). «Улучшенная процедура окисления алкинолов до алкиновых кислот». Synth. Commun. 4 (4): 203. Дои:10.1080/00397917408062073.
- ^ Видеть Окисление спиртов до альдегидов и кетонов.
- ^ Чжао, М .; Li, J .; Песня, З .; Desmond, R .; Tschaen, D.M .; Grabowski, E.J.J .; Рейдер, П.Дж. (1998). «Новый триоксид хрома, катализируемый окислением первичных спиртов до карбоновых кислот». Tetrahedron Lett. 39 (30): 5323. Дои:10.1016 / S0040-4039 (98) 00987-3.
- ^ Песня, Z.J .; Чжао, М .; Desmond, R .; Devine, P .; Tschaen, D.M .; Tillyer, R .; Frey, L .; Heid, R .; Xu, F .; Фостер, Б .; Li, J .; Reamer, R .; Volante, R .; Grabowski, E.J.J .; Dolling, U.H .; Рейдер, П.Дж. (1999). «Практический асимметричный синтез антагониста рецептора эндотелина». J. Org. Chem. 64 (26): 9658. Дои:10.1021 / jo991292t.
- ^ Crimmins, M.T. И ДеБэйли, A.C. (2006). «Энантиоселективный тотальный синтез бистрамида А». Варенье. Chem. Soc. 128 (15): 4936–7. Дои:10.1021 / ja057686l. ЧВК 2546575. PMID 16608311.
- ^ Кори, E.J .; Шмидт, Г. (1979). «Полезные методы окисления спиртов с участием дихромата пиридиния в апротических средах». Tetrahedron Lett. 20 (52): 399. Дои:10.1016 / S0040-4039 (01) 93515-4.
- ^ Бал Б.С .; Childers, Jr. W.E .; Пинник Х.В. (1981). «Окисление α, β-ненасыщенных альдегидов». Тетраэдр (Абстрактные). 37 (11): 2091. Дои:10.1016 / S0040-4020 (01) 97963-3.
- ^ Николау К.К .; Scott Tria G .; Эдмондс Д. Дж. (2008). «Полный синтез платенцина». Энгью. Chem. 120 (9): 1804. Дои:10.1002 / ange.200800066.
дальнейшее чтение
- Маркос Фернандес; Габриэль Тохо (2006). Окисление первичных спиртов до карбоновых кислот: руководство по современной общепринятой практике (основные реакции в органическом синтезе). Берлин: Springer. ISBN 0-387-35431-X.