WikiDer > Перманганат
 | |
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК Перманганат | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| MnO− 4 | |
| Молярная масса | 118.934 г · моль−1 |
| Конъюгированная кислота | Пермангановая кислота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
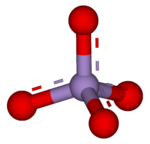
А перманганат это общее название для химическое соединение содержащий манганат (VII) ион, (MnO−
4). Поскольку марганец находится в +7 степень окисления, перманганат-ион (VII) является сильным окислитель. Ион имеет тетраэдрическая геометрия.[1] Растворы перманганатов имеют фиолетовый цвет и стабильны в нейтральный или немного щелочной средства массовой информации. Точная химическая реакция зависит от присутствующих органических загрязнителей и используемого окислителя. Например, трихлорэтан (C2ЧАС3Cl3) окисляется перманганат-ионами с образованием диоксида углерода (CO2), диоксид марганца (MnO2), ионы водорода (H+) и хлорид-ионы (Cl−).[2]
- 8MnO−
4 + 3C
2ЧАС
3Cl
3 → 6CO
2 + 8MnO
2 + ЧАС+
+ 4ЧАС
2О + 9Cl−
В кислый раствор перманганат (VII) восстанавливается до бледно-розовой степени окисления +2 марганец (II) (Mn2+) ион.
- 8 ЧАС+
+ MnO−
4 + 5 e− → Mn2+ + 4 часа2О
В сильно базовый раствор перманганат (VII) восстанавливается до зеленой +6 степени окисления манганат ион MnO2−
4.
- MnO−
4 + е− → MnO2−
4
Однако в нейтральной среде он восстанавливается до коричневой степени окисления +4. диоксид марганца MnO2.
- 2 ч2O + MnO−
4 + 3 е− → MnO2 + 4 ОН−
Производство
Перманганаты могут быть получены окислением марганец такие соединения, как хлорид марганца или же сульфат марганца сильными окислителями, например, гипохлорит натрия или же диоксид свинца:
- 2 MnCl2 + 5 NaClO + 6 NaOH → 2 NaMnO4 + 9 NaCl + 3 Н2О
- 2 MnSO4 + 5 PbO2 + 3 часа2ТАК4 → 2 HMnO4 + 5 PbSO4 + 2 часа2О
Также может производиться непропорциональность из манганаты, с диоксид марганца как побочный продукт:
- 3 Na2MnO4 + 2 часа2O → 2 NaMnO4 + MnO2 + 4 NaOH
Их производят в промышленных масштабах путем электролиза или окисления на воздухе щелочных растворов солей манганата (MnO2−
4).[3]
Характеристики

Перманганаты (VII) являются соли из марганцевая кислота. Они имеют темно-фиолетовый цвет из-за перенос заряда переход. Перманганат (VII) - сильный окислитель, и аналогично перхлорат. Поэтому его обычно используют в качественном анализе, который включает окислительно-восстановительные реакции (перманганометрия). Согласно теории, перманганат достаточно силен, чтобы окислять воду, но на самом деле этого не происходит ни в какой степени. Кроме того, он стабилен.
Это полезный реагент, хотя он не очень селективен к органическим соединениям. Перманганат калия используется как дезинфицирующее средство и добавка для очистки воды в аквакультуре[4].
Манганаты (VII) термически не очень стабильны. Например, перманганат калия разлагается при 230 ° C до манганат калия и диоксид марганца, выпуская кислород газ:
- 2 КМно4 → K2MnO4 + MnO2 + O2
Перманганат может окислять амин к нитросоединение,[5][6] ан алкоголь к кетон,[7] ан альдегид к карбоновая кислота,[8][9] терминал алкен к карбоновая кислота,[10] Щавелевая кислота к углекислый газ,[11] и алкен к диол.[12] Этот список не является исчерпывающим.
При окислении алкенов одним промежуточным продуктом является циклическая разновидность Mn (V).[нужна цитата]:
Соединения
- Перманганат аммония, NH4MnO4
- Перманганат кальция, Ca (MnO4)2
- Перманганат калия, КМно4
- Перманганат натрия, NaMnO4
- Перманганат серебра, AgMnO4
Смотрите также
- Перхлорат, аналогичный ион с центром хлора (VII)
- Хромат, который изоэлектронен перманганатом
- Пертехнетат
Рекомендации
- ^ Сукалян Даш, Сабита Патель и Биджай К. Мишра (2009). «Окисление перманганатом: синтетические и механистические аспекты». Тетраэдр. 65 (4): 707–739. Дои:10.1016 / j.tet.2008.10.038.
- ^ http://geocleanse.com/permanaganate.asp
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри; Карлос А. Мурильо; Манфред Бохманн (1999). Продвинутая неорганическая химия (6-е изд.). Нью-Йорк: John Wiley & Sons, Inc., стр. 770. ISBN 978-0471199571.
- ^ Зиндель. «Дезинфицирующее средство на основе перманганата калия и натрия».
- ^ А. Колдер, А. Р. Форрестер1 и С. П. Хепберн (1972). «2-метил-2-нитрозопропан и его димер». Органический синтез. 6: 803.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 52, п. 77
- ^ Натан Корнблюм и Уиллард Дж. Джонс (1963). «4-нитро-2,2,4-триметилпентан». Органический синтез. 5: 845.; Коллективный объем, 43, п. 87
- ^ Дж. У. Корнфорт (1951). «Этилпируват». Органический синтез. 4: 467.; Коллективный объем, 31, п. 59
- ^ Р. Л. Шрайнер и Э. К. Клейдерер (1930). «Пиперониловая кислота». Органический синтез. 2: 538.; Коллективный объем, 10, п. 82
- ^ Джон Р. Рухофф (1936). «н-гептановая кислота». Органический синтез. 2: 315.; Коллективный объем, 16, п. 39
- ^ Дональд Г. Ли, Шеннон Э. Лэмб и Виктор С. Чанг (1981). «Карбоновые кислоты от окисления концевых алкенов перманганатом: нонадекановая кислота». Органический синтез. 7: 397.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 60, п. 11
- ^ Ковач К.А., Гроф П., Бурай Л., Ридель М. (2004). «Пересмотр механизма реакции перманганат / оксалат». J. Phys. Chem. А. 108 (50): 11026. Bibcode:2004JPCA..10811026K. Дои:10.1021 / jp047061u.
- ^ E. J. Witzemann, Wm. Ллойд Эванс, Генри Хасс и Э. Ф. Шредер (1931). «этилацеталь dl-глицеральдегида». Органический синтез. 2: 307.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 11, п. 52

