WikiDer > Белок L
| Белок L b1 домен | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
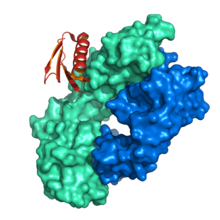 Структура связывания белка L с легкой цепью Fab мыши.[1] | |||||||||||
| Идентификаторы | |||||||||||
| Символ | PpL | ||||||||||
| Pfam | PF02246 | ||||||||||
| ИнтерПро | IPR003147 | ||||||||||
| SCOP2 | 1MHH / Объем / СУПФАМ | ||||||||||
| |||||||||||
Белок L был впервые выделен с поверхности бактерий Пептострептококк большой и было обнаружено, что он связывает иммуноглобулины через L цепь взаимодействие, из которого было предложено название.[2] Он состоит из 719 аминокислотных остатков.[3] Молекулярная масса протеина L, очищенного от клеточных стенок Peptostreptoccus magnus сначала была определена как 95 кДа с помощью SDS-PAGE в присутствии восстанавливающего агента 2-меркаптоэтанола, в то время как молекулярная масса была определена как 76 кДа с помощью гель-хроматографии в присутствии 6 М гуанидина HCl. Белок L не содержит никаких межцепочечных дисульфидных петель и не состоит из дисульфидно связанных субъединиц. Это кислая молекула с Пи 4.0.[4] в отличие Белок А и Белок G, которые связываются с Fc-областью иммуноглобулинов (антитела), Белок L связывает антитела через легкая цепь взаимодействия. Поскольку никакая часть тяжелой цепи не участвует во взаимодействии связывания, белок L связывает более широкий диапазон классов антител, чем белок A или G. Белок L связывается с представителями всех классов антител, включая IgG, IgM, IgA, IgE и IgD. Одноцепочечные вариабельные фрагменты (scFv) и Fab-фрагменты также связываются с протеином L.
Несмотря на этот широкий диапазон связывания, белок L не является универсальным связывающим антителом. белок. Связывание с белком L ограничено теми антителами, которые содержат легкие цепи каппа. У людей и мышей большинство молекул антител содержат легкие цепи каппа (κ), а остальные - легкие цепи лямбда (λ). Белок L эффективен только для связывания определенных подтипов легких цепей каппа. Например, он связывает подтипы VκI, VκIII и VκIV человека, но не связывает подтипы VκII. Связывание иммуноглобулинов мыши ограничено иммуноглобулинами, имеющими легкие цепи VκI.[5]
Учитывая эти специфические требования к эффективному связыванию, основным применением иммобилизованного протеина L является очистка моноклональные антитела от асцит или культура клеток супернатант которые, как известно, имеют каппа легкая цепь. Белок L чрезвычайно полезен для очистки моноклональных антител, содержащих VLκ, из супернатанта культуры, поскольку он не связывает бык иммуноглобулины, которые часто присутствуют в СМИ как сыворотка дополнение. Кроме того, белок L не мешает антигенсвязывающему сайту антитела, что делает его полезным для иммунопреципитация анализы, даже с использованием IgM.
Ген протеина L
Ген протеина L содержит пять компонентов: сигнальную последовательность из 18 аминокислот; NH2-концевой участок («A») из 79 остатков; пять гомологичных B-повторов из 72-76 аминокислот каждый; СООН-концевую область двух дополнительных «С» -повторов (52 аминокислоты каждая); гидрофильная, богатая пролином предполагаемая область, охватывающая клеточную стенку («W») после повторов C; якорь гидрофобной мембраны («М»). Было обнаружено, что B-повторы (36 кДа) ответственны за взаимодействие с легкими цепями Ig.[2]
Другие связывающие антитела белки
В дополнение к протеину L, другие иммуноглобулин-связывающие бактериальные белки, такие как Белок А, Белок G и Белок A / G все они обычно используются для очистки, иммобилизации или обнаружения иммуноглобулинов. Каждый из этих связывающих иммуноглобулин белков имеет различный профиль связывания антитела с точки зрения распознаваемой части антитела, а также вида и типа антител, которые он будет связывать.
использованная литература
- ^ Graille M, Harrison S, Crump MP, Findlow SC, Housden NG, Muller BH, Battail-Poirot N, Sibaï G, Sutton BJ, Taussig MJ, Jolivet-Reynaud C, Gore MG, Stura EA (декабрь 2002 г.). «Доказательства пластичности и структурной мимикрии на границе легкой цепи иммуноглобулина и белка L». J Biol Chem. 277 (49): 47500–6. Дои:10.1074 / jbc.M206105200. PMID 12221088.
- ^ Бьорк Л. (февраль 1988 г.). «Протеин L. Новый белок бактериальной клеточной стенки со сродством к цепям Ig L». J. Immunol. 140 (4): 1194–7. PMID 3125250.
- ^ Kastern W, Sjöbring U, Björck L (июнь 1992 г.). «Структура пептострептококкового белка L и идентификация повторяющегося домена связывания легкой цепи иммуноглобулина». J. Biol. Chem. 267 (18): 12820–5. PMID 1618782.
- ^ Акерстрём Б., Бьорк Л. (ноябрь 1989 г.). «Белок L: бактериальный белок, связывающий легкую цепь иммуноглобулина. Характеристика связывающих и физико-химических свойств». J. Biol. Chem. 264 (33): 19740–6. PMID 2479638.
- ^ Нильсон Б. Х., Лёгдберг Л., Кастерн В., Бьорк Л., Акерстрём Б. (август 1993 г.). «Очистка антител с использованием белковых L-связывающих каркасных структур в вариабельном домене легкой цепи». J. Immunol. Методы. 164 (1): 33–40. Дои:10.1016 / 0022-1759 (93) 90273-а. PMID 8360508.