WikiDer > Альфа-аминоадипатный путь - Википедия
В α-аминоадипатный путь это биохимический путь для синтеза аминокислота L-лизин. в эукариоты, этот путь уникален для высших грибы (содержащий хитин в их клеточных стенках) и эвглениды.[1] Также сообщалось о бактериях рода Thermus.[2]
Обзор пути
Гомоцитрат первоначально синтезируется из ацетил-КоА и 2-оксоглутарата путем гомоцитрат-синтаза. Затем это преобразуется в гомоаконитировать к гомоаконитаза а затем в гомоизоцитрат к гомоизоцитратдегидрогеназа. Атом азота добавляется из глутамата путем аминоадипат аминотрансфераза сформировать α-аминоадипат от чего этот путь получил свое название. Затем это уменьшается на аминоадипатредуктаза через промежуточное соединение ацил-фермента до полуальдегида. Реакция с глутамат одним классом сахаропиндегидрогеназа дает сахаропин, который затем расщепляется второй сахаропиндегидрогеназой с образованием лизина и оксоглутарата.[3]
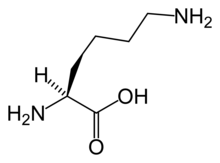
альфа-аминоадипиновая кислота
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2-аминогександиовая кислота | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| MeSH | 2-аминоадипиновая кислота + кислота |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C6ЧАС11НЕТ4 | |
| Молярная масса | 161,156 г / моль |
| Внешность | Кристаллический |
| Плотность | 1,333 г / мл |
| Температура плавления | 196 ° С (385 ° F, 469 К) |
| Точка кипения | 364 ° С (687 ° F, 637 К) |
| Опасности | |
| Главный опасности | Раздражающий |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
α-аминоадипиновая кислота является промежуточным звеном в Путь α-аминоадипиновой кислоты для метаболизма лизин и сахаропин. Он синтезируется из гомоизоцитрат к аминоадипат аминотрансфераза и уменьшен на аминоадипатредуктаза с образованием полуальдегида.
Исследование 2013 года определило α-аминоадипиновую кислоту (2-аминоадипиновая кислота) как новый предиктор развития диабета и предположил, что это потенциальный модулятор гомеостаза глюкозы у человека.[4]
Смотрите также
Рекомендации
- ^ Забриски TM, Джексон MD (2000). «Биосинтез и метаболизм лизина в грибах». Отчеты о натуральных продуктах. 17 (1): 85–97. Дои:10.1039 / a801345d. PMID 10714900.
- ^ Косуге Т., Хосино Т. (1999). «Α-аминоадипатный путь биосинтеза лизина широко распространен среди Thermus штаммы ". Журнал биологии и биоинженерии. 88 (6): 672–5. Дои:10.1016 / S1389-1723 (00) 87099-1. PMID 16232683.
- ^ Сюй Х, Анди Б., Цянь Дж., Западный А. Х., Кук П. Ф. (2006). «Путь α-аминоадипата для биосинтеза лизина в грибах». Биохимия клетки и биофизика. 46 (1): 43–64. Дои:10.1385 / CBB: 46: 1: 43. PMID 16943623. S2CID 22370361.
- ^ Ван Т.Дж., Нго Д., Психогиос Н., Деджам А., Ларсон М.Г., Васан Р.С., Горбани А., О'Салливан Дж., Ченг С., Ри Э.П., Синха С., МакКейб Е., Фокс С.С., О'Доннелл С.Дж., Хо Дж.Э., Флорес Дж.К., Магнуссон М., Пирс К.А., Соуза А.Л., Юй И, Картер С., Лайт П.Е., Меландер О, Клиш С.Б., Герштен Р.Э. (2013). «2-аминоадипиновая кислота является биомаркером риска диабета». J Clin Invest. 123 (10): 4309–4317. Дои:10.1172 / JCI64801. ЧВК 3784523. PMID 24091325.
| Этот биохимия статья - это заглушка. Вы можете помочь Википедии расширяя это. |