WikiDer > Анализ клеточного цикла
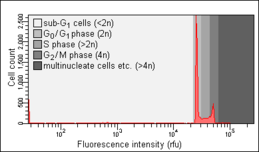
Анализ клеточного цикла путем измерения содержания ДНК это метод, который чаще всего использует проточной цитометрии различать клетки в разных фазах клеточный цикл. Перед анализом клетки обычно проницаемый и лечился флуоресцентный краситель это пятна ДНК количественно, например иодид пропидия (PI) или 4,6-диамидино-2-фенилиндол (DAPI). Интенсивность флуоресценции окрашенных клеток коррелирует с количеством содержащейся в них ДНК. Поскольку содержание ДНК удваивается во время Фаза S, содержание ДНК (и тем самым интенсивность флуоресценции) клеток в грамм0 фаза и грамм1 фаза (перед S), в фазе S и в грамм2 фаза и Фаза M (после S) указывает положение фазы клеточного цикла в основных фазах (G0/ГРАММ1 против S против G2/ M фаза) клеточного цикла. Содержание клеточной ДНК в отдельных клетках часто отображается в виде гистограммы их частот, чтобы предоставить информацию об относительной частоте (процентном соотношении) клеток в основных фазах клеточного цикла.
Аномалии клеточного цикла, выявляемые на гистограмме частот содержания ДНК, часто наблюдаются после различных типов повреждений клеток, например таких Повреждение ДНК который прерывает развитие клеточного цикла в определенных контрольно-пропускные пункты. Такая остановка развития клеточного цикла может привести либо к эффективной репарации ДНК, что может предотвратить превращение нормальной клетки в раковую (канцерогенез) или к гибели клеток, часто по способу апоптоз. Арест клеток в G0 или G1 часто наблюдается в результате недостатка питательных веществ (факторов роста), например, после сыворотка Анализ клеточного цикла был впервые описан в 1969 г. Лос-Аламосская научная лаборатория группой из Калифорнийский университет с использованием Окрашивание по Фельгену техника.[1] Первый протокол анализа клеточного цикла с использованием окрашивания йодидом пропидия был представлен в 1975 г. Аутар Кришан из Гарвардская медицинская школа и до сих пор широко цитируется.[2]
Многопараметрический анализ клеточного цикла включает, в дополнение к измерению содержания клеточной ДНК, другие составляющие / функции, связанные с клеточным циклом. Одновременное измерение клеточной ДНК и содержания РНК или чувствительности ДНК к денатурации при низком pH с использованием метахроматического красителя. акридиновый апельсин, показывает букву G1 квартал, ГРАММ1А, а G1B компартменты клеточного цикла, а также позволяет различать S, G2 и митотические клетки.[3] Клетки в G1 квартал находятся в состоянии покоя, временно выведены из клеточного цикла (также обозначаются как G0), G1А находятся в фазе роста, а G1B представляют собой клетки, непосредственно предшествующие входу в S, их рост (содержание РНК и белка, размер) подобен росту клеток, инициирующих репликацию ДНК. Подобные компартменты клеточного цикла также распознаются с помощью многопараметрического анализа, который включает измерение экспрессии циклин D1, циклин E, циклин А и циклин B1, каждый по отношению к содержанию ДНК [4] Одновременное измерение содержания ДНК и включения предшественника ДНК 5-бром-2'-дезоксиуридин (BrdU) методом проточной цитометрии - особенно полезный анализ, который широко используется при анализе клеточного цикла in vitro и in vivo.[5] Однако включение 5-этинил-2'-дезоксиуридин (EdU), предшественник, обнаружение которого дает определенные преимущества по сравнению с BrdU, теперь стал предпочтительной методологией для обнаружения реплицирующих ДНК (S-фаза) клеток.[6]
Экспериментальная процедура
Если окрашивание не производится с использованием Hoechst 33342, первым шагом в подготовке клеток к анализу клеточного цикла является повышение проницаемости клеток. плазматические мембраны. Обычно это делают, инкубируя их в буферный раствор содержащий мягкий моющее средство[7] Такие как Тритон Х-100 или же НП-40, или фиксация их в этиловый спирт. Большинство флуоресцентных красителей для ДНК (одно из исключений - Hoechst 33342) не проницаемы для плазматической мембраны, то есть не могут проходить через неповрежденную клеточную мембрану. Поэтому пермеабилизация имеет решающее значение для успеха следующего этапа - окрашивания клеток.
Перед (или во время стадии окрашивания) клетки часто обрабатывают РНКаза А удалять РНК. Это важно, потому что некоторые красители, окрашивающие ДНК, также окрашивают РНК, создавая тем самым артефакты это исказило бы результаты. Исключение составляет метахроматический флуорохром. акридиновый апельсин, которые в соответствии с конкретным протоколом окрашивания могут дифференцированно окрашивать как РНК (генерируя красную люминесценцию), так и ДНК (зеленую флуоресценцию), или в другом протоколе после удаления РНК и частичной денатурации ДНК для дифференциального окрашивания двухцепочечной ДНК (зеленая флуоресценция) по сравнению с одноцепочечной ДНК (красное свечение)[3]. Помимо йодида пропидия и акридинового оранжевого, количественно используемые красители включают (но не ограничиваются ими) DRAQ5, 7-аминоактиномицин D, DAPI и Hoechst 33342.
Двойная дискриминация
Поскольку клетки и особенно фиксированные клетки имеют тенденцию слипаться, клеточные агрегаты должны быть исключены из анализа с помощью процесса, называемого двойная дискриминация. Это важно, потому что дублет двух G0/ГРАММ1 клетки имеют такое же общее содержание ДНК и, следовательно, такую же интенсивность флуоресценции, как и один G2/ М ячейка.[8][9] Если не признано таковым, G0/ГРАММ1 дублеты способствовали бы ложный положительный результат идентификация и подсчет G2/ M клеток.
Связанные методы
Николетти пробирный
В Николетти пробирный, названный в честь его изобретателя, итальянского врача Ильдо Николетти, представляет собой модифицированную форму анализа клеточного цикла. Он используется для обнаружения и количественной оценки апоптоз, форма запрограммированная гибель клеток, путем анализа клеток с содержанием ДНК менее 2n («суб-G0/ГРАММ1 ячеек "). Такие ячейки обычно являются результатом апоптотическая фрагментация ДНК: во время апоптоза ДНК разрушается клеточными эндонуклеазы. Следовательно, ядра апоптотических клеток содержат меньше ДНК, чем ядра здоровых G0/ГРАММ1 ячеек, что приводит к суб-G0/ГРАММ1 пик флуоресценции гистограмма это может быть использовано для определения относительного количества апоптотических клеток в образце. Этот метод был разработан и впервые описан в 1991 году Николетти и его коллегами из Университет Перуджи Школа медицины.[10] Оптимизированный протокол, разработанный двумя авторами оригинальной публикации, был опубликован в 2006 году.[11] Объекты, измеренные в суб-G0/ГРАММ1 пик, с содержанием ДНК менее 5% от G0грамм1 пик, по всей вероятности, являются апоптотическими тельцами и, следовательно, не представляют собой отдельные апоптотические клетки [12]
- Анализ Николетти со здоровыми (слева) и апоптотическими (в центре и справа) клетками
Рекомендации
- ^ Ван Дилла М.А., Трухильо Т.Т., Маллани П.Ф., Колтер-младший (14 марта 1969 г.). «Микрофлуориметрия клеток: метод быстрого измерения флуоресценции». Наука. 163 (3872): 1213–1214. Bibcode:1969Sci ... 163.1213V. Дои:10.1126 / science.163.3872.1213. PMID 5812751.
- ^ Кришан А. (июль 1975 г.). «Быстрый проточный цитофлуориметрический анализ клеточного цикла млекопитающих путем окрашивания пропидиум йодидом». Журнал клеточной биологии. 66 (1): 188–193. Дои:10.1083 / jcb.66.1.188. ЧВК 2109516. PMID 49354.
- ^ Darzynkiewicz Z, Traganos F, Melamed MR (1980). «Новые компартменты клеточного цикла, идентифицированные многопараметрической проточной цитометрией». Цитометрия. 1 (2): 98–108. Дои:10.1002 / cyto.990010203. PMID 6170495.
- ^ Darzynkiewicz Z, Gong JP, Juan G, Ardelt B, Traganos F (1996). «Цитометрия циклиновых белков». Цитометрия. 25 (1): 1–13. Дои:10.1002 / (SICI) 1097-0320 (19960901) 25: 1 <1 :: AID-CYTO1> 3.0.CO; 2-N. PMID 8875049.
- ^ Грей JW, Dolbeare F, Pallavicini MG, Beisker W, Waldman F (1986). «Анализ клеточного цикла с использованием проточной цитометрии». Int J Radiat Biol Relat Stud Phys Chem Med. 49 (2): 237–55. Дои:10.1080/09553008514552531. PMID 3510993.
- ^ Бак С.Б., Брэдфорд Дж., Джи К.Р., Агнью Б.Дж., Кларк С.Т., Салик А. (2008). «Обнаружение прогрессирования клеточного цикла в S-фазе с использованием включения 5-этинил-2'-дезоксиуридина с помощью щелочной химии, альтернативы использованию антител к 5-бром-2'-дезоксиуридину». Биотехнологии. 44 (7): 927–9. Дои:10.2144/000112812. PMID 18533904.
- ^ Винделов Л.Л., Кристенсен И.Д., Ниссен Н.И. (март 1983 г.). «Детергентно-трипсиновый метод подготовки ядер для проточного цитометрического анализа ДНК». Цитометрия. 3 (5): 323–327. Дои:10.1002 / cyto.990030503. PMID 6188586.
- ^ Шарплесс Т., Траганос Ф., Дарзинкевич З., Меламед М.Р. (1975). «Проточная цитофлуориметрия: различение отдельных клеток и клеточных агрегатов путем прямого измерения размера». Акта Цитол. 19 (6): 577–81. PMID 1108568.
- ^ Версто Р.П., Крест Ф.Дж., Лири Дж.Ф., Моррис К., Стетлер-Стивенсон М.А., Габриэльсон Э. (15 октября 2001 г.). «Двойная дискриминация в анализе клеточного цикла ДНК». Цитометрия. 46 (5): 296–306. Дои:10.1002 / cyto.1171. PMID 11746105.
- ^ Николетти I, Миглиорати Дж., Пальячи М.С., Гриньяни Ф., Риккарди С. (3 июня 1991 г.). «Быстрый и простой метод измерения апоптоза тимоцитов с помощью окрашивания йодидом пропидия и проточной цитометрии». Журнал иммунологических методов. 139 (2): 271–279. Дои:10.1016 / 0022-1759 (91) 90198-О. PMID 1710634.
- ^ Риккарди С., Николетти И. (9 ноября 2006 г.). «Анализ апоптоза окрашиванием пропидиум йодидом и проточной цитометрией». Протоколы природы. 1 (3): 1458–1461. Дои:10.1038 / nprot.2006.238. PMID 17406435.
- ^ Darzynkiewicz Z, Bedner E, Traganos F (2001). «Трудности и подводные камни в анализе апоптоза». Методы Cell Biol. 63: 527–559. Дои:10.1016 / s0091-679x (01) 63028-0. PMID 11060857.
дальнейшее чтение
- «Основы клеточного цикла» (PDF). Университетский колледж Лондона. Архивировано из оригинал (PDF, 0,1 МБ) на 2011-06-06. Получено 2010-05-20.
- Рабинович, Петр. «Введение в анализ клеточного цикла» (PDF, 0,5 МБ). Phoenix Flow Systems, Inc. Получено 2010-05-20.