WikiDer > Хлоралкиловый эфир
Хлоралкиловые эфиры являются классом органические соединения с общей структурой R-O- (CH2)п-Cl, характеризуемый как эфир подключен к хлорметил группа через алкан цепь.
Хлорметилметиловый эфир (CMME) - это эфир с формулой CЧАС3ОCЧАС2Cl. Он используется как алкилирующий агент и промышленные растворитель для производства додецилбензилхлорид, водоотталкивающие средства, ионообменные смолы, полимеры, и как хлорметилирование реагент. Это известный человек канцероген.[1] В органический синтез соединение используется для введения метоксиметила (МОМ) защитная группа.
Близкородственные соединения промышленного значения: бис (хлорметил) эфир (BCME) (тесно связанный с химическим оружием серная горчица)[2] и бензилхлорметиловый эфир (BOMCl).
| Хлорметиловый эфир | р | Молярная масса | Количество CAS | Точка кипения ° C | |
| Бензил хлорметиловый эфир | Бензил | 156.61 | 3587-60-8 | 102 ° C при 14 мм рт. Ст. (1,9 кПа) | |
| Хлорметилметиловый эфир | Метил | 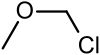 | 80.51 | 107-30-2 | 55-57 |
| Бис (хлорметиловый) эфир | 114.96 | 542-88-1 | 106 | ||
| трет-бутилхлорметиловый эфир | Бутил |  | 124.5 | ||
| Метоксиэтилхлорметиловый эфир | 124.57 | 3970-21-6 | 50-52 ° C при 13 мм рт. Ст. (1,7 кПа) | ||
| Дихлорметилметиловый эфир |  | 114.96 | 4885-02-3 | 82 - 85,5 ° С | |
| Типичные хлоралкиловые эфиры[3] | |||||
Защита от алкоголя
2-Метоксиэтоксиметильная группа (MEM) обычно используется в органическом синтезе в качестве защитной группы для спирты.
Наиболее распространенные методы защиты
- Лечение алкоголя основаниями, такими как гидрид натрия или же гидрид калия и 2-метоксиэтоксиметилхлорид в тетрагидрофуран (THF) при 0 ° C[4]
- Группа МЕМ также может быть установлена при температуре окружающей среды с помощью 2-метоксиэтоксиметилхлорида и мягкого основания, такого как N, N-диизопропилэтиламин (DIPEA) в дихлорметан[5]
Наиболее распространенные методы снятия защиты
2-метоксиэтоксиметилзащитная группа может быть отщеплена рядом кислот Льюиса, включая, но не ограничиваясь ими:
- TiCl4 или ZnBr2 в дихлорметан от 0 ° C до температуры окружающей среды
- Если выбранный растворитель представляет собой протонный растворитель, такой как метанол, муравьиная кислота может использоваться для расщепления группы МЕМ при повышенных температурах
_____________________________
Метоксиметил (МОМ) используется как защитная группа за спирты в органический синтез.
Наиболее распространенные методы защиты
- Лечение алкоголя с помощью N, N-диизопропилэтиламин (DIPEA) и метоксиметилхлорид (МАМА хлорид) в дихлорметан при 0 ° C[6]
- Для реакций, проводимых в более полярных растворителях, таких как тетрагидрофуран (ТГФ) или N, N-диметилформамид (ДМФ), защиту спирта можно проводить с помощью гидрида натрия при температуре от 0 ° C до температуры окружающей среды.
Наиболее распространенные методы снятия защиты
Группа MOM может быть отщеплена кислотой, обычно используемые условия для снятия защиты со спиртов MOM включают:[6]
- Концентрированный соляная кислота в метаноле или воде
- Трифторуксусная кислота (TFA) в дихлорметан
- Ацетилхлорид в метаноле при 0 ° C
Рекомендации
- ^ Бис (хлорметил) эфир и хлорметилметиловый эфир технической чистоты CAS №№ 542-88-1 и 107-30-2, Отчет о канцерогенных веществах, Одиннадцатое издание
- ^ Паспорт безопасности бис (хлорметил) эфира, Отдел охраны труда и техники безопасности, Национальные институты здравоохранения США
- ^ "Sigma-Aldrich: продукты и услуги в области аналитики, биологии, химии и материаловедения".
- ^ Кори, Э. Дж .; Гра, Жан-Луи; Ульрих, Питер (1976-03-01). «Новый общий метод защиты гидроксильной функции». Буквы Тетраэдра. 17 (11): 809–812. Дои:10.1016 / S0040-4039 (00) 92890-9.
- ^ Ли, Хон Мён; Ньето-Оберхубер, Кристина; Шаир, Мэтью Д. (17 декабря 2008 г.). «Энантиоселективный синтез (+) - кортистатина А, мощного и селективного ингибитора пролиферации эндотелиальных клеток». Журнал Американского химического общества. 130 (50): 16864–16866. Дои:10.1021 / ja8071918. ISSN 0002-7863. PMID 19053422.
- ^ а б Wuts, Питер Г. М .; Грин, Теодора В. (2006). Защитные группы Грина в органическом синтезе, четвертое издание - Wuts - онлайн-библиотека Wiley. Дои:10.1002/0470053488. ISBN 9780470053485.
- ^ Эндерс, Дитер; Гейбель, Гюнтер; Осборн, Саймон (2000-04-17). «Диастерео- и энантиоселективный тотальный синтез стигмателлина А». Химия - Европейский журнал. 6 (8): 1302–1309. Дои:10.1002 / (SICI) 1521-3765 (20000417) 6: 8 <1302 :: AID-CHEM1302> 3.0.CO; 2-J.
- ^ Амано, Сейджи; Такемура, Нориаки; Оцука, Масами; Огава, Сейитиро; Чида, Норитака (26 марта 1999 г.). «Полный синтез паникулида А из d-глюкозы». Тетраэдр. 55 (13): 3855–3870. Дои:10.1016 / S0040-4020 (99) 00096-4.