WikiDer > Муравьиной ангидрид
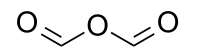 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Муравьиной ангидрид[1] | |
| Другие имена Метановый ангидрид Формилоксиметанон | |
| Идентификаторы | |
3D модель (JSmol) | |
| 1901016 | |
| ЧЭБИ | |
| ChemSpider | |
| 1041427 | |
PubChem CID | |
| |
| |
| Характеристики | |
| C2ЧАС2О3 | |
| Молярная масса | 74.035 г · моль−1 |
| Внешность | Бесцветный газ |
| Точка кипения | 24 ° C (75 ° F, 297 K) при 20 мм рт. |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Муравьиной ангидрид, также называемый метановый ангидрид, является органическое соединение с химическая формула C
2ЧАС
2О
3 и структурная формула из (H (C = O) -)2О. Его можно рассматривать как ангидрид из муравьиная кислота (HCOOH).
Подготовка
Муравьиной ангидрид может быть получен реакцией формилфторид с избытком формиат натрия и каталитическое количество муравьиной кислоты в эфире при -78 ° C.[2] Его также можно получить реакцией муравьиной кислоты с N,N ′-дициклогексилкарбодиимид ((C
6ЧАС
11−N =)2C) в эфире при -10 ° C.[3] Его также можно получить непропорциональность из ангидрид уксусной муравьиной кислоты.[4]
Характеристики
Муравьиной ангидрид - жидкость с температурой кипения 24 ° C при 20 ° C. мм рт. ст..[3] Устойчив в диэтиловый эфир решение. Его можно выделить путем низкотемпературной перегонки при низком давлении, но он разлагается при нагревании выше комнатной температуры.[3] При комнатной температуре и выше разлагается через реакция декарбонилирования в муравьиную кислоту и монооксид углерода.[5] Из-за своей нестабильности муравьиной ангидрид коммерчески недоступен, и его необходимо готовить свежим и незамедлительно использовать.
Разложение муравьиного ангидрида может катализироваться муравьиной кислотой.[3]
Муравьиной ангидрид можно обнаружить в газофазной реакции озон с этилен.[6] В газовой фазе молекула плоская.[3]
Смотрите также
Рекомендации
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 909. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Джордж А. Олах, Яшвант Д. Ванкар; Масуд Арванаги; Жан Соммер (1979), Муравьиной ангидрид. Angewandte Chemie International Edition Engl., Том 18, выпуск = 8, страница = 614. Дои:10.1002 / anie.197906141.
- ^ а б c d е Г. Ву, С. Шлыков, Ф. С. Ван Алсени, Х. Дж. Гейзе, Э. Слуйтс, Б. Дж. Ван дер Векен (1995), Муравьиновый ангидрид в газовой фазе, изученный методами электронной дифракции, микроволновой и инфракрасной спектроскопии, дополненный расчетами геометрии и силовых полей Ab-Initio. J. Phys. Chem., Том 99, выпуск 21, страницы 8589–8598 Дои:10.1021 / j100021a022
- ^ Р. Шейф, Дж. В. Шеерен, А. ван Эс, В. Стивенс (1965) Смешанные ангидриды карбоновых кислот: IV. муравьиной ангидрид. Recueil des Travaux Chimiques des Pays-Bas, том 84, выпуск 5, страницы 594–596. Дои:10.1002 / recl.19650840510
- ^ Boogaard, A .; Х. Дж. Гейзе; Ф. К. Мейлхофф (июль 1972 г.). «Электронографическое исследование молекулярной структуры муравьиного ангидрида». Журнал молекулярной структуры. Elsevier Science. 13 (1): 53–58. Дои:10.1016/0022-2860(72)87031-5.
- ^ A. Vaccani, A. Bauder и Hs. Х. Гюнтар (1975), Микроволновый спектр муравьиного ангидрида.. Тезисы докладов Международного симпозиума ОГУ по молекулярной спектроскопии 1970-1979 гг.