WikiDer > Преобразование гена
Преобразование гена это процесс, с помощью которого ДНК последовательность заменяет гомологичная последовательность так что последовательности становятся идентичными после события преобразования. Преобразование гена может быть либо аллельный, то есть тот аллель того же гена заменяет другой аллель, или эктопический, то есть тот паралогичная последовательность ДНК преобразует другое.
Конверсия аллельного гена
Конверсия аллельного гена происходит во время мейоз когда гомологичная рекомбинация между гетерозиготный сайтов приводит к несоответствию пары оснований. Это несоответствие затем распознается и корректируется клеточным механизмом, вызывая преобразование одного из аллелей в другой. Это может вызвать неменделирующий расщепление аллелей в половых клетках.[1]
Конверсия неаллельных / эктопических генов
Рекомбинация происходит не только во время мейоза, но также как механизм восстановления двухцепочечных разрывов (DSB), вызванных повреждением ДНК. Эти DSB обычно ремонтируют с помощью сестры. хроматида сломанного дуплекса, а не гомологичной хромосомы, поэтому они не приведут к аллельной конверсии. Рекомбинация также происходит между гомологичными последовательностями, присутствующими в разных геномных локусах (паралогичные последовательности), которые возникли в результате предыдущих дупликаций генов. Преобразование генов, происходящее между паралогическими последовательностями (эктопическая генная конверсия) предполагается ответственным за согласованная эволюция семейств генов.[1][2][3]
Механизм

Преобразование одного аллеля в другой часто происходит из-за исправления несоответствия оснований во время гомологичная рекомбинация: если одна из четырех хроматид во время мейоза соединяется с другой хроматидой, что может произойти из-за последовательности гомологияМожет происходить перенос цепи ДНК с последующей репарацией несоответствия. Это может изменить последовательность одной из хромосом, чтобы она стала идентичной другой.
Мейотическая рекомбинация инициируется путем образования двухцепочечного разрыва (DSB). Затем 5’-концы разрыва разрушаются, оставляя длинные 3 ’выступающие части из нескольких сотен нуклеотидов. Затем один из этих 3’-сегментов одноцепочечной ДНК вторгается в гомологичную последовательность на гомологичной хромосоме, образуя промежуточный продукт, который можно репарировать различными путями, что приводит либо к кроссоверам (CO), либо к непересекающимся (NCO). На различных этапах процесса рекомбинации образуется гетеродуплексная ДНК (двухцепочечная ДНК, состоящая из одиночных цепей каждой из двух гомологичных хромосом, которые могут быть или не быть полностью комплементарными). Когда в гетеродуплексной ДНК возникают несовпадения, последовательность одной цепи будет восстановлена, чтобы связать другую цепь с идеальной комплементарностью, что приведет к преобразованию одной последовательности в другую. Этот процесс восстановления может происходить по одному из двух альтернативных путей, как показано на рисунке. Одним путем структура, названная двойным Холлидей Джанкшн (DHJ), что приводит к обмену цепями ДНК. По другому пути, называемому отжигом, зависимым от синтеза (SDSA), происходит обмен информацией, но не физический. Конверсия гена будет происходить во время SDSA, если две молекулы ДНК гетерозиготны в месте рекомбинационной репарации. Преобразование гена также может происходить во время рекомбинационной репарации с участием DHJ, и это преобразование гена может быть связано с физической рекомбинацией дуплексов ДНК на двух сторонах DHJ.
Предвзятое и объективное преобразование генов
Предвзятое преобразование гена (BGC) происходит, когда один аллель имеет более высокую вероятность быть донором, чем другой в событии преобразования гена. Например, когда возникает несоответствие T: G, его более или менее вероятно исправят в пару C: G, чем в пару T: A. Это увеличивает вероятность передачи этого аллеля следующему поколению. Беспристрастная конверсия гена означает, что обе возможности возникают с равной вероятностью.
Конверсия генов с учетом GC
Конверсия генов с учетом GC (gBGC) - это процесс, при котором содержание GC в ДНК увеличивается из-за конверсии генов во время рекомбинации.[2] Доказательства наличия gBGC существуют для дрожжей и людей, а недавно теория была проверена на других эукариотических линиях.[4] Было обнаружено, что в проанализированных последовательностях ДНК человека скорость кроссовера положительно коррелирует с содержанием GC.[2] В псевдоавтосомные области (PAR) хромосом X и Y у людей, которые, как известно, имеют высокую скорость рекомбинации, также имеют высокое содержание GC.[1] Некоторые гены млекопитающих, претерпевающие согласованную эволюцию (например, рибосомные опероны, тРНК и гены гистонов), очень богаты GC.[1] Было показано, что содержание GC выше в паралогичных гистоновых генах человека и мыши, которые являются членами больших подсемейств (предположительно претерпевают согласованную эволюцию), чем в паралогичных гистоновых генах с относительно уникальными последовательностями.[5]Есть также доказательства смещения GC в процессе исправления несоответствия.[1] Считается, что это может быть адаптацией к высокой скорости дезаминирования метилцитозина, которая может приводить к переходам C → T.
BGC гена Fxy в Mus musculus
Ген Fxy или Mid1 у некоторых млекопитающих, тесно связанных с домашними мышами (люди, крысы и другие виды Mus), расположен в сцепленной с полом области Х-хромосомы. Однако в Mus musculus, он недавно транслоцировался таким образом, что 3 ’конец гена перекрывается с районом PAR X-хромосомы, который, как известно, является горячей точкой рекомбинации. Эта часть гена испытала резкое увеличение содержания GC и скорости замены в положении 3-го кодона, а также в интронах, но 5’-область гена, которая является X-связанной, этого не произошло. Поскольку этот эффект присутствует только в области гена, в которой наблюдается повышенная скорость рекомбинации, он должен быть вызван смещенной конверсией гена, а не давлением отбора.[2]
Влияние смещенной на GC конверсии генов на геномные структуры человека
Содержание GC широко варьируется в геноме человека (40–80%), но, по-видимому, есть большие участки генома, где содержание GC в среднем выше или ниже, чем в других регионах.[1] Эти области, хотя и не всегда имеют четкие границы, известны как изохоры. Одним из возможных объяснений присутствия GC-богатых изохор является то, что они эволюционировали из-за GC-смещенной конверсии генов в регионах с высокими уровнями рекомбинации.
Эволюционное значение
Адаптивная функция рекомбинации
Исследования конверсии генов способствовали нашему пониманию адаптивной функции мейотической рекомбинации. Обычный паттерн сегрегации пары аллелей (Aa) среди 4 продуктов мейоза - 2A: 2a. Обнаружение нечастых событий генной конверсии (например, моделей сегрегации 3: 1 или 1: 3 во время отдельных мейозов) дает представление об альтернативных путях рекомбинации, ведущих либо к кроссоверным, либо к некроссоверным хромосомам. Считается, что события конверсии генов возникают там, где аллели «А» и «а» оказываются близко к точному месту события молекулярной рекомбинации. Таким образом, можно измерить частоту, с которой события конверсии гена связаны с кроссовером или непересечением хромосомных областей, смежных с событием непосредственного преобразования, но вне его. Были проведены многочисленные исследования конверсии генов у различных грибов (которые особенно подходят для таких исследований), и результаты этих исследований были рассмотрены Уайтхаусом.[6] Из этого обзора ясно, что большинство событий конверсии генов не связаны с обменом внешних маркеров. Таким образом, большинство событий конверсии генов у нескольких изученных грибов связано с отсутствием кроссовера внешних маркеров. События конверсии генов без кроссовера в основном производятся с помощью отжига зависимых цепей от синтеза (SDSA).[7] Этот процесс включает ограниченный информационный обмен, но не физический обмен ДНК между двумя участвующими гомологичными хромосомами в месте события конверсии, и при этом возникает небольшая генетическая вариация. Таким образом, объяснения адаптивной функции мейотической рекомбинации, которые сосредотачиваются исключительно на адаптивном преимуществе создания новых генетических вариаций или физического обмена, кажутся неадекватными для объяснения большинства событий рекомбинации во время мейоза. Однако большинство событий мейотической рекомбинации можно объяснить предположением, что они являются адаптацией для восстановления повреждений ДНК, которые должны передаваться гаметам.[8]
Особый интерес с точки зрения того, что рекомбинация является адаптацией к репарации ДНК, представляют исследования на дрожжах, показывающие, что конверсия генов в митотических клетках увеличивается под действием УФ-излучения.[9][10] и ионизирующее излучение[11]
Генетические болезни человека
В обсуждениях генетические заболевания в людях, псевдоген опосредованные преобразования генов, которые вводят патогенные мутации в функциональные гены - это хорошо известный механизм мутации. Напротив, возможно, что псевдогены могут служить шаблонами. В ходе эволюции гены функционального источника, которые потенциально могут быть полезными, были получены из множества копий их единого исходного гена. Изменения, вызванные псевдогеном, могут в конечном итоге стать фиксированными, если они не будут оказывать вредного воздействия.[12] Таким образом, фактически, псевдогены могут действовать как источники вариантов последовательностей, которые могут быть перенесены на функциональные гены в новых комбинациях и на которые могут действовать отбор. Лектин 11 (SIGLEC11), человеческий иммуноглобулин, который связывается с сиаловой кислотой, можно рассматривать как пример такого события конверсии гена, которое сыграло значительную роль в эволюции. При сравнении гомологичных генов человек SIGLEC11 и его псевдоген в шимпанзе, бонобо, горилла и орангутанг, похоже, что произошла генная конверсия последовательности 5 ’вышележащих областей и экзонов, которые кодируют домен узнавания сиаловой кислоты, примерно в 2 т.п.н. от близко фланкирующего псевдогена hSIGLECP16 (Hayakawa et al., 2005). Три свидетельства этого события вместе предполагают, что это адаптивное изменение, которое очень важно с эволюционной точки зрения в род Гомо. Это включает в себя то, что это преобразование гена произошло только в человеческой линии, кора головного мозга приобрела важную экспрессию SIGLEC11, особенно в человеческой линии, и обнаружила изменение связывания субстрата в человеческой линии по сравнению с его аналогом у шимпанзе. Конечно, частота вклада этого псевдоген-опосредованного механизма конверсии генов в функциональные и адаптивные изменения в эволюции человека все еще неизвестна, и пока она практически не исследована. [13] Несмотря на это, введение положительно селективных генетических изменений по такому механизму может быть вынесено на рассмотрение на примере SIGLEC11. Иногда из-за вмешательства сменные элементы у некоторых членов семейства генов это вызывает вариацию среди них и, наконец, может также остановить скорость преобразования гена из-за отсутствия сходства последовательностей, что приводит к дивергентная эволюция.
Геномный анализ
На основании различных анализов генома был сделан вывод, что двухцепочечные разрывы (DSB) могут быть восстановлены с помощью гомологичная рекомбинация по крайней мере двумя разными, но связанными путями.[12] В случае основного пути будут использоваться гомологичные последовательности по обе стороны от DSB, что похоже на модель консервативной репарации DSB. [14] это было первоначально предложено для мейотической рекомбинации у дрожжей.[15] где второстепенный путь ограничен только одной стороной DSB, как постулируется неконсервативной моделью односторонней инвазии.[16] Однако в обоих случаях последовательность партнеров по рекомбинации будет абсолютно консервативной. Благодаря своей высокой степени гомологии, новые копии гена, которые возникли после дупликации гена, естественно имеют тенденцию к неравному кроссоверу или однонаправленным событиям конверсии гена. В последнем процессе существуют акцепторная и донорная последовательности, и акцепторная последовательность будет заменена последовательностью, скопированной с донора, в то время как последовательность донора остается неизменной.[13]
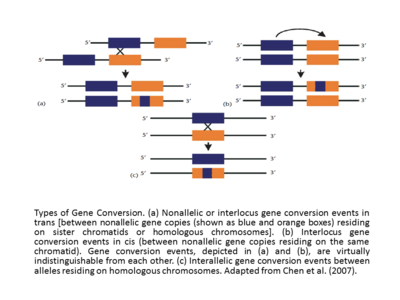
Эффективная гомология между взаимодействующими последовательностями делает событие конверсии гена успешным. Кроме того, частота преобразования гена обратно пропорциональна расстоянию между взаимодействующими последовательностями в цис [17],[12] и скорость преобразования гена обычно прямо пропорциональна длине непрерывного участка последовательности в предполагаемой преобразованной области. Похоже, что конверсионные тракты, сопровождающие кроссовер, длиннее (средняя длина = ∼460 п.н.), чем конверсионные тракты без кроссовера (средняя длина = 55–290 п.н.).[18] В исследованиях генов глобулинов человека давно подтверждено, что событие конверсии гена или события миграции ветвей могут либо стимулироваться, либо ингибироваться с помощью специфических мотивов, которые существуют вблизи последовательности ДНК (Papadakis and Patrinos, 1999).[12] Другая основная классификация событий конверсии генов - это интерлокусные (также называемые неаллельными) и межаллельные преобразования генов. События цис- или транс-неаллельной или интерлокусной конверсии гена происходят между копиями неаллельного гена, находящимися на сестринских хроматидах или гомологичных хромосомах, а в случае межараллельных событий конверсии гена происходят между аллелями, находящимися на гомологичных хромосомах (адаптировано из Chen et al., (2007).[13][12] Если сравнить события межлокусной конверсии гена, часто будет обнаружено, что они демонстрируют смещенную направленность. Иногда, например, в случае генов глобина человека (Пападакис и Патринос, 1999),[12] направление преобразования гена коррелирует с относительными уровнями экспрессии генов, которые участвуют в событии, при этом ген экспрессируется на более высоком уровне, называемом «главным» геном, преобразуя его с более низкой экспрессией, называемым «подчиненным» геном. Первоначально сформулированное в контексте эволюции правило «гена хозяина / подчиненного» следует объяснять с осторожностью. Фактически, увеличение транскрипции гена демонстрирует не только увеличение вероятности его использования в качестве донора, но также и в качестве акцептора.[12][19]
Эффект
Обычно организм, унаследовавший разные копии гена от каждого из своих родителей, называется гетерозиготным. Обычно это представлено как генотип: Aa (т.е. одна копия варианта (аллель) 'A' и одна копия аллеля 'a'). Когда гетерозигота создает гаметы путем мейозаллели обычно дублируются и в конечном итоге в соотношении 2: 2 образуются 4 клетки, которые являются прямыми продуктами мейоза. Однако при конверсии гена наблюдается соотношение, отличное от ожидаемого 2A: 2a, в котором A и a являются двумя аллелями. Примеры: 3A: 1a и 1A: 3a. Другими словами, может быть, например, в три раза больше аллелей A, чем аллелей, экспрессируемых в дочерних клетках, как в случае 3A: 1a.
Медицинское значение
Конверсия гена, приводящая к мутации CYP21A2 ген является распространенной основной генетической причиной врожденная гиперплазия надпочечников. Конверсия соматических генов - один из механизмов, который может привести к семейной ретинобластома, врожденный рак сетчатка, и предполагается, что конверсия генов может играть роль в развитии болезнь Хантингтона.
Рекомендации
- ^ а б c d е ж Галтье Н., Пигано Г., Муширу Д., Дюре Л. (октябрь 2001 г.). «Эволюция GC-содержания в геномах млекопитающих: гипотеза необъективной конверсии генов». Генетика. 159 (2): 907–11. ЧВК 1461818. PMID 11693127.
- ^ а б c d Дюре Л., Галтье Н. (2009). «Предвзятая конверсия генов и эволюция геномных ландшафтов млекопитающих». Анну Рев Геном Хум Генет. 10: 285–311. Дои:10.1146 / annurev-genom-082908-150001. PMID 19630562.
- ^ Харпак, Арбель; Лань, Сюнь; Гао, Цзыюэ; Причард, Джонатан К. (28 ноября 2017 г.). «Частая неаллельная генная конверсия в человеческом родословном и ее влияние на дивергенцию дубликатов генов». Труды Национальной академии наук. 114 (48): 12779–12784. Дои:10.1073 / pnas.1708151114. ISSN 0027-8424. ЧВК 5715747. PMID 29138319.
- ^ Пессия Е., Попа А., Муссе С., Резвой С., Дюре Л., Марэ Г.А. (2012). «Доказательства широко распространенной конверсии генов с ошибкой GC у эукариот». Геном Биол Эвол. 4 (7): 675–82. Дои:10.1093 / gbe / evs052. ЧВК 5635611. PMID 22628461.
- ^ Galtier N (февраль 2003 г.). «Преобразование генов движет эволюцией содержания GC в гистонах млекопитающих». Тенденции Genet. 19 (2): 65–8. Дои:10.1016 / s0168-9525 (02) 00002-1. PMID 12547511.
- ^ Белый дом, HLK (1982). Генетическая рекомбинация: понимание механизмов. Вайли. п. 321 и таблица 38. ISBN 978-0471102052.
- ^ МакМахилл М.С., Шам Ч.В., Епископ Д.К. (ноябрь 2007 г.). «Синтез-зависимый отжиг нитей в мейозе». PLoS Biol. 5 (11): e299. Дои:10.1371 / journal.pbio.0050299. ЧВК 2062477. PMID 17988174.
- ^ Бернштейн, Харрис; Бернштейн, Кэрол; Мичод, Ричард Э. (2011). «19. Мейоз как эволюционная адаптация к репарации ДНК». В Круман, Инна (ред.). Ремонт ДНК. 2011: InTech. Дои:10.5772/25117. ISBN 978-953-307-697-3.CS1 maint: location (связь)
- ^ Ито Т., Кобаяши К. (октябрь 1975 г.). «Исследования по индукции конверсии митотических генов ультрафиолетовым излучением. II. Спектры действия». Мутат. Res. 30 (1): 43–54. Дои:10.1016/0027-5107(75)90251-1. PMID 1101053.
- ^ Ханнан М.А., Калкинс Дж., Лассуэлл В.Л. (1980). «Рекомбинагенные и мутагенные эффекты солнечного света (УФ-В) в Saccharomyces cerevisiae". Мол. Генерал Жене. 177 (4): 577–80. Дои:10.1007 / bf00272666. PMID 6991864.
- ^ Раджу М.Р., Гнанапурани М., Стаклер Б. и др. (Сентябрь 1971 г.). «Индукция гетероаллельных реверсий и летальность в Saccharomyces cerevisiae при воздействии излучения различной ЛПЭ (лучи 60 Со, тяжелые ионы и - мезоны) в атмосфере воздуха и азота». Radiat. Res. 47 (3): 635–43. Дои:10.2307/3573356. JSTOR 3573356. PMID 5119583.
- ^ а б c d е ж грамм Чен, Джайн-Мин (2001). Конверсия генов в процессе эволюции и болезни. Вайли. ISBN 9780470015902.
- ^ а б c Чен, Цзянь-Минь; Купер, Дэвид Н .; Чужанова, Надя; Ферек, Клод; Патринос, Джордж П. (2007). «Конверсия генов: механизмы, эволюция и болезни человека». Природа Обзоры Генетика. 8 (10): 762–775. Дои:10.1038 / nrg2193. ISSN 1471-0056. PMID 17846636.
- ^ Шостак Дж. У., Орр-Уивер Т. Л., Ротштейн Р. Дж., Шталь Ф. В. (1983). «Модель репарации двухцепочечного разрыва для рекомбинации». Клетка. 33 (1): 25–35. Дои:10.1016/0092-8674(83)90331-8. PMID 6380756.
- ^ Ота Т., Ней М. (январь 1995 г.). «Эволюция псевдогенов иммуноглобулина VH у кур». Мол. Биол. Evol. 12 (1): 94–102. Дои:10.1093 / oxfordjournals.molbev.a040194. PMID 7877500.
- ^ Белмааза А., Чартран П. (май 1994 г.). «Односторонние события инвазии при гомологичной рекомбинации при двухцепочечных разрывах». Мутат. Res. 314 (3): 199–208. Дои:10.1016/0921-8777(94)90065-5. PMID 7513053.
- ^ Шильдкраут, Э. (2005). «Частота конверсии и делеции генов во время репарации двухцепочечных разрывов в человеческих клетках контролируется расстоянием между прямыми повторами». Исследования нуклеиновых кислот. 33 (5): 1574–1580. Дои:10.1093 / нар / gki295. ISSN 1362-4962. ЧВК 1065255. PMID 15767282.
- ^ Джеффрис AJ, май, Калифорния (февраль 2009 г.). «Интенсивная и сильно локализованная активность генной конверсии в горячих точках мейотического кроссовера человека». Природа Генетика. 36 (2): 151–156. Дои:10.1038 / ng1287. PMID 14704667.
- ^ Schildkraut, E .; Miller, C.A .; Николофф, Дж. А. (2006). «Транскрипция донора увеличивает его использование во время индуцированной двухцепочечным разрывом генной конверсии в клетках человека». Молекулярная и клеточная биология. 26 (8): 3098–3105. Дои:10.1128 / MCB.26.8.3098-3105.2006. ISSN 0270-7306. ЧВК 1446947. PMID 16581784.
внешняя ссылка
- Ген + преобразование в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- изображений: http://www.web-books.com/MoBio/Free/Ch8D4.htm и http://www.web-books.com/MoBio/Free/Ch8D2.htm