WikiDer > Лауролактам
 | |
| Имена | |
|---|---|
| Название ИЮПАК азациклотридекан-2-он | |
| Другие имена Додекалактам | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.012.204 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C12ЧАС23NО | |
| Молярная масса | 197.322 г · моль−1 |
| Внешность | бесцветное твердое вещество |
| Температура плавления | 152,5 ° С (306,5 ° F, 425,6 К)[1] |
| Точка кипения | 314,9 ± 10 ° С |
| 0,03 мас.% | |
| Опасности | |
| точка возгорания | 192 ° С (378 ° F, 465 К) |
| От 320 до 330 ° C (от 608 до 626 ° F; от 593 до 603 K) | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Лауролактам является органическое соединение из группы макроциклический лактамы. Лауролактам в основном используется в качестве мономера в инженерные пластмассы, Такие как нейлон-12 и сополиамиды.[2]
Синтез
Хотя производное 12-аминододекановая кислота, это сделано из циклододекатриен. Триен гидрируют до насыщенного алкана, циклододекан. Для производства лауролактама циклододекан окисляют воздухом или кислородом в присутствии борная кислота и соли переходных металлов (например, ацетат кобальта (II)), получая смесь[3] из циклододеканол и циклододеканон. Эта смесь количественно дегидрированный на медном контактном катализаторе до циклододеканон и это отреагировало гидроксиламин до оксима циклододеканона. В оксим превращается в лауролактам в Перестановка Бекмана в присутствии сильной кислоты.[4][5][6]
Альтернативный процесс - это фотонитрозирование циклододекана с нитрозилхлорид[3] в присутствии безводный хлористый водород.[7] Полученный оксим циклододеканона экстрагируют концентрированная серная кислота и переставил до лауролактама при нагревании до 160 ° C. Общий выход (фотонитрогенизация + перегруппировка Бекмана) до 93%.[2]
Характеристики
Лауролактам представляет собой нерастворимое в воде кристаллическое твердое вещество; в техническом качестве обычно бежевого цвета, а в чистом виде (чистота 99,9%) белого цвета. Он растворим во многих органических растворителях, например. грамм. 1,4-диоксан, бензол или же циклогексан. Процесс очистки обычно проводят многоступенчатой перегонкой при пониженном давлении.[2] Комбинация дистилляции и кристаллизации из раствора или расплава дает очень чистый лауролактам (> 99%).[8] Риск, связанный с лауролактамом, считается низким.[9]
Использует
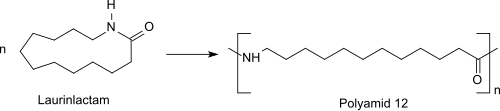
Полимеризация с раскрытием цикла используется для полимеризации мономера до нейлон-12. Реакцию можно проводить с катионными или анионными инициаторами или с водой. Полагают, что катионная полимеризация с кислотой включает начальное О-протонирование. Нуклеофильная атака мономером реактивного протонированного азота с последующим ацилированием первичного амина с раскрытием цикла приводит к образованию полиамида.[10] В полимеризация с раскрытием кольца мономера лауринлактама первоначально происходит при добавлении воды в процессе предварительной полимеризации при температуре около 300 ° C под давлением до форполимер. Этот форполимер вступает в реакцию с последующей поликонденсацией при окружающем или пониженном давлении и температуре около 250 ° C до более высокой молекулярной массы. полиамид 12 (PA 12: - [NH- (CH2)11-CO]п-).[11]
В качестве сомономера лауролактам используется вместе с ε-капролактам для приготовления сополиамида 6/12.[12]
Рекомендации
- ^ Брэдли, Жан-Клод; Уильямс, Энтони; Лэнг, Эндрю (2014): Жан-Клод Брэдли Открытый набор данных о точке плавления. фигшер.Дои:10.6084 / m9.figshare.1031637
- ^ а б c Т. Шиффер, Дж. Энбринк: Циклододеканол, циклододеканон и лауролактам. В: Энциклопедия промышленной химии Ульмана. Wiley-VCH, Weinheim 2002, Дои:10.1002 / 14356007.a08_201.
- ^ а б Х.-Ж. Арпе: Industrielle Organische Chemie. 6., vollst. überarb. Aufl., Wiley-VCH Verlag, Weinheim, 2007, ISBN 978-3-527-31540-6.
- ^ Дуглас Ф. Табер, Патрик Дж. Стрейни (декабрь 2010 г.), [PDF «Синтез лауролактама из циклододеканона посредством перегруппировки Бекмана»] Проверять
| url =ценить (помощь), Журнал химического образования (на немецком), 87 (12), с. 1392, г. Bibcode:2010JChEd..87.1392T, Дои:10.1021 / ed100599q - ^ Патент US8309714: Процесс производства лауролактама. Invent1: Дж. Кугимото и др., assign1: Ube Industries, Ltd., erteilt am 13 ноября 2012 г.
- ^ Ю. Фуруя и др .: Хлорид циануровой кислоты как мягкий и активный катализатор перегруппировки Бекмана. В: J.Am.Chem.Soc. 127, № 32, 2005, С. 11240–11241, Дои:10.1021 / ja053441x
- ^ США 6197999, J. Ollivier, D. Drutel, выдано 06.03.2001, назначено Атофине.
- ^ США 8399658, A. Hengstermann et al., «Метод выделения лауролактама из технологического потока синтеза лауролактама», опубликованный 19 марта 2013 г., передан Evonik Degussa GmbH.
- ^ «ОЭСР: Отчет о первоначальной оценке набора данных для отбора (SIDS)» (SIAR) » (PDF).
- ^ Стивенс, М. П. Химия полимеров: введение, Oxford University Press: Нью-Йорк, 1999.
- ^ США 5362448, A. Kawakami et al., "Метод непрерывной полимеризации лауролактама и устройство для него", выпущенный 2008-11-08, переуступлен Ube Industries, Ltd.
- ^ DE 3730504, E. De Jong et al., «Сополимиды, содержащие капролактам и лауролактам, способ их получения и их использование для термосваривания тканей», выпущенный 1989-03-16, переуступлен Atochem Werke GmbH