WikiDer > Полиаморфизм - Википедия

Полиаморфизм это способность вещества существовать в нескольких различных аморфный модификации. Это аналог полиморфизм из кристаллический материалы. Многие аморфные вещества могут существовать с различными аморфными характеристиками (например, полимеры). Однако полиаморфизм требует два разных аморфные состояния с четким разрывом (первого порядка) фаза перехода между ними. Когда такой переход происходит между двумя стабильными жидкими состояниями, полиаморфный переход также можно назвать фазовый переход жидкость – жидкость.[3]
Обзор
Хотя аморфные материалы не обнаруживают дальний периодического атомного упорядочения, все еще существует значительная и разнообразная локальная структура на межатомных масштабах длины (см. структура жидкостей и стекол). Различные локальные структуры могут образовывать аморфные фазы одного химического состава с разными физическими свойствами, такими как плотность. В нескольких случаях наблюдались резкие переходы между двумя аморфными состояниями разной плотности одного и того же материала. Аморфный лед один из важных примеров (см. также примеры ниже).[4] Ожидается, что некоторые из этих переходов (включая воду) завершатся через секунду. критическая точка.
Жидкость – жидкостные переходы
Полиаморфизм может применяться ко всем аморфным состояниям, то есть стеклам, другим аморфным твердым телам, переохлажденным жидкостям, обычным жидкостям или жидкостям. Однако переход жидкость – жидкость происходит только в жидком состоянии (красная линия на фазовой диаграмме, вверху справа). В этой статье переходы жидкость – жидкость определяются как переходы между двумя жидкостями одного и того же химического вещества. В другом месте термин «переход жидкость-жидкость» может также относиться к более распространенным переходам между жидкими смесями различного химического состава.
Стабильное жидкое состояние, в отличие от большинства стекол и аморфных твердых тел, является термодинамически устойчивым состоянием равновесия. Таким образом, новые переходы жидкость-жидкость или жидкость-жидкость в стабильных жидких (или жидких) состояниях анализировать легче, чем переходы в аморфных твердых телах, где аргументы осложняются неравновесной, неэргодической природой аморфного состояния.
Теория Рапопорта
Переход жидкость – жидкость был первоначально рассмотрен Рапопортом в 1967 г. для объяснения максимумов кривых плавления при высоком давлении некоторых жидких металлов.[5] Теория Рапопорта требует наличия максимума кривой плавления в полиаморфных системах.
Двойные потенциалы
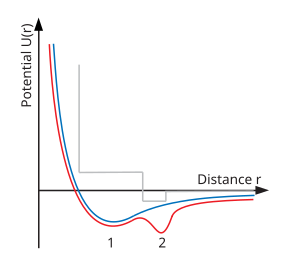
Одним из физических объяснений полиаморфизма является наличие двухъямного межатомного парного потенциала (см. Нижнюю правую диаграмму). Хорошо известно, что обычная критическая точка жидкость – газ возникает, когда межатомный парный потенциал содержит минимум. При более низких энергиях (температурах) частицы, захваченные этим минимумом, конденсируются в жидкое состояние. Однако при более высоких температурах эти частицы могут покинуть скважину, и четкое разделение между жидкостью и газом теряется. Молекулярное моделирование показал, что добавление второй скважины создает дополнительный переход между двумя разными жидкостями (или флюидами) со второй критической точкой.[2]
Примеры полиаморфизма
Полиаморфизм был экспериментально обнаружен или теоретически предложен в кремний, жидкость фосфор, трифенилфосфат, маннитол, и в некоторых других молекулярная сеть-образующие вещества.[6]
Вода и структурные аналоги
Самый известный случай полиаморфизма - это аморфный лед. Повышение давления в обычных гексагональных кристаллах льда примерно до 1,6 ГПа при жидкий азот температура (77 К) превращает их в аморфный лед высокой плотности. После сброса давления эта фаза стабильна и имеет плотность 1,17 г / см3.3 при 77 К и 1 бар. Последующее нагревание до 127 К при атмосферном давлении превращает эту фазу в аморфный лед низкой плотности (0,94 г / см3 при 1 баре).[7] Тем не менее, если аморфный лед высокой плотности нагреть до 165 К не при низких давлениях, а с сохранением сжатия 1,6 ГПа, а затем снова охладить до 77 К, то образуется еще один аморфный лед, который имеет еще более высокую плотность 1,25 г / см3 при 1 бар. Все эти аморфные формы имеют очень разные спектры колебательной решетки и межмолекулярные расстояния.[8][9] Подобный крутой жидкоаморфный фаза перехода предсказывается в жидком кремнии при охлаждении под высоким давлением.[10] Это наблюдение основано на первых принципах компьютерного моделирования молекулярной динамики, и его можно было бы интуитивно ожидать, поскольку известно, что тетраэдрический аморфный углерод, кремний и германий структурно аналогичен воде.[11]
Оксидные жидкости и стаканы
Иттрия-глинозем расплавы являются еще одной системой, демонстрирующей полиаморфизм. Сообщается о наблюдении фазового перехода жидкость – жидкость в переохлажденной жидкости.[12] Хотя это оспаривается в литературе.[13] О полиаморфизме также сообщалось в стеклах из иттрия-оксида алюминия. Плавы иттрия-оксида алюминия, закаленные от температуры примерно 1900 ° C со скоростью ~ 400 ° C / с, могут образовывать стекла, содержащие вторую сосуществующую фазу. Это происходит при определенных соотношениях Y / Al (около 20–40 мол.% Y2О3). Две фазы имеют одинаковый средний состав, но разную плотность, молекулярную структуру и твердость.[14] Однако также обсуждается, является ли вторая фаза стеклообразной или кристаллической.[15]При охлаждении наблюдались непрерывные изменения плотности. диоксид кремния или же диоксид германия. Хотя непрерывные изменения плотности не составляют переход первого рода, они могут указывать на лежащий в основе резкий переход.
Органические материалы
Полиаморфизм также наблюдался в органических соединениях, таких как жидкие трифенилфосфит при температурах от 210 К до 226 К [16][17][18][19] и п-бутанол при температурах от 120 К до 140 К.[20][21]
Полиаморфизм также является важным направлением фармацевтической науки. Аморфная форма лекарственного средства обычно имеет гораздо лучшую растворимость в воде (по сравнению с аналогичной кристаллической формой), но фактическая локальная структура в аморфном фармацевтическом препарате может отличаться в зависимости от метода, используемого для образования аморфной фазы. Маннит является первым фармацевтическим веществом. с полиаморфизмом.[22] Помимо обычной аморфной фазы, можно получить вторую аморфную фазу при комнатной температуре и давлении. Эта новая фаза имеет значительно более низкую энергию, более низкую плотность и более высокую температуру стеклования. Поскольку маннитол широко используется в фармацевтических препаратах для таблеток, полиаморфизм маннита предлагает мощный инструмент для разработки свойств и поведения таблеток. [23]
Смотрите также
Рекомендации
- ^ Mishima, O .; Мисима, Осаму (1998). «Взаимосвязь между жидкой, переохлажденной и стеклянной водой». Природа. 396 (6709): 329. Bibcode:1998Натура.396..329М. Дои:10.1038/24540. S2CID 4328846.
- ^ а б Franzese, G .; Malescio, G; Скибинский, А; Булдырев С.В.; и другие. (2001). «Общий механизм возникновения фазового перехода жидкость – жидкость». Природа. 409 (6821): 692–5. arXiv:cond-mat / 0102029. Bibcode:2001Натура.409..692F. Дои:10.1038/35055514. PMID 11217853. S2CID 4419993.
- ^ Хэнкок, Британская Колумбия; Шалаев, Э.Ю .; Шамблин, SL (2002). «Полиаморфизм: перспективы фармацевтической науки». Журнал фармации и фармакологии. 54 (8): 1151–2. Дои:10.1211/002235702320266343. PMID 12195833. S2CID 20047984.
- ^ Mishima, O .; Calvert, L.D .; Уолли, Э. (1985). «Очевидно, переход 1-го рода между двумя аморфными фазами льда, вызванный давлением». Природа. 314 (6006): 76. Bibcode:1985Натура.314 ... 76М. Дои:10.1038 / 314076a0. S2CID 4241205.
- ^ Рапопорт, Э. (1967). «Модель максимумов кривой плавления при высоком давлении». J. Chem. Phys. 46 (2891): 2891–2895. Bibcode:1967ЖЧФ..46.2891Р. Дои:10.1063/1.1841150.
- ^ «Аномальные свойства воды». Получено 30 августа 2015.
- ^ Schober, H; Коза, М .; Tölle, A .; Fujara, F .; и другие. (1997). «Аморфный полиморфизм во льду, исследуемый методом неупругого рассеяния нейтронов». Physica B: конденсированное вещество. 241–243: 897–902. Bibcode:1997PhyB..241..897S. Дои:10.1016 / S0921-4526 (97) 00749-7.
- ^ Лортинг, Томас; Зальцманн, Кристоф; Коль, Ингрид; Майер, Эрвин; и другие. (2001). «Второе отчетливое структурное« состояние »аморфного льда высокой плотности при 77 К и давлении 1 бар». Физическая химия Химическая физика. 3 (24): 5355. Bibcode:2001PCCP .... 3.5355L. Дои:10.1039 / b108676f. S2CID 59485355.
- ^ К. Дж. Рао (2002). Структурная химия стекол. Эльзевир. п. 120. ISBN 978-0-08-043958-7.
- ^ Моришита, Т. (2004). «Аморфная форма высокой плотности и полиаморфные превращения кремния». Phys. Rev. Lett. 93 (55503): 55503. Bibcode:2004ПхРвЛ..93э5503М. Дои:10.1103 / PhysRevLett.93.055503. PMID 15323706.
- ^ Benmore, C.J .; Hart, R .; Mei, Q .; Цена, Д .; и другие. (2004). «Промежуточное химическое упорядочение в аморфной и жидкой воде, Si и Ge». Phys. Ред. B. 72 (132201): 132201. Bibcode:2005ПхРвБ..72м2201Б. Дои:10.1103 / PhysRevB.72.132201.
- ^ Наголенники, G; Уайлдинг, MC; Fearn, S; Langstaff, D; Kargl, F; Кокс, S; Ван, QV; Majérus, O; и другие. (2008). «Обнаружение фазовых переходов жидкость / жидкость первого порядка в расплавах оксид иттрия-оксид алюминия» (PDF). Наука. 322 (5901): 566–70. Bibcode:2008Sci ... 322..566G. Дои:10.1126 / наука.1160766. PMID 18948535. S2CID 10368768.
- ^ Барнс, AC; Скиннер, LB; Лосось, PS; Бычков, А; и другие. (2009). «Переходы жидкость / жидкость в оксид иттрия-оксид алюминия» (PDF). Письма с физическими проверками. 103 (22): 225702. Bibcode:2009PhRvL.103v5702B. Дои:10.1103 / PhysRevLett.103.225702. PMID 20366109.
- ^ Aasland, S .; Макмиллан, П. Ф. (1994). «Плотностное разделение жидкость – жидкая фаза в системе AI2O3 – Y2O3». Природа. 369 (6482): 633. Bibcode:1994Натура.369..633A. Дои:10.1038 / 369633a0. S2CID 4325330.
- ^ Скиннер, LB; Барнс, AC; Лосось, PS; Крайтон, Вашингтон (2008). «Фазовое разделение, кристаллизация и полиаморфизм в системе Y2O3-Al2O3». J. Phys .: Condens. Иметь значение. 20 (20): 205103. Bibcode:2008JPCM ... 20t5103S. Дои:10.1088/0953-8984/20/20/205103. PMID 21694284.
- ^ Курита, Р. (2004-10-29). «Критические явления, связанные с переходом жидкость-жидкость в молекулярной жидкости». Наука. 306 (5697): 845–848. Bibcode:2004Наука ... 306..845K. Дои:10.1126 / science.1103073. ISSN 0036-8075. PMID 15514150. S2CID 29634533.
- ^ Ха, Алиса; Коэн, Итаи; Чжао, Сяолинь; Ли, Мишель; и другие. (1996). «Переохлажденные жидкости и полиаморфизм †». Журнал физической химии. 100: 1–4. Дои:10.1021 / jp9530820.
- ^ Пул, П. Х. (1997). «Полиморфные фазовые переходы в жидкостях и стеклах». Наука. 275 (5298): 322–323. Дои:10.1126 / science.275.5298.322. S2CID 95734427.
- ^ Паоло М. Осси (2006). Неупорядоченные материалы: введение. Springer. п. 65. ISBN 978-3-540-29609-6.
- ^ Курита, Рей; Танака, Хадзиме (13 июля 2005 г.). «О распространенности и общей природе фазового перехода жидкость – жидкость в молекулярных системах». Журнал физики: конденсированное вещество. 17 (27): L293 – L302. Дои:10.1088 / 0953-8984 / 17/27 / L01. ISSN 0953-8984.
- ^ Сайм, Кристофер Д .; Мхи, Джоанна; Гонсалес-Хименес, Марио; Шебанова, Ольга; Уолтон, Финли; Винн, Клаас (2017). «Срыв кристаллизации жидкокристаллической фазой». Научные отчеты. 7 (1): 42439. Bibcode:2017НатСР ... 742439S. Дои:10.1038 / srep42439. ISSN 2045-2322. ЧВК 5314399. PMID 28209972.
- ^ Чжу, Мэн; Ван, Цзюнь-Цян; Перепезко, Джон Х .; Ю, Лянь (2015). «Возможное существование двух аморфных фаз d-маннита, связанных переходом первого рода». Журнал химической физики. 142 (24): 244504. Bibcode:2015ЖЧФ.142x4504Z. Дои:10.1063/1.4922543. ISSN 0021-9606. PMID 26133438.
- ^ Чжу, Мэн; Ю, Лянь (2017). «Полиаморфизм D-маннита». Журнал химической физики. 146 (24): 244503. Bibcode:2017ЖЧФ.146x4503Z. Дои:10.1063/1.4989961. ISSN 0021-9606. PMID 28668061.