WikiDer > Трет-бутиллитий
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC терт-Бутиллитий[нужна цитата] | |
| Идентификаторы | |
3D модель (JSmol) | |
| 3587204 | |
| ChemSpider | |
| ECHA InfoCard | 100.008.939 |
| Номер ЕС |
|
PubChem CID | |
| Номер ООН | 3394 |
| |
| |
| Характеристики | |
| LiC 4ЧАС 9 | |
| Молярная масса | 64,055 г моль−1 |
| Внешность | Бесцветное твердое вещество |
| Плотность | 660 мг · см−3 |
| Точка кипения | От 36 до 40 ° C (от 97 до 104 ° F, от 309 до 313 K) |
| Реагирует | |
| Кислотность (пKа) | 45–53 |
| Опасности | |
| Пиктограммы GHS |      |
| Сигнальное слово GHS | Опасность |
| H225, H250, H260, H300, H304, H310, H314, H330, H336, H411 | |
| P210, P222, P223, P231 + 232, P370 + 378, P422 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | -6,6 ° С (20,1 ° F, 266,5 К) |
| Родственные соединения | |
Родственные соединения | п-Бутиллитий |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
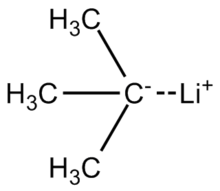
терт-Бутиллитий это химическое соединение с формула (CH3)3CLi. Как литийорганическое соединение, у него есть приложения в органический синтез так как это сильный основание, способный депротонировать многие углеродные кислоты, в том числе бензол. терт-Бутиллитий коммерчески доступен в виде углеводородных растворов; его обычно не готовят в лаборатории. О его синтезе впервые сообщил Р. Б. Вудворд в 1941 г.[1]
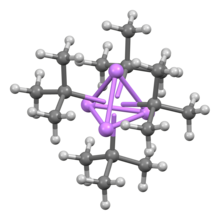
Структура и склеивание
Как и другие литийорганические соединения, терт-бутиллитий представляет собой кластер. В то время как п-бутиллитий существует как гексамер, так и тетрамер, терт-Бутиллитий существует в виде тетрамера с кубановая структура. Связывание в кластерах лития включает сигма-делокализацию и существенное связывание Li-Li.[2]
Связь литий – углерод в терт-бутиллитий сильно поляризован, имеет около 40 процентов ионный характер. Молекула реагирует как карбанион, как представлено этими двумя резонансные структуры.[3] (Учитывая расчеты полярности связи C – Li, «реальная» структура одиночной молекулы т-бутиллитий, вероятно, является почти средним из двух показанных резонансных вкладов, в которых центральный атом углерода имеет ~ 50% частичного отрицательного заряда, а атом лития имеет ~ 50% частичного положительного заряда.)
Химические свойства
Похожий на п-бутиллитий, терт-бутиллитий можно использовать для обмена лития на галогены и для депротонирования аминов и активированных соединений C-H.
Известно, что это соединение и другие алкиллитиевые соединения реагируют с эфирными растворителями; в период полураспада из терт-бутиллитий - 60 минут при 0 ° C в диэтиловый эфир, 40 минут при −20 ° C в тетрагидрофуран (THF),[4] и около 11 минут при -70 ° C в диметоксиэтан.[5]В этом примере реакция терт-бутиллитий с (THF) показан:
Чтобы свести к минимуму разложение этими растворителями, реакции с участием терт-бутиллитий часто проводят при очень низких температурах в специальных растворителях, таких как Растворитель ловушки смесь.
Безопасность
терт-бутиллитий - это пирофорный вещество, что означает, что оно легко воспламеняется на воздухе. (Точное определение пирофорного материала - это материал, который «самовоспламеняется [ы] на воздухе при температуре 54,55 ° C (130,19 ° F) или ниже»).[6]) Растворители, используемые в обычных коммерческих препаратах, сами по себе горючие. Хотя с этим составом можно работать, используя перенос канюли, следы от терт-бутиллитий на кончике иглы или канюли может загореться и забить канюлю солями лития. В то время как некоторые исследователи воспринимают этот эффект «пилотного света» как признак того, что продукт «свежий» и не испортился из-за времени или неправильного хранения / обращения, другие предпочитают заключать кончик иглы или канюлю в короткую стеклянную трубку, которая является промывают инертным газом и закрывают с каждого конца перегородками.[7] Серьезные лабораторные аварии с участием терт-бутиллитий. Например, в 2008 году штатный научный сотрудник, Шехарбано Сангджи, в лаборатории Патрик Харран[8] на Калифорнийский университет в Лос-Анджелесе, умер после сильных ожогов в результате пожара терт-бутиллитий.[9][10][11]
Крупномасштабные реакции могут привести к неконтролируемым реакциям, пожарам и взрывам, когда терт-бутиллитий смешивают с простыми эфирами, такими как диэтиловый эфир и тетрагидрофуран. Может быть предпочтительным использование углеводородных растворителей.
Безвоздушные методы важны для предотвращения бурной реакции этого соединения с кислородом и влагой в воздухе:
- т-BuLi + O2 → т-BuOOLi
- т-BuLi + H2O → т-BuH + LiOH
Рекомендации
- ^ Бартлетт, Пол Д .; К. Гарднер Суэйн; Роберт Б. Вудворд (1941). «т-бутиллитий». Варенье. Chem. Soc. 63 (11): 3229–3230. Дои:10.1021 / ja01856a501.
- ^ Эльшенбройх, К. «Металлоорганические соединения» (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Металлоорганические реагенты: источники нуклеофильного углерода для синтеза спирта. К. П. К. Фоллхардт, Н. Э. Шор: Органическая химия: структура и функции. 3-е издание, 1999 г., §8.7.
- ^ Stanetty, P; Koller, H .; Миховилович, М. (1992). «Направленное орто-литиирование 1,1-диметилэтилового эфира фенилкарбаминовой кислоты (N-BOC-анилин). Пересмотр и улучшения». Журнал органической химии. 57 (25): 6833–6837. Дои:10.1021 / jo00051a030.
- ^ Fitt, J. J .; Гшвенд, Х. Э. (1984). «Реакция н-, втор- и трет-бутиллития с диметоксиэтаном (ДМЭ): поправка». Журнал органической химии. 49: 209–210. Дои:10.1021 / jo00175a056.
- ^ ПОЛУ, стандарт F6-92, Руководство по вторичной изоляции систем трубопроводов для опасных газов, цитируется ChemiCool.com
- ^ Эррингтон, Р. М. (1997). Продвинутая практическая неорганическая и металлоорганическая химия (Google Книги выдержка). Лондон: Blackie Academic & Professional. С. 47–48. ISBN 978-0-7514-0225-4.
- ^ "Лаборатория Харрана: Калифорнийский университет в Лос-Анджелесе".
- ^ Джиллиан Кемсли (22 января 2009 г.). "Исследователь умер после пожара в лаборатории". Новости химии и машиностроения.
- ^ Джиллиан Кемсли (2009-04-03). «Уроки UCLA: подробности эксперимента, который привел к смерти исследователя, подсказка оценки методов академической безопасности». Новости химии и машиностроения.
- ^ Лос-Анджелес Таймс, 2009-03-01



