WikiDer > Реакция Цудзи-Троста
В Реакция Цудзи-Троста (также называемый Аллильное алкилирование троста или же аллильное алкилирование) это палладий-катализированный реакция замещения с использованием подложки, содержащей уходящая группа в аллильный позиция. Палладиевый катализатор сначала координируется с аллильной группой, а затем подвергается окислительная добавка, формируя π-аллильный комплекс. Этот аллильный комплекс может быть атакован нуклеофил, в результате чего получается замещенный продукт.[1]
Первыми в этой работе выступили Дзиро Цудзи в 1965 г.[2] и позже адаптирован Барри Трост в 1973 году с введением фосфин лиганды.[3] Объем этой реакции был расширен до множества различных нуклеофилов на основе углерода, азота и кислорода, множества различных уходящих групп, множества различных лигандов на основе фосфора, азота и серы, а также многих различных металлов (хотя палладий по-прежнему предпочтителен).[4] Введение фосфиновых лигандов привело к улучшенной реакционной способности и многочисленным стратегиям асимметричного аллильного алкилирования. Многие из этих стратегий основаны на появлении хиральный лиганды, которые часто могут обеспечить высокий энантиоселективность и высокий диастереоселективность в мягких условиях. Эта модификация значительно расширяет возможности этой реакции для множества различных синтетических приложений. Способность образовывать связи углерод-углерод, углерод-азот и углерод-кислород в этих условиях делает эту реакцию очень привлекательной для областей медицинской химии и синтеза природных продуктов.
История
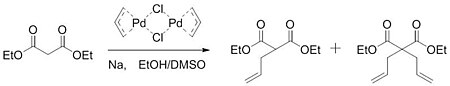
В 1962 году Шмидт опубликовал работу по катализируемому палладием окислению алкены к карбонил группы. В данной работе было установлено, что палладиевый катализатор активировал алкен для нуклеофильной атаки гидроксид.[5] Получив понимание из этой работы, Цуджи предположил, что аналогичная активация может иметь место с образованием углерод-углеродных связей. В 1965 году Цудзи сообщил о работе, которая подтвердила его гипотезу. Реакцией хлорида аллилпалладия димер с натриевой солью диэтилмалонат, группа смогла сформировать смесь моноалкилированный и диалкилированный товар.[6]
Объем реакции расширялся только постепенно, пока Трост не обнаружил следующий большой прорыв в 1973 году. Пытаясь синтезировать ациклические гомологи сесквитерпена, Трост столкнулся с проблемами с начальной процедурой и не смог алкилировать его субстраты. Эти проблемы были преодолены с добавлением трифенилфосфин к реакционной смеси.
Затем эти условия были проверены для других субстратов, и некоторые из них привели к «практически мгновенной реакции при комнатной температуре». Вскоре после этого он разработал способ использования этих лигандов для асимметричного синтеза.[7] Неудивительно, что это стимулировало многие другие исследования этой реакции и привело к важной роли, которую эта реакция теперь играет в синтетической химии.
Механизм
Начиная с нулевой валент палладия и субстрата, содержащего уходящую группу в аллильной позиции, реакция Цуджи-Троста протекает через каталитический цикл изложены ниже.
Во-первых, палладий координируется с алкеном, образуя η2 π-аллил-Pd0 Π сложный. Следующий шаг окислительная добавка в котором уходящая группа исключена с инверсия конфигурации и η3 π-аллил-PdII создается (также называется ионизацией). Затем нуклеофил присоединяется к аллильной группе, регенерируя η2 π-аллил-Pd0 комплекс. По завершении реакции палладий отделяется от алкена и может снова начать работу в каталитический цикл.[8]
«Жесткие» и «мягкие» нуклеофилы
Используемые нуклеофилы обычно образуются из предшественников (пронуклеофилов). на месте после их депротонирование с базой.[9] Эти нуклеофилы затем подразделяются на «жесткие» и «мягкие» нуклеофилы с использованием парадигмы описания нуклеофилов, которая в значительной степени опирается на pKas от их конъюгированные кислоты. «Жесткие» нуклеофилы обычно имеют конъюгированные кислоты с pKas более 25, тогда как «мягкие» нуклеофилы обычно имеют конъюгированные кислоты с pKas менее 25.[10] Этот дескриптор важен из-за влияния этих нуклеофилов на стереоселективность продукта. Стабилизированные или «мягкие» нуклеофилы инвертировать стереохимию из π-аллильный комплекс. Эта инверсия в сочетании с инверсией стереохимии, связанной с окислительным добавлением палладия, дает чистое сохранение стереохимии. С другой стороны, нестабилизированные или «твердые» нуклеофилы сохраняют стереохимию π-аллильный комплекс, приводящий к чистой инверсии стереохимии.[11]
Эта тенденция объясняется изучением механизмов нуклеофильной атаки. «Мягкие» нуклеофилы атакуют углерод аллильной группы, в то время как «твердые» нуклеофилы атакуют металлический центр с последующим восстановительным отщеплением.[12]
Фосфиновые лиганды
Фосфиновые лиганды, такие как трифенилфосфин или Лиганд Троста, были использованы для значительного расширения масштабов реакции Цуджи – Троста. Эти лиганды могут модулировать свойства палладиевого катализатора, такие как стерическая масса а также электронные свойства. Важно отметить, что эти лиганды также могут придавать хиральность конечному продукту, что делает возможным проведение этих реакций. асимметрично как показано ниже.
Асимметричное замещение аллила
Энантиоселективная версия реакции Цуджи-Троста называется асимметричным аллильным алкилированием Троста (Trost AAA) или просто асимметричным аллильным алкилированием (AAA). Эти реакции часто используются в асимметричном синтезе.[13][14][15] Первоначально реакция была разработана с использованием палладиевого катализатора, поддерживаемого Лиганд Троста, хотя подходящие условия с тех пор значительно расширились. Энантиоселективность может быть придана реакции во время любой из стадий, кроме декомплексирование палладия из алкена, так как стереоцентр уже установлен в этой точке. Были разработаны пять основных способов использования преимуществ этих стадий и получения условий энантиоселективной реакции. Эти методы энантиодискриминация были ранее рассмотрены Тростом:
- Предпочтительная ионизация посредством энантиоселективного образования олефиновых комплексов
- Энантиотопическая ионизация уходящих групп.
- Атака на энантиотопических концах аллильного комплекса
- Энантиофасовый обмен в π-Аллиловый комплекс
- Дифференциация граней прохиральных нуклеофилов
Предпочтительный метод энантиодискриминации в значительной степени зависит от интересующего субстрата, и в некоторых случаях на энантиоселективность могут влиять несколько из этих факторов.
Объем
Нуклеофилов
Сообщается, что для этой реакции эффективны многие различные нуклеофилы. Некоторые из наиболее распространенных нуклеофилов включают: малонаты, енолирует, первичные алкоксиды, карбоксилаты, феноксиды, амины, азиды, сульфаниламиды, имиды, и сульфоны.
Выход из группы
Объем уходящих групп также был расширен за счет включения ряда различных уходящих групп, хотя карбонаты, фенолы, фосфаты, галогениды и карбоксилаты являются наиболее широко используемыми.
«Жесткие» и «мягкие» нуклеофилы
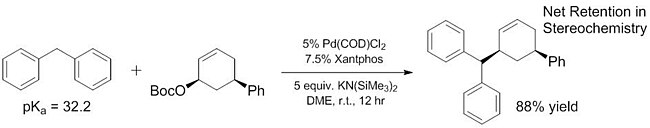
Недавняя работа продемонстрировала, что круг «мягких» нуклеофилов может быть расширен за счет включения некоторых пронуклеофилов, которые имеют гораздо более высокое значение pKas, чем ~ 25. Некоторые из этих «мягких» нуклеофилов имеют pKas в диапазоне вплоть до 32,[16] и даже более простые пронуклеофилы (~ 44), как было показано, действуют как мягкие нуклеофилы с добавлением Кислоты Льюиса которые помогают облегчить депротонирование.[17]Улучшенный диапазон pKa "мягких" нуклеофилов имеет решающее значение, потому что эти нуклеофилы - единственные, которые были исследованы.[18][19] для энантиоселективных реакций до недавнего времени[20] (хотя неэнантиоселективные реакции «твердых» нуклеофилов известны уже некоторое время[21]). Увеличивая количество пронуклеофилов, которые действуют как «мягкие» нуклеофилы, эти субстраты также могут быть включены в энантиоселективные реакции с использованием ранее описанных и хорошо изученных методов.
Лиганды
Основываясь на реакционной способности трифенилфосфинового лиганда, структура лигандов, используемых для реакции Цуджи-Троста, быстро стала более сложной. Сегодня эти лиганды могут содержать фосфор, серу, азот или некоторую комбинацию этих элементов, но большинство исследований сосредоточено на моно- и дифосфиновых лигандах. Эти лиганды могут быть дополнительно классифицированы в зависимости от природы их хиральности, при этом некоторые лиганды содержат центральную хиральность на атомах фосфора или углерода, некоторые содержат биарил. осевая хиральностьи другие, содержащие плоская хиральность. Дифосфиновые лиганды с центральной хиральностью возникли как эффективный тип лиганда (особенно для процедур асимметричного аллильного алкилирования), одним из таких примеров является лиганд Троста.[22]Фосфинооксазолины (PHOX) лиганды использовались в AAA, особенно с нуклеофилами на основе углерода.[23]
Дополнительные подложки
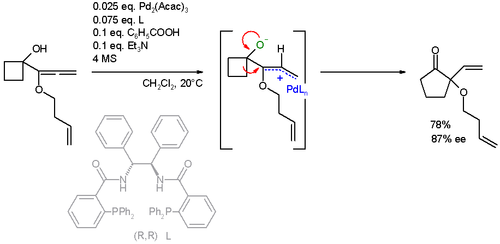
Субстрат реакции также был расширен до аллены. В этом конкретном расширение кольца реакция ААА также сопровождается Перегруппировка Вагнера-Меервейна:[24][25]
Приложения
Синтез фармацевтических / натуральных продуктов
Способность образовывать связи углерод-углерод, углерод-азот и углерод-кислород энантиоселективно в мягких условиях делает асимметричное аллильное алкилирование Троста чрезвычайно привлекательным для синтеза сложных молекул.
Примером этой реакции является синтез средний в сочетании полный синтез галантамина и морфий[26] с 1 мол.% [димер пи-аллилпалладия хлорида], 3 мол.% (SS) Лиганд Троста, и триэтиламин в дихлорметан в комнатная температура. Эти условия приводят к образованию (-) - энантиомера арилового эфира в 72% химический выход и 88% энантиомерный избыток.
Другая реакция Цуджи – Троста была использована на начальных этапах синтеза (-) - Неотиобинуфаридина. Эта недавняя работа демонстрирует способность этой реакции давать высоко диастереоселективные (10: 1) и энантиоселективные (97,5: 2,5) продукты из ахиральный исходный материал с небольшим количеством катализатора (1%).[27]
Обнаружение палладия
Помимо практического применения этой реакции в медицинской химии и синтезе природных продуктов, в недавних работах также использовалась реакция Цуджи-Троста для обнаружения палладия в различных системах. Эта система обнаружения основана на не-флуоресцентный флуоресцеин-производный датчик (датчики с большей длиной волны также недавно были разработаны для других приложений[28]), который становится флуоресцентным только в присутствии палладия или платины. Эта чувствительность к палладию / платине обусловлена реакцией Цуджи-Троста. Сенсор содержит аллильную группу, а флюоресцеин выступает в качестве уходящей группы. В πОбразуется комплекс -аллил, и после атаки нуклеофила высвобождается флуоресцеин, что приводит к резкому увеличению флуоресценции.[29][30]
Это просто, высокопроизводительный метод для обнаружения палладия путем мониторинга флуоресценции было показано, что он полезен при мониторинге уровней палладия в металлические руды,[31] фармацевтические продукты,[32] и даже в живые клетки.[33] С постоянно растущей популярностью палладиевый катализ, этот тип быстрого обнаружения должен быть очень полезен для снижения загрязнения фармацевтических продуктов и предотвращения загрязнения окружающей среды палладием и платиной.
внешняя ссылка
- Орг. Synth. 1989, 67, 105
- Орг. Synth. 2009, 86, 47
- пример реакции цудзи-троста в полном синтезе см .: http://www.biocis.u-psud.fr/IMG/pdf/concise_total_synthesis_of_Minfiensine.pdf Вторая реакция на сайте команды biocis: http://www.biocis.u-psud.fr/spip.php?article332
Рекомендации
- ^ Стратегические применения названных реакций в органическом синтезе (мягкая обложка) Ласло Курти, Барбара Чако ISBN 0-12-429785-4
- ^ Органический синтез с помощью соединений благородных металлов XVII. Реакция π-аллилпалладий хлорид с нуклеофилами Буквы Тетраэдра, Том 6, выпуск 49, 1965, страницы 4387-4388 Дзиро Цудзи, Хидетака Такахаши, Масанобу Морикава Дои:10.1016 / S0040-4039 (00) 71674-1
- ^ Трост, Б.М.; Фуллертон, Т. Дж. "Новые синтетические реакции. Аллильное алкилирование". Варенье. Chem. Soc. 1973, 95, 292–294. Дои:10.1021 / ja00782a080.
- ^ Риос, Итцель Герреро; Росас-Эрнандес, Алонсо; Мартин, Эрика; «Последние достижения в применении хиральных фосфиновых лигандов в Pd-катализируемом асимметричном аллильном алкилировании». Молекулы, 2011, 16 970–1010. Дои:10.3390 / молекулы16010970
- ^ Смидт, Дж., Хафнер, В., Джира, Р., Зибер, Р., Седлмайер, Дж. И Сабель, А. (1962), Олефиноксидирование с палладийхлорид-каталисатореном. Angewandte Chemie, 74: 93–102. Дои:10.1002 / ange.19620740302
- ^ Органический синтез с помощью соединений благородных металлов XVII. Реакция π-аллилпалладий хлорид с нуклеофилами Буквы Тетраэдра, Том 6, выпуск 49, 1965, страницы 4387–4388 Дзиро Цудзи, Хидетака Такахаши, Масанобу Морикава Дои:10.1016 / S0040-4039 (00) 71674-1
- ^ Асимметричные аллильные алкилирования, катализируемые переходными металлами Барри М. Трост Дэвид Л. Ван Вранкен Chem. Rev., 1996, 96 (1), pp 395–422 Дои:10.1021 / cr9409804
- ^ Трост, Барри М .; Чжан, Тин; Зибер, Джошуа Д.; «Каталитическое асимметричное аллильное алкилирование с использованием гетероатомных нуклеофилов: мощный метод образования связи C-X». Chem. Sci. 2010, 1, 427–440.
- ^ Стратегические применения названных реакций в органическом синтезе (мягкая обложка) Ласло Курти, Барбара Чако ISBN 0-12-429785-4
- ^ Trost, B.M .; Thaisrivongs, D. A. J. Am. Chem. Soc. 2008, 130, 14092
- ^ Лупария, Марко; Оливерира, Мария Тереза; Аудизио, Давиде; Фребо, Фредерик; Годдард, Ричард; Маулиде, Нуно; «Каталитическая асимметричная диастереодивергентная дерацемизация». Энгью. Chem. Int. Эд. 2011, 50, 12631–12635.
- ^ Б. М. Трост, Т. Р. Верховен, Дж. М. Фортунак, Tetrahedron Lett. 1979, 20, 2301 - 2304
- ^ Трост, Б.М.; Дитч, Т. Дж. "Новые синтетические реакции. Асимметричная индукция в аллильных алкилированиях". Варенье. Chem. Soc. 1973, 95, 8200–8201. Дои:10.1021 / ja00805a056.
- ^ Трост, Б.М.; Стреге, П. Е. "Асимметричная индукция в каталитическом аллильном алкилировании". Варенье. Chem. Soc. 1977, 99, 1649–1651. Дои:10.1021 / ja00447a064.
- ^ Асимметричные аллильные алкилирования, катализируемые переходными металлами: применение в полном синтезе Trost, B.M .; Кроули, М.Л. Chem. Ред.; (Рассмотрение); 2003; 103(8); 2921–2944. Дои:10.1021 / cr020027w
- ^ Ша, Шэн-Чун; Чжан, Джиади; Кэрролл, Патрик Дж .; Уолш, Патрик Дж .; «Повышение предела pKa« мягких »нуклеофилов в аллильных замещениях, катализируемых палладием: применение пронуклеофилов диарилметана». JACS. 2013, 135, 17602–17609. DOI: 10.1021 / ja409511n
- ^ Zhang, J .; Stanciu, C .; Ван, Б .; Hussain, M. M .; Da, C.-S .; Кэрролл, П. Дж .; Dreher, S.D .; Уолш, П. Дж. Катализируемое палладием аллильное замещение нуклеофилами на основе (η6-арена – CH2Z) Cr (CO) 3, J. Am. Chem. Soc. 2011, 133, 20552.
- ^ Trost, B.M .; Toste, F. D. J. Am. Chem. Soc. 1999, 121, 4545.
- ^ Trost, B.M .; Machacek, M. R .; Aponick, A. Acc. Chem. Res. 2006, 39, 747.
- ^ Ли, Сяо-Хуэй; Чжэн, Бао-Хуэй; Дин, Чанг-Хуа; Хоу, Сюэ-Лун; «Энантиоселективный синтез 2,3-дизамещенных инданонов посредством Pd-катализируемого внутримолекулярного асимметричного аллильного алкилирования кетонов». Орг. Lett. КАК МОЖНО СКОРЕЕ. DOI: 10.1021 / ol402980v
- ^ Castanet, Y .; Petit, F. Tetrahedron Lett. 1979, 20, 3221.
- ^ Лу, Чжан; Ма, Шэнмин; «Катализируемое металлами энантиоселективное аллилирование в асимметричном синтезе». Энгью. Chem. Int. Эд. 2008, 47, 258–297. DOI: 10.1002 / anie.200605113
- ^ Behenna, D. C .; Штольц, Б. М., Шэнмин; «Энантиоселективное аллилирование Цудзи». Варенье. Chem. Soc. 2004, 126, 15044–15045. DOI: 10.1021 / ja044812x
- ^ Трост, Б.М.; Се, Дж. "Катализированное палладием расширение асимметричного кольца алленилциклобутанолов: асимметричный сдвиг Вагнера-Меервейна". Варенье. Chem. Soc. 2006, 128, 6044–6045. Дои:10.1021 / ja0602501.
- ^ Сокатализаторы: бензойная кислота и триэтиламин. Молекулярные сита (МС) предотвращают гидролиз.
- ^ Трост, Б.М.; Tang, W .; Тост, Ф. Д. «Дивергентный энантиоселективный синтез (-) - галантамина и (-) - морфина». Варенье. Chem. Soc. 2005, 127, 14785–14803. Дои:10.1021 / ja054449 +.
- ^ Jansen, Daniel J .; Шенви, Райан А .; «Синтез (-) - Неотиобинуфаридина». JACS. 2013, 135, 1209–1212. DOI: 10.1021 / ja310778t
- ^ Ван, Чжифэй; Чжэн, Шуанг; Цай, Джин; Ван, Пэн; Фэн, Цзе; Ян, Ся; Чжан, Лиминг; Джи, Мин; Ву, Фуген; Он, Нонъюэ; Ван, Ненг; «Флуоресцентная система искусственного иммуноферментного анализа на основе Pd / C нанокатализатора и флуоресцентного хемодозиметра». Анальный. Chem. КАК МОЖНО СКОРЕЕ. DOI: 10.1021 / ac403001y
- ^ Гарнер, Аманда Л .; Коидэ, Кадзунори; «Исследования флуорогенного зонда для палладия и платины, ведущие к методу обнаружения палладия». Chem. Commun. 2009, 86–88. DOI: 10.1039 / b814197e
- ^ Песня, фэнлинг; Гарнер, Аманда Л .; Коидэ, Кадзунори; «Высокочувствительный флуоресцентный датчик палладия, основанный на механизме введения аллильного окислителя». JACS. 2007, 129, 12354–12355. DOI: 10.1021 / ja073910q
- ^ Уильямс, Джессика М .; Коидэ, Кадзунори; «Высокопроизводительный метод обнаружения палладия в рудах». Ind. Eng. Chem. Res. 2013, 52, 8612–8615. DOI: 10.1021 / ie400959z
- ^ Бу, Сяодун; Коидэ, Кадзунори; Кардер, Эван Дж .; Уэлч, Кристофер Дж .; «Быстрый анализ остаточного палладия в фармацевтических разработках с использованием флуорометрического метода на основе катализа». Орг. Процесс Res. Dev. 2013, 17, 108–113. DOI: 10.1021 / op3003008
- ^ Чжу, Баоцунь; Гао, Ченчен; Чжао, Юньчжоу; Лю, Цайюнь; Ли, Ямин; Вэй, Цинь; Ма, Чжэньминь; Ду, Бин; Чжан, Сяолин; «Рациометрический флуоресцентный хемодозиметр на основе 4-гидроксинафталимида для визуализации палладия в живых клетках». Chem. Commun. 2011, 47, 8656–8658. DOI: 10.1039 / c1cc13215f