WikiDer > Щелочность
Щелочность (от арабского "аль-кали"[1]) - способность воды противостоять подкислению.[2] Не следует путать с основность что является абсолютным измерением по шкале pH. Щелочность - сила буферный раствор состоит из слабые кислоты и их сопряженные основания. Это измеряется титрование то решение с кислотой, такой как HCl пока его pH не изменится резко или не достигнет известной конечной точки, где это произойдет. Щелочность выражается в единицах концентрации, таких как мэкв / л (миллиэквиваленты на литр), мкэкв / кг (микроэквиваленты на килограмм) или мг / л CaCO3 (миллиграммы на литр карбоната кальция).[3] Каждое из этих измерений соответствует количеству кислоты, добавленной в виде титрант.
Хотя щелочность - это в первую очередь термин, используемый океанологами,[3] он также используется гидрологами для описания временная твердость. Кроме того, измерение щелочности важно для определения способности потока нейтрализовать кислотное загрязнение от осадки или же Сточные Воды. Это один из лучших показателей чувствительности потока к поступлению кислоты.[4] Могут наблюдаться долгосрочные изменения щелочности ручьев и рек в ответ на антропогенные воздействия, такие как кислотные дожди, вызванные SOИкс и нетИкс выбросы.[5]
История
В 1884 г. профессор Вильгельм (Вильям) Диттмар колледжа Андерсона, ныне Стратклайдский университет, проанализировали 77 образцов чистой морской воды со всего мира, привезенных Челленджер экспедиция. Он обнаружил, что в морской воде основные ионы находятся в фиксированном соотношении, подтверждая гипотезу Йохан Георг Форххаммер, который теперь известен как принцип постоянных пропорций. Однако было одно исключение. Диттмар обнаружил, что концентрация кальция была немного выше в глубинах океана, и назвал это повышение щелочностью.
Также в 1884 г. Сванте Аррениус представил свои кандидатские диссертации, в которых отстаивал существование ионы в растворе, а кислоты определены как гидроксоний доноры ионов и основания как гидроксид доноры ионов. За эту работу он получил Нобелевская премия по химии в 1903 г.[требуется дальнейшее объяснение]
Упрощенное резюме
Щелочность примерно относится к молярному количеству оснований в растворе, которое может быть преобразовано в незаряженные частицы сильной кислотой. Например, 1 моль HCO31− в растворе представляет 1 молярный эквивалент, а 1 моль CO32− составляет 2 молярных эквивалента, поскольку в два раза больше H+ ионы были бы необходимы, чтобы сбалансировать заряд. Общий заряд раствора всегда равен нулю.[6] Это приводит к параллельному определению щелочности, основанному на балансе заряда ионов в растворе.
Определенные ионы, включая Na+, К+, Ca2+, Mg2+, Cl −, ТАК42−, и нет3− находятся "консервативный«таким образом, чтобы на них не влияли изменения температуры, давления или pH.[6] Другие, такие как HCO3− на них влияют изменения pH, температуры и давления. Выделяя консервативные ионы на одной стороне этого уравнения баланса зарядов, неконсервативные ионы, которые принимают / отдают протоны и, таким образом, определяют щелочность, группируются на другой стороне уравнения.
Этот комбинированный баланс заряда и баланс протонов называется общая щелочность.[7] Общая щелочность не (сильно) зависит от температуры, давления или pH и, таким образом, сама по себе является консервативным измерением, что увеличивает его применимость в водных системах. Все анионы, кроме HCO3− и CO32− имеют низкие концентрации в поверхностных водах Земли. Таким образом карбонатная щелочность, что равно мHCO3− + 2мCO32− также примерно равна общей щелочности.[6]
Подробное описание
Щелочность или же АТ измеряет способность раствора нейтрализовать кислоты к Точка эквивалентности карбоната или бикарбоната, определяемый как pH 4,5 для океанографических / лимнологических исследований.[8] Щелочность равна стехиометрический сумма базы в растворе. В естественной среде карбонатная щелочность имеет тенденцию составлять большую часть общей щелочности из-за частого появления и растворения карбонат скалы и наличие углекислый газ в атмосфере. Другие распространенные природные компоненты, которые могут способствовать щелочности, включают: борат, гидроксид, фосфат, силикат, растворенный аммиак, то сопряженные основания некоторых органические кислоты (например., ацетат), и сульфат. Растворы, произведенные в лаборатории, могут содержать практически неограниченное количество оснований, способствующих щелочности. Щелочность обычно указывается в единицах миллиэкв / л (миллиэквивалент на литр). В коммерческих целях, как и в производстве бассейнов, щелочность также может быть выражена в миллионных долях эквивалента карбоната кальция (ppm CaCO3).
Щелочность иногда неправильно используется как синоним основность. Например, добавление CO2 снижает pH раствора. Это увеличение снижает основность; однако щелочность остается неизменной (см. пример ниже). Для определения общей щелочности 0,1 N H2ТАК4 используется гидрологами вместе с фенолфталеин индикатор pH.
Теоретическое лечение
В типичном грунтовые воды или же морская вода, измеренная щелочность устанавливается равной:
- АТ = [HCO3−]Т + 2 [CO32−]Т + [В (ОН)4−]Т + [ОН−]Т + 2 [PO43−]Т + [HPO42−]Т + [SiO (OH)3−]Т - [H+]sws - [HSO4−]
(Нижний индекс T указывает общую концентрацию компонентов в растворе, измеренную. Это противоположно свободной концентрации, которая учитывает значительное количество ионная пара взаимодействия, которые происходят в морской воде.)
Щелочность можно измерить путем титрования образца сильной кислотой до тех пор, пока не будет израсходована вся буферная способность вышеупомянутых ионов выше pH бикарбоната или карбоната. Эта точка функционально установлена на pH 4,5. На данный момент все представляющие интерес основания протонированы до разновидностей нулевого уровня, следовательно, они больше не вызывают щелочности. В карбонатной системе ионы бикарбоната [HCO3−] и карбонат-ионы [CO32−] превратились в угольную кислоту [H2CO3] при этом pH. Этот pH также называют CO.2 точка эквивалентности, когда основной компонент в воде растворен CO2 который преобразуется в H2CO3 в водном растворе. На данный момент нет сильных кислот или оснований. Таким образом, щелочность моделируется и количественно оценивается по отношению к CO.2 Точка эквивалентности. Поскольку щелочность измеряется по отношению к CO2 точка эквивалентности, растворение CO2, хотя и добавляет кислоту и растворенный неорганический углерод, не изменяет щелочность. В естественных условиях растворение основных пород и добавление аммиака [NH3] или органических аминов приводит к добавлению основания в природные воды на CO2 Точка эквивалентности. Растворенное в воде основание увеличивает pH и титрует эквивалентное количество CO.2 до бикарбонат-иона и карбонат-иона. В состоянии равновесия вода имеет определенную щелочность, обусловленную концентрацией анионов слабых кислот. И наоборот, добавление кислоты превращает анионы слабой кислоты в CO.2 а постоянное добавление сильных кислот может привести к тому, что щелочность станет меньше нуля.[9] Например, при добавлении кислоты в обычный раствор морской воды протекают следующие реакции:
- В (ОН)4− + H+ → В (ОН)3 + H2O
- ОЙ− + H+ → H2O
- PO4−3 + 2H+ → H2PO4−
- HPO4−2 + H+ → H2PO4−
- [SiO (OH)3−] + H+ → [Si (OH)40]
Из приведенных выше реакций протонирования видно, что большинство оснований потребляют один протон (H+), чтобы стать нейтральным видом, таким образом увеличивая щелочность на один эквивалент. CO3−2 однако будет потреблять два протона, прежде чем превратиться в частицы с нулевым уровнем (CO2), таким образом, он увеличивает щелочность на два на моль CO3−2. [ЧАС+] и [HSO4−] уменьшают щелочность, так как действуют как источники протонов. Их часто вместе представляют как [H+]Т.
Щелочность обычно указывается в мг / л. в качестве CaCO3. (Соединение «as» уместно в этом случае, потому что щелочность возникает из-за смеси ионов, но сообщается «как будто» все это связано с CaCO3.) Это можно преобразовать в миллиэквиваленты на литр (мг-экв / л), разделив на 50 (приблизительное МВт CaCO3/2).
Примеры проблем
Сумма способствующих видов
Следующие уравнения демонстрируют относительный вклад каждого компонента в щелочность типичного образца морской воды. Вклады в мкмоль.кг − солн−1 и получены из Справочник по методам анализа параметров углекислого газа в морской воде "[1], "(Соленость = 35 г / кг, pH = 8,1, температура = 25 ° C).
- АТ = [HCO3−]Т + 2 [CO32−]Т + [В (ОН)4−]Т + [ОН−]Т + 2 [PO43−]Т + [HPO42−]Т + [SiO (OH)3−]Т - [H+] - [HSO4−] - [HF]
Фосфаты и силикаты, являясь питательными веществами, обычно незначительны. При pH = 8,1 [HSO4−] и [HF] также незначительны. Так,
АТ = [HCO3−]Т + 2 [CO32−]Т + [В (ОН)4−]Т + [ОН−]Т - [H+] = 1830 + 2 × 270 + 100 + 10 − 0.01 = 2480 μмоль.кг − солн−1
Добавление CO2
Добавление (или удаление) CO2 к раствору не изменяет его щелочность, так как чистая реакция дает такое же количество эквивалентов положительно вносящих вклад частиц (H+) как виды, вносящие отрицательный вклад (HCO3− и / или CO32−). Добавление CO2 к раствору снижает его pH, но не влияет на щелочность.
При всех значениях pH:
- CO2 + H2O ⇌ HCO3− + H+
Только при высоких (основных) значениях pH:
- HCO3− + H+ ⇌ CO32− + 2H+
Растворение карбонатной породы
Добавление CO2 раствор, находящийся в контакте с твердым веществом, может (со временем) влиять на щелочность, особенно для карбонатных минералов, контактирующих с грунтовыми или морской водой. Растворение (или осаждение) карбонатной породы сильно влияет на щелочность. Это потому, что карбонатная порода состоит из CaCO.3 и его диссоциация добавит Ca+2 и CO3−2 в раствор. Ca+2 не влияет на щелочность, но CO3−2 повысит щелочность на 2 единицы. Повышенное растворение карбонатных пород в результате подкисления из-за кислотных дождей и добычи полезных ископаемых способствовало повышению концентрации щелочности в некоторых крупных реках на востоке США.[5] Следующая реакция показывает, как кислотный дождь, содержащий серную кислоту, может иметь эффект увеличения щелочности реки за счет увеличения количества бикарбонат-иона:
- 2CaCO3 + H2ТАК4 → 2Ca+2 + 2HCO3− + ТАК4−2
Другой способ написать это:
- CaCO3 + H+ ⇌ Ca+2 + HCO3−
Чем ниже pH, тем выше будет концентрация бикарбоната. Это показывает, как более низкий pH может привести к более высокой щелочности, если количество произведенного бикарбоната больше, чем количество H+ остающийся после реакции. Это так, поскольку количество кислоты в дождевой воде невелико. Если эти щелочные грунтовые воды позже вступят в контакт с атмосферой, они могут потерять CO.2, осаждают карбонат и, таким образом, снова становятся менее щелочными. Когда карбонатные минералы, вода и атмосфера находятся в равновесии, обратимая реакция
- CaCO3 + 2H+ ⇌ Ca+2 + CO2 + H2O
показывает, что pH будет связан с концентрацией ионов кальция, причем более низкий pH соответствует более высокой концентрации ионов кальция. В этом случае, чем выше pH, тем больше будет бикарбоната и карбонат-иона, в отличие от парадоксальной ситуации, описанной выше, когда человек не находится в равновесии с атмосферой.
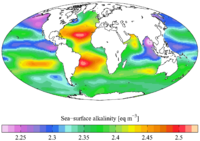
Щелочность океана
Процессы, повышающие щелочность
Есть много методов создания щелочности в океане. Возможно, наиболее известным является растворение CaCO3 (карбонат кальция, входящий в состав коралловых рифов) с образованием Ca2+ и CO32− (карбонат). Карбонат-ион может поглотить два иона водорода. Следовательно, это вызывает чистое увеличение щелочности океана. Растворение карбоната кальция является косвенным результатом понижения pH океана. Это может нанести большой ущерб коралловый риф экосистем, но имеет относительно низкое влияние на общую щелочность (AТ) В океане.[10] Снижение pH за счет абсорбции CO2 фактически повышает щелочность, вызывая растворение карбонатов.
Процессы анаэробной деградации, такие как денитрификация и восстановление сульфатов, оказывают гораздо большее влияние на щелочность океана. Денитрификация и сульфатредукция происходят в глубинах океана, где отсутствует кислород. Оба эти процесса потребляют ионы водорода и выделяют квазиинертные газы (N2 или H2S), которые со временем уходят в атмосферу. Это потребление H+ увеличивает щелочность. Было подсчитано, что анаэробная деградация может составлять до 60% от общей щелочности океана.[10]
Процессы, снижающие щелочность
Анаэробные процессы обычно повышают щелочность. И наоборот, аэробное разложение может снизить AТ. Этот процесс происходит в тех частях океана, где присутствует кислород (поверхностные воды). Это приводит к растворению органических веществ и образованию ионов водорода.[10] Увеличение H+ явно снижает щелочность. Однако растворенное органическое вещество может иметь основные функциональные группы, которые могут поглощать эти ионы водорода и сводить на нет их влияние на щелочность. Следовательно, аэробная деградация оказывает относительно небольшое влияние на общую щелочность океана.[11]
Все эти вышеупомянутые методы являются химическими процессами. Однако физические процессы также могут влиять на AТ. Растущее беспокойство вызывает таяние полярных ледяных шапок, которое может способствовать снижению щелочности океана. Если бы лед растаял, общий объем океана увеличился бы. Поскольку щелочность - это величина концентрации (моль / л), увеличение объема теоретически может способствовать уменьшению AТ. Однако реальный эффект был бы намного сложнее этого.[12]
Глобальная временная изменчивость
Исследователи показали, что щелочность океана меняется со временем. Потому что АТ рассчитывается по ионам в океане, изменение химического состава приведет к изменению щелочности. Один из способов этого - подкисление океана. Однако океаническая щелочность относительно стабильна, поэтому значительные изменения могут происходить только в течение длительного времени (то есть от сотен до тысяч лет).[13] В результате сезонная и годовая изменчивость, как правило, очень низкая.[10]
Пространственная изменчивость
Исследователи также показали, что щелочность варьируется в зависимости от местоположения. Местный АТ может зависеть от двух основных моделей смешивания: течения и реки. Перемешивание с преобладанием течения происходит недалеко от берега в районах с сильным течением воды. В этих областях тренды щелочности следуют текущим и имеют сегментированную взаимосвязь с соленостью.[14]
Перемешивание с преобладанием рек также происходит недалеко от берега; он наиболее силен вблизи устья большой реки (например, Миссисипи или Амазонки). Здесь реки могут действовать как источник или сток щелочности. АТ следует за истоком реки и имеет линейную зависимость от солености. Такой режим перемешивания наиболее важен в конце зимы и весной, потому что таяние снега увеличивает сток реки. По мере того как сезон переходит в лето, речные процессы становятся менее значительными, и смешивание течений может стать доминирующим процессом.[10]
Щелочность океанов также следует общим тенденциям в зависимости от широты и глубины. Было показано, что AТ часто обратно пропорциональна температуре поверхности моря (ТПМ). Следовательно, она обычно увеличивается с увеличением широты и глубины. В результате области апвеллинга (где вода из глубин океана выталкивается на поверхность) также имеют более высокие значения щелочности.[15]
Наборы данных измерений
На протяжении новейшей истории было много попыток измерить, зарегистрировать и изучить щелочность океана. Некоторые из более крупных наборов данных перечислены ниже.
- GEOSECS (Геохимическое исследование разрезов океана)
- TTO / NAS (Transient Tracers in the Ocean / North Atlantic Study)
- JGOFS (Совместное исследование глобального потока в океане)
- ВОСЕ (Эксперимент по циркуляции Мирового океана)
- КАРИНА (двуокись углерода в Атлантическом океане)
Смотрите также
- Щелочные почвы
- База (химия)
- Биологический насос
- Обезщелачивание воды
- Проект анализа глобальных океанических данных
- Закисление океана
Рекомендации
- ^ «определение щелочи». www.dictionary.com. Получено 2018-09-30.
- ^ "Что такое щелочность?". Центр водных исследований. 2014 г.. Получено 5 февраля 2018.
- ^ а б Диксон, Эндрю Г. (1992). «Развитие концепции щелочности в морской химии». Морская химия, 40, 1: 49–63. Дои:10.1016 / 0304-4203 (92) 90047-Е.
- ^ «Общая щелочность». Агентство по охране окружающей среды США. Получено 6 марта 2013.
- ^ а б Kaushal, S. S .; Likens, G.E .; Utz, R.M .; Pace, M. L .; Grese, M .; Епсен, М. (2013). «Повышенное ощелачивание рек в восточной части США». Экологические науки и технологии: 130724203606002. Дои:10.1021 / es401046s.
- ^ а б c Древер, Джеймс I. (1988). Геохимия природных вод, второе издание. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0-13-351396-3.
- ^ Wolf-Gladrow, Dieter A .; Зибе, Ричард Э .; Клаас, Кристина; Кёртцингер, Арне; Диксон, Эндрю Г. (июль 2007 г.). «Общая щелочность: явное консервативное выражение и его применение к биогеохимическим процессам». Морская химия. 106 (1–2): 287–300. Дои:10.1016 / j.marchem.2007.01.006.
- ^ Диксон, А.Г. (июнь 1981 г.). «Точное определение общей щелочности и процедура оценки щелочности и общего неорганического углерода по данным титрования». Глубоководные исследования, часть A. Документы по океанографическим исследованиям. 28 (6): 609–623. Дои:10.1016/0198-0149(81)90121-7.
- ^ Бенджамин. Марк М. 2015. Химия воды. 2-е изд. Лонг-Гроув, Иллинойс: Waveland Press, Inc.
- ^ а б c d е Thomas, H .; Schiettecatte, L.-S .; и другие. Повышенное хранение углерода в океане от образования анаэробной щелочности в прибрежных отложениях. Обсуждения биогеологии. 2008, 5, 3575-3591
- ^ Ким, Х.-К. и К. Ли (2009), Значительный вклад растворенного органического вещества в щелочность морской воды, Geophys. Res. Lett., 36, L20603, Дои:10.1029 / 2009GL040271
- ^ Chen, B .; Цай, В. Использование щелочности для разделения источников таяния льда и рек в западной части Северного Ледовитого океана. Материалы совещания AGU по наукам об океане 2010 г., 2010 г., стр. 22–26.
- ^ Doney, S.C .; Fabry, V.J .; и другие. Окисление океана: другая проблема CO2. Анну. Rev. Mar. Sci., 2009, 69–92. Дои:10.1146 / annurev.marine.010908.163834
- ^ Cai, W.-J .; Hu, X. et al. Распределение щелочности в западной окраине северной части Атлантического океана. Журнал геофизических исследований. 2010, 115, 1-15. Дои:10.1029 / 2009JC005482
- ^ Millero, F.J .; Лук-порей.; Рош, М. Распределение щелочности в поверхностных водах основных океанов. Морская химия. 1998, 60, 111-130.
внешняя ссылка
- Холмс-Фарли, Рэнди. "Химия и аквариум: что такое щелочность?," Интернет-журнал Advanced Aquarist's. Щелочность в аквариумах с морской водой.
- DOE (1994) "[2],"Справочник методов анализа различных параметров системы углекислого газа в морской воде. Версия 2, A. G. Dickson & C. Goyet, ред. ORNL / CDIAC-74.
- Набор данных GEOSECS [3]
- Набор данных JGOFS [4]
- Набор данных WOCE [5]
- Набор данных КАРИНА [6]
Калькуляторы карбонатной системы
Следующие пакеты рассчитывают состояние карбонатной системы в морской воде (включая pH):
- CO2SYS, доступен как отдельный исполняемый файл, Excel электронная таблица или MATLAB сценарий.
- морской уголь, а Пакет R за Windows, Mac OS X и Linux (также доступны здесь)
- CSYS, а Скрипт Matlab

![{ displaystyle sum (conservativecations) - sum (conservativeanions) = [HCO_ {3} ^ {-}] + 2 [CO_ {3} ^ {2 -}] + [B (OH_ {4}) ^ {- }] + [OH ^ {-}] + [HPO_ {4} ^ {2 -}] + 2 [PO_ {4} ^ {3 -}] + [H_ {3} SiO_ {4} ^ {-}] + [NH_ {3}] + [HS ^ {-}] - [H ^ {+}] - [HSO_ {4} ^ {-}] - [HF] - [H_ {3} PO_ {4}] - [HNO_ {2}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35c3e50b2973a751ac9a353b86df56dc052b5ddc)