WikiDer > Формиат аммония
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Формиат аммония | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.007.959 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| CЧАС5NО2 | |
| Молярная масса | 63.056 г · моль−1 |
| Внешность | Белые моноклинные кристаллы, расплывающийся |
| Запах | Слегка аммиачный |
| Плотность | 1,26 г / см3[1] |
| Температура плавления | 116 ° С (241 ° F, 389 К) |
| Точка кипения | 180 ° С (356 ° F, 453 К) разлагается[2] |
| (граммы на 100 г воды) 102 г (0 ° C) 142,7 г (20 ° С) 202,4 г (40 ° С) 516 г (80 ° С)[2] | |
| Растворимость в других растворителях | Растворим в жидкости аммиак, алкоголь, диэтиловый эфир[2] |
| Термохимия | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -556,18 кДж / моль |
| Опасности | |
| Паспорт безопасности | Паспорт безопасности данных JT Baker |
| Пиктограммы GHS |  [1] [1] |
| Сигнальное слово GHS | Предупреждение |
| H315, H319, H335[1] | |
| P261, P305 + 351 + 338[1] | |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 410 мг / кг (мыши, внутривенно)[2] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Формиат аммония, NH4HCO2, это аммоний соль из муравьиная кислота. Это бесцветный, гигроскопичный, кристаллический твердый.
Восстановительное аминирование
Ацетон можно превратить в изопропиламин следующее:[нужна цитата]
- CH3C (O) CH3 + 2 HCO2− +NH4 → (CH3)2CHNHCHO + 2 H2O + NH3 + CO2
- (CH3)2CHNHCHO + H2O → (CH3)2CHNH2 + HCO2ЧАС
Использует
Чистый формиат аммония разлагается на формамид и воды при нагревании, и это его основное применение в промышленности. Муравьиная кислота также может быть получен реакцией формиата аммония с разбавленной кислотой, и, поскольку формиат аммония также получают из муравьиной кислоты, он может служить способом хранения муравьиной кислоты.
Формиат аммония также можно использовать в палладий на углероде (Pd / C) восстановление функциональных групп. В присутствии Pd / C формиат аммония разлагается до водород, углекислый газ, и аммиак. Этот газообразный водород адсорбируется на поверхности палладий металл, где он может реагировать с различными функциональными группами. Например, алкены можно свести к алканы, или же формальдегид к метанол. Активированные одинарные связи с гетероатомами также могут быть заменены атомами водорода (гидрогенолиз).
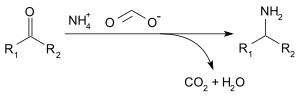
Формиат аммония можно использовать для восстановительное аминирование из альдегиды и кетоны (Лейкарт реакция) по следующей реакции:[3]
Формиат аммония можно использовать в качестве буфера в высокоэффективная жидкостная хроматография (ВЭЖХ) и подходит для использования с жидкостная хроматография-масс-спектрометрия (ЖХ / МС). В пKа значения муравьиной кислоты и иона аммония составляют 3,8 и 9,2 соответственно.
Реакции
При нагревании формиат аммония удаляет воду, образуя формамид. При дальнейшем нагревании образует цианистый водород (HCN) и вода. Побочной реакцией этого является разложение формамида до монооксид углерода (CO) и аммиак.
Рекомендации
- ^ а б c d Сигма-Олдрич Ко., Формиат аммония. Проверено 10 июня 2014.
- ^ а б c d http://chemister.ru/Database/properties-en.php?dbid=1&id=1071
- ^ Александр, Эллиот; Рут Боумен Уайлдман (1948). «Исследования механизма реакции Лейкарта». Журнал Американского химического общества. 70: 1187–1189. Дои:10.1021 / ja01183a091.
внешняя ссылка
![]() СМИ, связанные с Формиат аммония в Wikimedia Commons
СМИ, связанные с Формиат аммония в Wikimedia Commons