WikiDer > Бензилиденацетон
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК (E) -4-фенилбут-3-ен-2-он | |
| Другие имена Бензалацетон Бензилиденацетон Метил стирилкетон Бензилиден ацетон | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.015.989 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII |
|
| |
| |
| Свойства | |
| C10ЧАС10О | |
| Молярная масса | 146,19 г / моль |
| Внешность | бледно-желтое твердое вещество |
| Плотность | 1,008 г / см3 |
| Температура плавления | От 39 до 42 ° C (от 102 до 108 ° F, от 312 до 315 K) |
| Точка кипения | От 260 до 262 ° C (от 500 до 504 ° F; от 533 до 535 K) |
| 1,3 г / л | |
| Растворимость в других растворителях | неполярные растворители |
| Опасности | |
| Основной опасности | раздражитель |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H315, H317, H319, H335 | |
| P261, P264, P271, P272, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P333 + 313, P337 + 313, P362, P363, P403 + 233, P405, P501 | |
| точка возгорания | 116 ° С (241 ° F, 389 К) |
| Родственные соединения | |
Родственные соединения | Дибензилиденацетон коричный альдегид |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Бензилиденацетон это органическое соединение описывается формулой C6ЧАС5СН = СНС (О) СН3. Хотя оба СНГ- и транс-изомеры возможны для α, β-ненасыщенных кетоннаблюдается только транс-изомер. Его первоначальная подготовка продемонстрировала масштабы реакций конденсации для создания новых сложных органических соединений.[1] Бензилиденацетон используется в качестве ароматизатора в продуктах питания и парфюмерии.[2]
Подготовка
Бензилиденацетон может быть эффективно получен путем индуцированной NaOH конденсации легко доступных реагентов. ацетон и бензальдегид:[3]
Однако бензилиденацетон, образующийся в результате этой реакции, может подвергаться другому Конденсация Клайзена-Шмидта с другой молекулой бензальдегид формировать дибензилиденацетон. Поскольку относительно слабые основания, такие как NaOH, образуют очень мало енолят-ион при равновесии в реакционной смеси все еще остается много непрореагировавшего основания, которое может продолжаться и удалять протоны из альфа-углерод бензилиденацетона, позволяя ему претерпеть еще одну конденсацию Клайзена-Шмидта и получить дибензилиденацетон.[4]
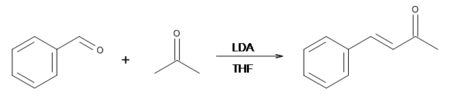
Если же, с другой стороны, диизопропиламид лития (LDA) используется в качестве основания, весь ацетон будет депротонирован, количественно образуя енолят-ион. Следовательно, наиболее эффективный способ получения бензилиденацетона - использовать эквимолярные количества LDA (в ТГФ), ацетон, и бензальдегид. Реакция должна проводиться с безводными химическими веществами, так как LDA распадается в воде.[5]
Реакции
Как и большинство метилкетонов, бензилиденацетон имеет умеренную кислотность в альфа-позиция, и его можно легко депротонировать с образованием соответствующего энолировать[6]
Соединение претерпевает реакции, ожидаемые для его набора функциональных групп: например, двойная связь добавляет бром, гетеродиен добавляет богатый электронами алкены в Дильс-Альдер реакции дать дигидропираны, метильная группа подвергается дальнейшей конденсации с бензальдегидом с образованием дибензилиденацетон, а карбонильные формы гидразоны. Он реагирует с Fe2(CO)9 давать (бензилиденацетон) Fe (CO)3, реагент для переноса Fe (CO)3 на другие органические субстраты.[7]
- Гидрирование бензилиденацетона приводит к получению бензилацетон.
- Реакция 4-гидроксикумарин с этим соединением дает Варфарин.
использованная литература
- ^ Клайзен, Л. "Убер Die Einwirkung von Aceton auf Furfural und auf Benzaldehyd bei Gegenwart von Alkalilauge" Berichte der deutschen chemischen Gesellschaft 1881, том 14, стр. 2468-2471.
- ^ Опдайк, Д. Л. Дж. (2013). Монографии по ароматическому сырью: сборник монографий, впервые появившихся в токсикологии пищевых продуктов и косметики. Эльзевир. п. 135. ISBN 9781483147970.
- ^ Drake, N.L .; Аллен младший П. «Бензалацетон». Органический синтез.; Коллективный объем, 1, п. 77
- ^ Мойя-Барриос, Р. Руководство лаборатории CHEM 2402, зима 2016 г. Университет Далхаузи, факультет химии
- ^ Брюс, Паула Юрканис. Органическая химия, 7-е издание. Pearson Education, 2014 г. ISBN 0-321-80322-1
- ^ Данхайзер, Р. Л.; Миллер, Р. Ф .; Брисбуа, Р. Г. (1990). "Перенос диазогруппы с детрифторацетилированием: (E) -1-диазо-4-фенил-3-бутен-2-он ». Органический синтез. 73: 134.; Коллективный объем, 9, п. 197
- ^ Knölker, H.-J. "(η4-Benzylideneacetone) tricarbonyliron »в Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. OnlineДои:10.1002 / 047084289X.rb058.