WikiDer > Биомиметический синтез
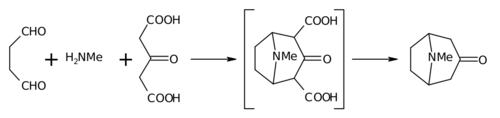
Биомиметический синтез это область органический химический синтез это специально биологически вдохновлено. Термин охватывает как проверку «биогенетической гипотезы» (предполагаемый протекания биосинтеза в природе) посредством выполнения серии реакций, направленных на параллель с предлагаемым биосинтезом, а также программ обучения, в которых синтетическая реакция или реакции, нацеленные на желаемую синтетическую цель, предназначены для имитации одной или нескольких известен ферментативный преобразование установленного биосинтетический путь.[1][2] Самым ранним обычно цитируемым примером биомиметического синтеза является Сэр Роберт Робинсонс органический синтез алкалоида тропинон.[3]
Более свежий пример: E.J. Корис карбений-опосредованная циклизация инженерного линейного полиен обеспечить тетрациклический стероидный препарат кольцевая система,[4] которые основаны на исследованиях катионных циклизаций линейных полиенов Альберт Эшенмозер и Гилберт Аист,[5][6] и обширные исследования W.S. Джонсон для определения требований к инициированию и прекращению циклизации и стабилизации катионной карбениевой группы во время циклизации (поскольку природа обеспечивает ферменты во время биосинтеза стероиды Такие как холестерин).[7] Что касается второго определения, синтетический органический или же неорганический катализаторы применяется для осуществления химического преобразования, осуществляемого в природе посредством биокатализатор (например, чисто белковый катализатор, а металл или другой кофактор привязанный к фермент, или рибозим) можно сказать, что он выполняет биомиметический синтез, где проектирование и определение характеристик таких каталитических систем было названо биомиметическая химия.[8][9][10]
Синтез прото-дафнифиллин
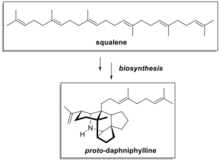
Прото-дафнифиллин является предшественником в биосинтез семьи алкалоиды нашел в Дафнифиллум макроподум. Интересен своим сложным молекулярная структура что делает его сложной мишенью для традиционных методов органического синтеза из-за структуры конденсированного кольца и спироуглеродного центра. На основе предложенного пути биосинтеза прото-дафнифиллин из сквален, Клейтон Хиткок и сотрудники разработали удивительно элегантный и короткий полный синтез прото-дафнифиллин из простых исходных материалов.[11] Это пример того, как биомиметический синтез может упростить полный синтез сложного природного продукта.
Ключевой этап синтетического пути Хиткока включает циклизацию ациклических диальдегидов A или B с образованием прото-дафнифиллин. Оба диальдегида (A или B) имеют углеродный скелет, аналогичный сквалену, и могут быть синтезированы из простых исходных материалов. Обработка A или B последовательностью простых реагентов, содержащих гидроксид калия, аммиак, и уксусная кислота привело к формированию прото-дафнифиллин. На этом замечательном этапе были образованы шесть σ-связей и пять колец. В первоначальном отчете было предложено, что гидроксилдигидропиран промежуточный C впервые образовался, когда исходный диальдегид (A) был обработан гидроксидом калия. Промежуточное соединение 2-аза-1,3-диена (D) получали в результате реакции промежуточного соединения C с аммиаком. Катализированный кислотой Реакция Дильса-Альдера образует промежуточное соединение E, которое затем превращают в конечный продукт в условиях реакции.
Примеры биомиметических синтезов в Википедии
- карпаноне, через подход Чепмена
- спиротрипростатин В, через подход Ганесана
- эндиандриновая кислота, видеть Биомиметик Полный синтез, через подход Николау
Дополнительные литературные примеры биомиметических синтезов
- Синтез C-нор-D-гомо накитерпиозинового типа компанией Merckстероиды, например, Структурные: расщепленные, сжатые и расширенные кольца (секо-, нор- и гомостероиды), через миграцию атомов C-13[12]
- Хиткоковский синтез сквален-производные алкалоиды дафнифиллинового ряда, например, Дафнифиллум, через каскады тетра / пентациклизации[13][14]
Рекомендации
- ^ de la Torre MC, Сьерра, Массачусетс (январь 2004 г.). «Комментарии о последних достижениях в области биомиметического органического синтеза». Энгью. Chem. Int. Эд. Англ.. 43 (2): 160–81. Дои:10.1002 / anie.200200545. PMID 14695603.
- ^ ван Тамелен Э.Е. (1961). Синтез натуральных продуктов биогенетического типа. Fortschr. Chem. Орг. Натурст. 19. С. 242–290. Дои:10.1007/978-3-7091-7156-1_5. ISBN 978-3-7091-7158-5.
- ^ Робинсон Р. (1917). "LXIII. Синтез тропинона". Журнал химического общества, Сделки. 111: 762–768. Дои:10.1039 / CT9171100762.
- ^ Кори Э.Дж., Ло Г, Лин Л.С. (1997). «Простой энантиоселективный синтез биологически активного тетрациклического морского сестертерерпена скалярного происхождения». Варенье. Chem. Soc. 119 (41): 9927–28. Дои:10.1021 / ja972690l.
- ^ Eschenmoser A, Felix D, Gut M, Meier J, Stadler P (1959). «Некоторые аспекты кислотно-катализируемой циклизации терпеноидных полиенов». В Wolstenholme GE, O'Conner M (ред.). Симпозиум Фонда Ciba по биосинтезу терпенов и стероидов. Симпозиумы Фонда Новартис. Лондон: Дж. И А. Черчилль. С. 217–230. Дои:10.1002 / 9780470719121.ch14. ISBN 9780470719121.
- ^ Аист Г., Бургстралер А.В. (1955). «Стереохимия циклизации полиенов». Варенье. Chem. Soc. 77 (19): 5068–77. Дои:10.1021 / ja01624a038.
- ^ Джонсон В.С., Маршалл Дж. А., Кина Дж. Ф., Франк Р. В., Мартин Д. Г., СП Бауэр (1966). «Общий синтез стероидов - подход гидрохризена - XVI: рацемический конессин, прогестерон, холестерин и некоторые родственные натуральные продукты». Тетраэдр. 22: 541–601. Дои:10.1016 / S0040-4020 (01) 90961-5.
- ^ Breslow R (Январь 2009 г.). «Биомиметическая химия: биология как источник вдохновения». Журнал биологической химии. 284 (3): 1337–42. Дои:10.1074 / jbc.X800011200. PMID 18784073.
- ^ Ли С.К., Холм Р.Х. (апрель 2003 г.). «Спекулятивная синтетическая химия и проблема нитрогеназы». Труды Национальной академии наук Соединенных Штатов Америки. 100 (7): 3595–600. Дои:10.1073 / pnas.0630028100. ЧВК 152967. PMID 12642670.
- ^ Breslow R (1995). «Биомиметическая химия и искусственные ферменты: катализ по дизайну». Отчеты о химических исследованиях. 28 (3): 146–153. Дои:10.1021 / ar00051a008.
- ^ Пьеттре С, Хиткок СН (Июнь 1990 г.). «Биомиметический общий синтез прото-дафнифиллина». Наука. 248 (4962): 1532–4. Дои:10.1126 / science.248.4962.1532. PMID 17818314.
- ^ Гао С., Чен С. (2012). «Накитерпиозин». В Ли Дж.Дж., Кори ЭДжей (ред.). Полный синтез натуральных продуктов: на пороге органической химии. Берлин: Springer. С. 25–38. ISBN 978-3-642-34065-9.
- ^ Хиткок СН, Хансен М.М., Руджери Р.Б., Кэт Дж.С. (1992). «Алкалоиды дафнифиллума. 11. Биомиметический тотальный синтез метилгомосекодафнифиллата. Развитие реакции тетрациклизации». Журнал органической химии. 57 (9): 2544–53. Дои:10.1021 / jo00035a008.
- ^ Хиткок СН, Piettre S, Ruggeri RB, Ragan JA, Kath JC (1992). «Алкалоиды дафнифиллума. 12. Предлагаемый биосинтез пентациклового скелета. прото-Дафнифиллин ». Журнал органической химии. 57 (9): 2554–66. Дои:10.1021 / jo00035a009.
дальнейшее чтение
- Poupon E, Nay B, ред. (2011). Биомиметический органический синтез. Алкалоиды. 1. Wiley-VCH Verlag GmbH & Co. KGaA. Дои:10.1002/9783527634606. ISBN 978-3-527-32580-1.
- Эшли Э (5 января 2004 г.). «Биомиметический синтез натуральных продуктов» (PDF). Литературный семинар, Исследовательская группа Штольца. Калифорнийский технологический институт. Архивировано из оригинал (PDF) 23 июня 2010 г.. Получено 24 ноября, 2013.