WikiDer > Органокатализ

В органическая химия, период, термин органокатализ (а чемодан терминов «органический» и «катализатор») относится к форме катализ, при этом скорость химическая реакция увеличивается на органический катализатор называемый «органокатализатор», состоящий из углерод, водород, сера и другие неметаллические элементы, содержащиеся в органических соединениях.[3][4][5][6][7][8] Из-за схожести состава и описания их часто принимают за неправильное употребление за ферменты из-за их сопоставимого воздействия на скорость реакции и формы вовлеченного катализа.
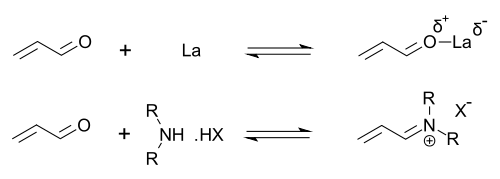
Органокатализаторы, показывающие вторичные амин функциональность может быть описана как выполнение либо енамин катализ (путем образования каталитических количеств активного енамина нуклеофил) или же иминий катализ (путем образования каталитических количеств активированного иминиевого электрофила). Этот механизм типичен для ковалентного органокатализа. Ковалентное связывание субстрата обычно требует высокой загрузки катализатора (для пролинового катализа обычно 20-30 мол.%). Нековалентные взаимодействия, такие как водородная связь, облегчают низкие загрузки катализатора (до 0,001 мол.%).
Органокатализ дает несколько преимуществ. Нет необходимости в катализе на основе металлов, что вносит вклад в зеленая химия. В этом контексте простые органические кислоты использовались в качестве катализатора для модификации целлюлозы в воде в многотонном масштабе.[9] Когда органокатализатор хиральный проспект открыт для асимметричный катализ, например, использование пролин в альдольные реакции является примером хиральности и зеленой химии.[10]
Вступление
Обычные ахиральные органокатализаторы основаны на азоте, таком как пиперидин используется в Конденсация Кневенагеля.[11] DMAP используется в эстерификации[12] и DABCO используется в Реакция Бейлиса-Хиллмана.[13] Соли тиазолия работают в Реакция Стеттера. Эти катализаторы и реакции имеют долгую историю, но текущий интерес к органокатализу сосредоточен на асимметричный катализ с хиральными катализаторами, называемыми асимметричный органокатализ или же энантиоселективный органокатализ. Новаторская реакция, разработанная в 1970-х годах, называется Реакция Хайоса – Пэрриша – Эдера – Зауэра – Вихерта.. Между 1968 и 1997 годами было лишь несколько сообщений об использовании малых органических молекул в качестве катализаторов асимметричных реакций (реакция Хайоса – Пэрриша, вероятно, самая известная), но эти химические исследования рассматривались скорее как уникальные химические реакции, чем как интегральные. части более крупного взаимосвязанного поля.[14]
В этой реакции встречающийся в природе хиральный пролин является хиральным катализатором в Альдольная реакция. Исходный материал - ахиральный трикетон и требуется всего 3% пролина для получения продукта реакции, кетола в 93% энантиомерный избыток. Это первый пример асимметричной альдольной реакции, катализируемой аминокислотами.[15][16]
Асимметричный синтез Кетон Виланда-Мишера (1985) также основан на пролине, и еще одно раннее применение было одним из преобразований в полный синтез из Эритромицин к Роберт Б. Вудворд (1981).[17] Краткий обзор статьи посвящен избранным недавним примерам полного синтеза природных и фармацевтических продуктов с использованием органокаталитических реакций.[18]
Многие хиральные органокатализаторы являются адаптацией хиральные лиганды (которые вместе с металлическим центром также катализируют асимметричные реакции), и обе концепции в некоторой степени совпадают.
Классы органокатализаторов
Органокатализаторы асимметричного синтеза можно разделить на несколько классов:
- Биомолекулы: пролин, фенилаланин. Вторичные амины в целом.[19] В хинные алкалоиды, определенный олигопептиды.
- Синтетические катализаторы на основе биомолекул.
- Катализаторы водородного связывания, включая ТАДДОЛЫ, производные от БИНОЛ Такие как НОБИН, и органокатализаторы на основе тиомочевины
- Соли триазолия как новое поколение Реакция Стеттера катализаторы
Примеры асимметричных реакций с участием органокатализаторов:
- Асимметричные реакции Дильса-Альдера
- Асимметричные реакции Майкла
- Асимметричные реакции Манниха
- Эпоксидирование Ши
- Органокаталитический перенос гидрирования
Пролин
Был рассмотрен пролиновый катализ.[20][21]
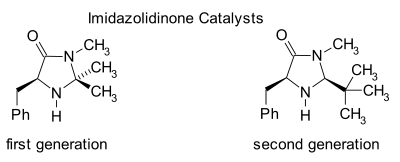
Имидазолидиноновый органокатализ
Имидазолидиноны являются катализаторами многих превращений, таких как асимметричные реакции Дильса-Альдера и Майкл дополнения. Хиральные катализаторы индуцируютасимметричные реакции, часто с высокой энантиоселективностью. Этот катализатор работает, образуя иминиевый ион с карбонил группы α, β-ненасыщенных альдегидов (Enals) и Enones в быстром химическое равновесие. Этот активация иминия аналогична активации карбонильных групп Кислота Льюиса и оба катализатора снижают LUMO:[22][23]
Промежуточный иминиевый промежуточный продукт является хиральным, который переносится в продукт реакции через хиральная индукция. Катализаторы использовались в Реакции Дильса-Альдера, Майкл дополнения, Алкилирование Фриделя-Крафтса, перенос гидрирования и эпоксидирование.
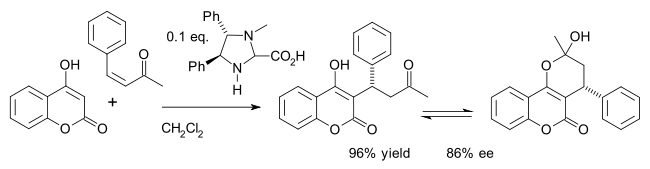
Одним из примеров является асимметричный синтез лекарства. варфарин (в равновесии с гемикетальный) в Майкл дополнение из 4-гидроксикумарин и бензилиденацетон:[24]
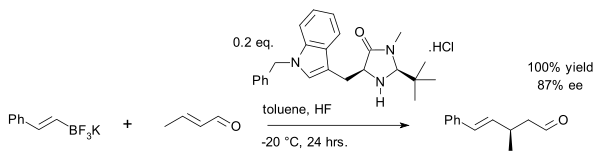
Недавний эксплойт - это винил алкилирование кротоновый альдегид с органотрифторборатная соль:[25]
Другие примеры его использования: см. органокаталитический перенос гидрирования и асимметричные реакции Дильса-Альдера.
Органокатализ тиомочевины
Большая группа органокатализаторов включает мочевина или тиомочевина часть. Эти каталитически эффективные производные (тио) мочевины, называемые органокатализаторами (тио) мочевины, обеспечивают явную двойную водородная связь взаимодействия для координации и активации субстратов, принимающих водородные связи.[26]
Рекомендации
- ^ Юстус фон Либих, Юстус (1860). "Ueber die Bildung des Oxamids aus Cyan". Annalen der Chemie und Pharmacie. 113 (2): 246–247. Дои:10.1002 / jlac.18601130213.
- ^ В. Лангенбек (1929). "Über Organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden". Либигс Энн. 469: 16–25. Дои:10.1002 / jlac.19294690103.
- ^ Беркессель А., Грегер Х. (2005). Асимметричный органокатализ. Вайнхайм: Wiley-VCH. ISBN 978-3-527-30517-9.CS1 maint: несколько имен: список авторов (связь)
- ^ Специальный выпуск: Список, Бенджамин (2007). «Органокатализ». Chem. Rev. 107 (12): 5413–5883. Дои:10.1021 / cr078412e.
- ^ Петр I. Далко; Лайонел Мойсан (2004). «В золотой век органокатализа». Энгью. Chem. Int. Эд. 43 (39): 5138–5175. Дои:10.1002 / anie.200400650. PMID 15455437.
- ^ Мэтью Дж. Гонт; Карин К. Йоханссон; Энди МакНелли; Нгок Т. Во (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня. 12 (1/2): 8–27. Дои:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ Дитер Эндерс; Кристоф Грондал; Маттиас Р. М. Хюттль (2007). «Асимметричные органокаталитические домино реакции». Энгью. Chem. Int. Эд. 46 (10): 1570–1581. Дои:10.1002 / anie.200603129. PMID 17225236.
- ^ Петр I. Далко; Лайонел Мойсан (2001). «Энантиоселективный органокатализ». Энгью. Chem. Int. Эд. 40 (20): 3726–3748. Дои:10.1002 / 1521-3773 (20011015) 40:20 <3726 :: AID-ANIE3726> 3.0.CO; 2-D.
- ^ Международный патент WO 2006068611 A1 20060629 «Прямая гомогенная и гетерогенная модификация аминов и спиртов, катализируемая органическими кислотами и аминокислотами». Изобретатели: Армандо Кордова, Стокгольм, Швеция; Йонас Хафрен, Стокгольм, Швеция.
- ^ Пример 4 в патенте США № 3975440 от 17 августа 1976 г., поданном 9 декабря 1970 г. Золтану Г. Хаджосу и Дэвиду Р. Пэрришу.
- ^ Лист Б. (2010). «Эмиль Кневенагель и корни аминокатализа». Angewandte Chemie International Edition на английском языке. 49 (10): 1730–1734. Дои:10.1002 / anie.200906900. PMID 20175175.
- ^ Нейзес, Бернхард; Стеглих, Вольфганг (июль 1978). «Простой метод этерификации карбоновых кислот». Angewandte Chemie International Edition на английском языке. 17 (7): 522–524. Дои:10.1002 / anie.197805221.
- ^ Басаваиа, Деэви; Рао, Анумолу Джаганмохан; Сатьянараяна, Тумманапалли (март 2003 г.). "Последние достижения в реакции и приложениях Бейлиса-Хиллмана". Химические обзоры. 103 (3): 811–892. Дои:10.1021 / cr010043d. PMID 12630854.
- ^ «Появление и развитие органокатализа» Дэвид К. Макмиллан, ПРИРОДАТом 455 | 18 сентября 2008| DOI: 10.1038 / nature07367
- ^ Z. G. Hajos, D. R. Parrish, патент Германии DE 2102623 1971
- ^ Золтан Г. Хаджос; Дэвид Р. Пэрриш (1974). «Асимметричный синтез бициклических интермедиатов химии природных продуктов». J. Org. Chem. 39 (12): 1615–1621. Дои:10.1021 / jo00925a003.
- ^ Р. Б. Вудворд; Э. Логуш; К. П. Намбьяр; К. Сакан; Д. Э. Уорд; Б. В. Ау-Йунг; П. Баларам; Л. Дж. Браун; и другие. (1981). «Асимметричный общий синтез эритромцина. 1. Синтез эритронолидного производного секокислоты посредством асимметричной индукции». Варенье. Chem. Soc. 103 (11): 3210–3213. Дои:10.1021 / ja00401a049.
- ^ Б. -Ф. Солнце (2015). «Полный синтез натуральных и фармацевтических продуктов за счет органокаталитических реакций». Tetrahedron Lett. 56 (17): 2133–2140. Дои:10.1016 / j.tetlet.2015.03.046.
- ^ Бертельсен, Сорен (2009). «Органокатализ - после золотой лихорадки». Обзоры химического общества. 38 (8): 2178–89. Дои:10.1039 / b903816g. PMID 19623342.
- ^ Gaunt, M. J .; Johansson, C. C. C .; McNally, A .; Во, Н. Т. (2007). «Энантиоселективный органокатализ». Открытие наркотиков сегодня. 12 (1–2): 8–27. Дои:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ Кучеренко, А. С .; Сиюткин, Д. Э .; Мальцев, О. В .; Кочетков, С. В .; Злотин, С. Г. (2013). «Асимметричный органокатализ: от пролина до высокоэффективных иммобилизованных органокатализаторов». Российский химический вестник. 61 (7): 1313. Дои:10.1007 / s11172-012-0177-4. S2CID 93168492.
- ^ Жеральд Леле; Дэвид В. К. Макмиллан (2006). "Современные стратегии в области органического катализа: появление и развитие активации иминия" (PDF). Aldrichimica Acta. 39 (3): 79.
- ^ Эрккиля, Анниина; Маджандер, Инкери; Пихко, Петри М. (2007). «Иминиум-катализ». Chem. Rev. 107 (12): 5416–5470. Дои:10.1021 / cr068388p. PMID 18072802.
- ^ Ниш Халланд; Торе Хансен; Карл Анкер Йоргенсен (2003). «Органокаталитическая асимметричная реакция Михаэля циклических 1,3-дикарбонильных соединений и α, β-ненасыщенных кетонов - высокоатомно-экономичное каталитическое одностадийное образование оптически активного антикоагулянта варфарина». Энгью. Chem. Int. Эд. 42 (40): 4955–4957. Дои:10.1002 / anie.200352136. PMID 14579449.
- ^ Сандра Ли; Дэвид В. К. Макмиллан (2007). "Органокаталитический винил и алкилирование по Фриделю-Крафтсу солями трифторбората" (PDF). Варенье. Chem. Soc. 129 (50): 15438–15439. Дои:10.1021 / ja0767480. PMID 18031044.
- ^ Мадарас, Адам; Доса, Жолт; Варга, Сцилард; Соос, Тибор; Csámpai, Antal; Папай, Имре (июль 2016 г.). "Производные тиомочевины как органокатализаторы кислоты Бренстеда" (PDF). Катализ ACS. 6 (7): 4379–4387. Дои:10.1021 / acscatal.6b00618.