WikiDer > CUL4A
Каллин-4А это белок что у людей кодируется CUL4A ген.[4][5] CUL4A принадлежит к Cullin семья убиквитинлигаза белки и очень гомологичен CUL4B белок. CUL4A регулирует множество ключевых процессов, таких как восстановление ДНК, ремоделирование хроматина, сперматогенез, кроветворение и митотический клеточный цикл. В результате CUL4A был причастен к нескольким видам рака и патогенез некоторых вирусов, включая ВИЧ. Было обнаружено, что компонент комплекса CUL4A, цереблон, является основной мишенью тератогенного агента. талидомид.
Структура
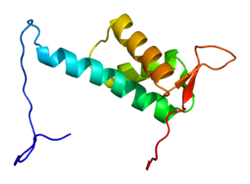
Белок CUL4A состоит из 759 аминокислот и образует протяженную жесткую структуру, в основном состоящую из альфа-спирали. На N-конец, CUL4A связывается с бета-винт из DDB1 адаптерный белок, который взаимодействует с многочисленными DDB1-CUL4-ассоциированными факторами (DCAF). В результате N-конец имеет решающее значение для набора субстратов для убиквитинлигаза сложный. На C-терминал конец, CUL4A взаимодействует с RBX1/ ROC1 через его RING домен. RBX1 является основным компонентом комплексов убиквитин-лигаза Cullin-RING (CRL) и выполняет функцию рекрутирования E2 ферменты, конъюгирующие с убиквитином. Следовательно, C-конец CUL4A - вместе с RBX1 и активированными ферментами E2 - составляет каталитическое ядро комплексов CRL4. CUL4A также модифицирован ковалентным присоединением NEDD8 молекула у высококонсервативного остатка лизина в С-концевой области. Эта модификация, по-видимому, вызывает конформационные изменения, которые способствуют гибкости в RING-домене Cullin белки и повышенная активность убиквитинлигазы.[6]
В целом комплексы CRL4A имеют модульную структуру, которая позволяет осуществлять сложную регуляцию клеткой и влиять на многочисленные субстраты и процессы в клетке. Хотя отдельные части различаются, все убиквитин-лигазы на основе кульлина обладают этими характеристиками.[7]
Функция
Повреждение и восстановление ДНК
Адаптерный белок DDB1 первоначально был охарактеризован как большая субъединица гетеродимерного комплекса (UV-DDB), который, как было обнаружено, распознает поврежденную ДНК и участвует в форме репарации, известной как эксцизионная репарация нуклеотидов (NER). Меньшая субъединица этого белкового комплекса, связывающего поврежденную ДНК, известна как DDB2 и способен напрямую связывать повреждения ДНК, связанные с УФ-облучением. DDB2 представляет собой белок DCAF и одновременно является субстратом убиквитинирования комплекса CRL4, а также служит белком лигазы E3 для других субстратов, таких как XPC и гистоны (см. следующий раздел) рядом с местом повреждения.[8] Из-за его убиквитинирования белков DDB2 и XPC, распознающих повреждения ДНК, CUL4A был описан как негативный регулятор активности NER.[9][10] В дополнение к «глобальному» типу NER, комплекс CRL4A, по-видимому, также играет роль в «транскрипционно-связанном» NER в сочетании с Синдром Кокейна А белок.[11] Комплексы CRL4A, по-видимому, активируются определенными типами повреждений ДНК (в первую очередь, УФ-облучением), а некоторые субстраты предпочтительно убиквитинируются после индукции повреждения ДНК.
Ремоделирование хроматина
Роль CUL4A в модификации хроматина во многом связана с активностью восстановления ДНК и происходит после индукции повреждения ДНК. И CUL4A, и его близкородственный гомолог CUL4B могут убиквитинировать гистоны H2A, H3 и H4.[12][13] Дрожжевой гомолог CUL4A, Rtt101, убиквитинирует гистон H3 и способствует нуклеосома комплексы сборки и CRL4A выполняют сходные функции в клетках человека.[14] Комплексы CRL4 также влияют на события метилирования гистонов и структуру хроматина через регуляцию гистоновые метилтрансферазы.[15] Монометилаза гистона H4 PR-Set7 / SET8 убиквитинируется на хроматине комплексами CRL4 (Cdt2) во время фазы S и после повреждения ДНК в PCNA-зависимая манера.[16][17][18]
Регуляция клеточного цикла и репликации ДНК
Комплексы CRL4A регулируют вход в фазу синтеза ДНК, или S фазамитотического цикла путем регулирования уровней экспрессии белка фактора лицензирования репликации Cdt1 и ингибитор циклин-зависимой киназы стр.21. В обоих случаях CRL4A использует Cdt2 как DCAF, чтобы связывать оба субстрата PCNA-зависимым образом. Во время невозмущенного прогрессирования клеточного цикла убиквитинирование и подавление этих белков с помощью CRL4ACdt2 происходит в начале репликации ДНК. Повреждение ДНК, такое как УФ-облучение, также индуцирует CRL4A.Cdt2-опосредованное разрушение этих белков. Оба субстрата также регулируются SCFSkp2 сложный.
CRL4-опосредованное разрушение p21 облегчает циклин E-Cdk2 ингибирование и способствует переходу в S-фазу. Потеря экспрессии Cdt2 увеличивает экспрессию p21 в клетках и стабилизирует p21 после УФ-облучения.[19] Делеция CUL4A приводит к задержке вступления в S-фазу в эмбриональных фибробластах мыши, что устраняется делецией p21.[10] В клетках пигментного эпителия сетчатки человека потеря экспрессии Cdt2 также приводит к p21-зависимому отсроченному вступлению в S-фазу и повторной экспрессии p21 в S-фазе, что приводит к циклам неполной репликации, долгосрочному накоплению p21 и в некоторых случаях индукция апоптоза.[20]
После стимулирования инициации репликации эукариотической ДНК в источник, Cdt1 инактивируется Близнецы и предназначен для деградации SCFSkp2 и CRL4Cdt2 комплексы. Экспрессия Cdt1 стабилизируется с помощью РНКи-опосредованного нокдауна DDB1 или обоих CUL4A и CUL4B, что предполагает дублирующую или перекрывающуюся функцию двух белков CUL4 для регуляции Cdt1.[21][22] Только снижение экспрессии Geminin, по-видимому, вызывает повторную репликацию в Cdt1-сверхэкспрессирующих клетках.
CRL4 также используют Cdt2 и PCNA для разрушения субъединицы p12 ДНК-полимераза δ во время фазы S и после УФ-облучения.[23]
Гемопоэз
Комплексы CRL4A, по-видимому, вызывают деградацию многих членов HOX семейства транскрипции, которые являются важными регуляторами кроветворения.[24] Первым членом семейства HOX, идентифицированным как мишень CRL4A-опосредованной деградации, является HOXA9, который важен для поддержания гемопоэтических стволовых клеток и участвует в подмножестве миелоидные лейкозы.[25][26] HOXA9 Degron лежит в гомеодомен, который имеет решающее значение для связывания ДНК. Исследования выравнивания последовательностей показали, что внутри спирали первого гомеодомена присутствует высококонсервативный мотив «LEXE». Когда несколько аминокислот в этом мотиве были мутированы, HOXB4 стал устойчивым к CRL4A-опосредованной деградации.[24] Рецептор субстрата, или DCAF, необходимый для деградации белка HOX, остается неизвестным.
Сперматогенез и мейоз
В Cul4a ген необходим для нормального сперматогенез и мейоз в мужских половых клетках мышей.[27][28] Cul4a−/− мужчины производят ненормальную сперму и бесплодны. В то время как CUL4A и CUL4B экспрессируются в мужских гаметах, CUL4A высоко экспрессируется в пахитены и диплотены. Именно на этих стадиях мужские половые клетки с дефицитом CUL4A обнаруживают высокие уровни апоптоз, неправильный Ремонт ДНК и накопление субстрата CRL4 Cdt1.
Нарушение регуляции
Рак
Хромосомная область ch13q34, содержащая CUL4A ген амплифицируется в 3-6% определенных карциномы в том числе: рак груди, матки, легких, желудка и колоректального рака.[29] CUL4A также мутирует или амплифицируется примерно в 4% меланомы (хотя мутации рассредоточены, а отдельные мутации возникают спорадически).
В моделях мышей Cul4a нокаут приводил к выраженной устойчивости к УФ-индуцированному канцерогенезу кожи.[10] Cre-индуцированный Cul4a повышенная экспрессия в легочной ткани мыши гиперплазия.[30]
Из-за наблюдаемого усиления CUL4A в нескольких карциномах и тот факт, что комплексы CRL4 нацелены на множественную репарацию ДНК и гены-супрессоры опухолей, CUL4A можно считать онкоген в определенных контекстах.
Вирусный патогенез
Благодаря своей устойчивой экспрессии (особенно во время репликации ДНК) и модульной природе комплексы CRL4A можно кооптировать или «захватить», чтобы способствовать вирусной пролиферации в клетках млекопитающих.
Определенный парамиксовирусы избегать интерферон ответ в клетках путем нацеливания STAT1 и нарушение сигнализации. Вирус обезьяны 5 и вирус парагриппа человека типа II экспрессируют белок, названный «V», который действует как рецептор субстрата и связывает белки DDB1 и STAT (структура CRL4ASV5V комплекс изображен на вставке) - таким образом, вызывая убиквитинирование и деградацию STAT1[31][32]
DCAF1 также называется ВПРБП из-за его взаимодействия с белком ВИЧ-1 Впр. Хотя DCAF1 / VPRBP, по-видимому, играет решающую роль в подавлении опухолей, репликации ДНК и эмбриональном развитии, ВИЧ-1 «захватывает» комплекс убиквитин-лигазы, чтобы вызвать остановку клеточного цикла в Фаза G2.[33][34][35] CRL4ADCAF1-Vpr индуцирует убиквитинирование ядерной изоформы урацил-ДНК гликозилаза.[36][37] ВИЧ-2, по-видимому, также использует CRL4A.DCAF1 через Vpx индуцированное белком разрушение лентивирус-ингибирующей дезоксинуклеозид трифосфогидролазы, названной SAMHD1.[38][39]
Лечение талидомидом
В 2010 году Ито и др. сообщили, что Cereblon, белок DCAF, был основной мишенью тератогенного соединения талидомида.[40] Талидомид и другие производные, такие как помалидомид и леналидомид известны как иммуномодулирующие препараты (или IMiD) и были исследованы в качестве терапевтических агентов при аутоиммунных заболеваниях и некоторых видах рака, особенно миеломах. Последние отчеты показывают, что IMiD привязываются к CRL4.CRBN и способствуют деградации факторов транскрипции IKZF1 и IKZF3, которые обычно не являются мишенью для комплексов CRL4.[41][42]
Взаимодействия и субстраты
Формы CUL4A человека прямые взаимодействия с:
Комплексы CUL4A-DDB1-RBX1 человека способствуют убиквитинированию:
†белок является субстратом CRL4A только тогда, когда направляется вирусными белками
§белок является субстратом CRL4A только когда направляется IMiDs
Примечания
Версия этой статьи 2015 года была обновлена внешним экспертом в соответствии с моделью двойной публикации. Соответствующие академическая экспертная оценка статья была опубликована в Ген и может быть процитирован как: Джеффри Ханна, Пэнбо Чжоу (15 ноября 2015 г.). «Отличительные и перекрывающиеся функции белков каркаса лигазы cullin E3 CUL4A и CUL4B». Ген. 573 (1): 33–45. Дои:10.1016 / J.GENE.2015.08.064. ЧВК 5110433. PMID 26344709.CS1 maint: использует параметр авторов (связь) |
Рекомендации
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000031446 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Kipreos ET, Lander LE, Wing JP, He WW, Hedgecock EM (июнь 1996 г.). «cul-1 необходим для выхода из клеточного цикла C. elegans и определяет новое семейство генов». Клетка. 85 (6): 829–39. Дои:10.1016 / S0092-8674 (00) 81267-2. PMID 8681378. S2CID 15805562.
- ^ «Энтрез Джин: CUL4A Cullin 4A».
- ^ Дуда Д.М., Борг Л.А., Скотт Д.К., Хант Х.В., Хаммель М., Шульман Б.А. (сентябрь 2008 г.). «Структурное понимание активации NEDD8 лигаз cullin-RING: конформационный контроль конъюгации». Клетка. 134 (6): 995–1006. Дои:10.1016 / j.cell.2008.07.022. ЧВК 2628631. PMID 18805092.
- ^ Bosu DR, Kipreos ET (2008). «Убиквитинлигазы Cullin-RING: глобальные циклы регуляции и активации». Отделение клеток. 3: 7. Дои:10.1186/1747-1028-3-7. ЧВК 2266742. PMID 18282298.
- ^ а б Сугасава К., Окуда Й, Сайджо М., Ниси Р., Мацуда Н., Чу Г., Мори Т., Иваи С., Танака К., Танака К., Ханаока Ф. (май 2005 г.). «УФ-индуцированное убиквитилирование белка XPC, опосредованное УФ-DDB-убиквитинлигазным комплексом». Клетка. 121 (3): 387–400. Дои:10.1016 / j.cell.2005.02.035. PMID 15882621. S2CID 16773579.
- ^ Чен X, Чжан Дж., Ли Дж., Лин П.С., Форд Дж. М., Чжэн Н., Чжоу П. (май 2006 г.). «Независимая от киназы функция c-Abl в обеспечении протеолитического разрушения поврежденных ДНК-связывающих белков». Молекулярная клетка. 22 (4): 489–99. Дои:10.1016 / j.molcel.2006.04.021. PMID 16713579.
- ^ а б c d Лю Л., Ли С., Чжан Дж., Петерс С.Б., Ханна Дж., Чжан И, Инь И, Кофф А., Ма Л., Чжоу П. (май 2009 г.). «Отмена CUL4A усиливает реакцию на повреждение ДНК и защищает от канцерогенеза кожи». Молекулярная клетка. 34 (4): 451–60. Дои:10.1016 / j.molcel.2009.04.020. ЧВК 2722740. PMID 19481525.
- ^ Ханна Дж., Чжоу П. (апрель 2009 г.). «Регулирование путей ответа на повреждение ДНК с помощью убиквитинлигаз cullin-RING». Ремонт ДНК. 8 (4): 536–43. Дои:10.1016 / j.dnarep.2009.01.011. ЧВК 2858918. PMID 19231300.
- ^ Герреро-Санторо Дж., Капетанаки М.Г., Се К.Л., Горбачинский И., Левин А.С., Рапич-Отрин В. (июль 2008 г.). «На основе cullin 4B поврежденная УФ-излучением ДНК-связывающая протеин-лигаза связывается с поврежденным УФ-излучением хроматином и убиквитинирует гистон H2A». Исследования рака. 68 (13): 5014–22. Дои:10.1158 / 0008-5472.CAN-07-6162. PMID 18593899.
- ^ Ван Х, Чжай Л., Сюй Дж, Джу Х., Джексон С., Эрдджумент-Бромаж Х, Темпст П, Сюн Й, Чжан И (май 2006 г.). «Убиквитилирование гистонов H3 и H4 с помощью убиквитинлигазы CUL4-DDB-ROC1 способствует клеточному ответу на повреждение ДНК». Молекулярная клетка. 22 (3): 383–94. Дои:10.1016 / j.molcel.2006.03.035. PMID 16678110.
- ^ Хан Дж, Чжан Х, Чжан Х, Ван З, Чжоу Х, Чжан З (ноябрь 2013 г.). «Убиквитинлигаза Cul4 E3 регулирует передачу гистонов во время сборки нуклеосом». Клетка. 155 (4): 817–29. Дои:10.1016 / j.cell.2013.10.014. ЧВК 3994564. PMID 24209620.
- ^ Хига Л.А., Ву М., Йе Т, Кобаяши Р., Сун Х., Чжан Х. (ноябрь 2006 г.). «Убиквитинлигаза CUL4-DDB1 взаимодействует с множеством белков WD40-повторов и регулирует метилирование гистонов». Природа клеточной биологии. 8 (11): 1277–83. Дои:10.1038 / ncb1490. HDL:10397/34293. PMID 17041588. S2CID 22180568.
- ^ а б Йоргенсен С., Эскильдсен М., Фуггер К., Хансен Л., Ларсен М.С., Кушольт А.Н., Сильюосен Р.Г., Трелле МБ, Йенсен О.Н., Хелин К., Соренсен С.С. (январь 2011 г.). «SET8 разрушается посредством убиквитилирования CRL4 (CDT2), связанного с PCNA, в S-фазе и после УФ-облучения». Журнал клеточной биологии. 192 (1): 43–54. Дои:10.1083 / jcb.201009076. ЧВК 3019552. PMID 21220508.
- ^ а б Тардат М., Брюстель Дж., Кирш О, Лефевбре С., Калланан М., Сардет С., Жюльен Е. (ноябрь 2010 г.). «Гистон H4 Lys 20 метилтрансфераза PR-Set7 регулирует начало репликации в клетках млекопитающих». Природа клеточной биологии. 12 (11): 1086–93. Дои:10.1038 / ncb2113. PMID 20953199. S2CID 6710289.
- ^ а б Oda H, Hübner MR, Beck DB, Vermeulen M, Hurwitz J, Spector DL, Reinberg D (ноябрь 2010 г.). «Регулирование PR-Set7 монометилазы гистона H4 посредством CRL4 (Cdt2) -опосредованной PCNA-зависимой деградации во время повреждения ДНК». Молекулярная клетка. 40 (3): 364–76. Дои:10.1016 / j.molcel.2010.10.011. ЧВК 2999913. PMID 21035370.
- ^ а б Аббас Т., Сивапрасад Ю., Тераи К., Амадор В., Пагано М., Датта А. (сентябрь 2008 г.). «PCNA-зависимая регуляция убиквитилирования и деградации p21 посредством комплекса убиквитинлигазы CRL4Cdt2». Гены и развитие. 22 (18): 2496–506. Дои:10.1101 / gad.1676108. ЧВК 2546691. PMID 18794347.
- ^ Барр, Алексис Р .; Купер, Сэмюэл; Heldt, Frank S .; Бутера, Франческа; Стой, Генриетта; Мансфельд, Йорг; Новак, Бела; Бакал, Крис (2017). «Повреждение ДНК во время S-фазы опосредует решение о прекращении пролиферации в последующем G1 через экспрессию p21». Nature Communications. 8: 14728. Bibcode:2017НатКо ... 814728B. Дои:10.1038 / ncomms14728. ЧВК 5364389. PMID 28317845.
- ^ а б Хига Л.А., Михайлов И.С., Бэнкс Д.П., Чжэн Дж., Чжан Х. (ноябрь 2003 г.). «Радиационно-опосредованный протеолиз CDT1 комплексами CUL4-ROC1 и CSN составляет новую контрольную точку». Природа клеточной биологии. 5 (11): 1008–15. Дои:10.1038 / ncb1061. PMID 14578910. S2CID 26070877.
- ^ а б Ху Дж., Сюн Й. (февраль 2006 г.). «Эволюционно законсервированная функция ядерного антигена пролиферирующих клеток для деградации Cdt1 убиквитинлигазой Cul4-Ddb1 в ответ на повреждение ДНК». Журнал биологической химии. 281 (7): 3753–6. Дои:10.1074 / jbc.C500464200. PMID 16407242.
- ^ а б Чжан С., Чжао Х., Дарзынкевич З., Чжоу П., Чжан З., Ли EY, Ли М.Я. (2013). «Новая функция CRL4 (Cdt2): регуляция субъединичной структуры ДНК-полимеразы δ в ответ на повреждение ДНК и во время S-фазы». J. Biol. Chem. 288 (41): 29550–61. Дои:10.1074 / jbc.M113.490466. ЧВК 3795253. PMID 23913683.
- ^ а б c Ли Дж., Ши Дж. Х., Чжан Дж., Лю Л., Чжан Й, Эом Дж. Й., Моррон Дж., Мур М. А., Чжоу П. (май 2013 г.). «Улучшение ex vivo размножения взрослых гемопоэтических стволовых клеток за счет преодоления CUL4-опосредованной деградации HOXB4». Кровь. 121 (20): 4082–9. Дои:10.1182 / кровь-2012-09-455204. ЧВК 3656448. PMID 23520338.
- ^ а б Чжан И, Моррон Г., Чжан Дж, Чен Икс, Лу Х, Ма Л, Мур М, Чжоу П. (ноябрь 2003 г.). «CUL-4A стимулирует убиквитилирование и деградацию гомеодоменного белка HOXA9». Журнал EMBO. 22 (22): 6057–67. Дои:10.1093 / emboj / cdg577. ЧВК 275435. PMID 14609952.
- ^ Lawrence, H.J .; Christensen, J .; Fong, S .; Hu, Y. L .; Weissman, I .; Sauvageau, G .; Humphries, R.K .; Ларгман, К. (2005). «Потеря экспрессии гомеобокса гена Hoxa-9 ухудшает способность гемопоэтических стволовых клеток к пролиферации и репопуляции». Кровь. 106 (12): 3988–3994. Дои:10.1182 / кровь-2005-05-2003. ЧВК 1895111. PMID 16091451.
- ^ Инь И, Линь С., Ким С.Т., Ройг И., Чен Х., Лю Л., Вейт Г.М., Джин РУ, Кини С., Джасин М., Моли К., Чжоу П., Ма Л. (2011). «Убиквитинлигаза E3 Cullin 4A регулирует мейотическую прогрессию в сперматогенезе мышей». Dev. Биол. 356 (1): 51–62. Дои:10.1016 / j.ydbio.2011.05.661. ЧВК 3130830. PMID 21624359.
- ^ Копанджа Д., Рой Н., Стоянова Т., Гесс Р.А., Багчи С., Райчаудхури П. (2011). «Cul4A необходим для сперматогенеза и мужской фертильности». Dev. Биол. 352 (2): 278–87. Дои:10.1016 / j.ydbio.2011.01.028. ЧВК 3065526. PMID 21291880.
- ^ "cBioPortal for Cancer Genomics". Архивировано из оригинал на 2015-05-21.
- ^ Ли Т, Хун М.С., Ван И, Мао Дж. Х., Тан Дж. Л., Джахан К., Роос Х, Сюй З., Джаблон Д. М., Ю Л. (март 2011 г.). «Трансгенные мыши для кре-индуцируемой сверхэкспрессии гена Cul4A». Бытие. 49 (3): 134–41. Дои:10.1002 / dvg.20708. ЧВК 3285554. PMID 21381181.
- ^ а б Ulane CM, Kentsis A, Cruz CD, Parisien JP, Schneider KL, Horvath CM (август 2005 г.). «Состав и сборка комплексов убиквитинлигазы, нацеленных на STAT: карбоксильный конец белка парамиксовируса V является доменом олигомеризации». Журнал вирусологии. 79 (16): 10180–9. Дои:10.1128 / JVI.79.16.10180-10189.2005. ЧВК 1182666. PMID 16051811.
- ^ а б Драгоценный Б., Чайлдс К., Фицпатрик-Суоллоу В., Гудборн С., Рэндалл Р. Э. (ноябрь 2005 г.). «Белок 5V обезьяньего вируса действует как адаптер, связывающий DDB1 с STAT2, чтобы облегчить убиквитинирование STAT1». Журнал вирусологии. 79 (21): 13434–41. Дои:10.1128 / JVI.79.21.13434-13441.2005. ЧВК 1262611. PMID 16227264.
- ^ McCall CM, Miliani de Marval PL, Chastain PD, Jackson SC, He YJ, Kotake Y, Cook JG, Xiong Y (сентябрь 2008 г.). «Vpr-связывающий белок VprBP вируса иммунодефицита человека типа 1, белок WD40, связанный с убиквитинлигазой DDB1-CUL4 E3, необходим для репликации ДНК и эмбрионального развития». Молекулярная и клеточная биология. 28 (18): 5621–33. Дои:10.1128 / MCB.00232-08. ЧВК 2546929. PMID 18606781.
- ^ Le Rouzic E, Belaïdouni N, Estrabaud E, Morel M, Rain JC, Transy C, Margottin-Goguet F (январь 2007 г.). «Vpr ВИЧ1 останавливает клеточный цикл путем привлечения DCAF1 / VprBP, рецептора убиквитинлигазы Cul4-DDB1». Клеточный цикл. 6 (2): 182–8. Дои:10.4161 / cc.6.2.3732. PMID 17314515.
- ^ Вэнь Сяоюнь; Дуус, Карен М .; Фридрих, Томас Д .; Де Норонья, Карлос М.С. (2007). «Белок Vpr ВИЧ1 способствует остановке цикла G2Cell, задействуя DDB1 и Cullin4A-содержащий комплекс убиквитин-лигазы с использованием VprBP / DCAF1 в качестве адаптера». Журнал биологической химии. 282 (37): 27046–27057. Дои:10.1074 / jbc.M703955200. PMID 17620334.
- ^ а б Ан Дж, Ву Т, Новинце З, Герреро-Санторо Дж, Рапик-Отрин В., Гроненборн А.М. (ноябрь 2010 г.). «Vpr ВИЧ-1 загружает урацил-ДНК-гликозилазу-2 на DCAF1, субъединицу распознавания субстрата убиквитинлигазы Е3 с кольцом 4А кулина для протеасомозависимой деградации». Журнал биологической химии. 285 (48): 37333–41. Дои:10.1074 / jbc.M110.133181. ЧВК 2988339. PMID 20870715.
- ^ а б Вен X, Кейси Клоков Л., Некорчук М., Шарифи Х. Дж., Де Норонья К. М. (2012). «Белок Vpr ВИЧ1 усиливает конститутивный DCAF1-зависимый оборот UNG2». PLOS ONE. 7 (1): e30939. Bibcode:2012PLoSO ... 730939W. Дои:10.1371 / journal.pone.0030939. ЧВК 3265533. PMID 22292079.
- ^ а б Hofmann H, Logue EC, Bloch N, Daddacha W., Polsky SB, Schultz ML, Kim B, Landau NR (декабрь 2012 г.). «Дополнительный лентивирусный белок Vpx нацелен на SAMHD1 для деградации в ядре». Журнал вирусологии. 86 (23): 12552–60. Дои:10.1128 / JVI.01657-12. ЧВК 3497686. PMID 22973040.
- ^ а б Ан Дж, Хао С., Ян Дж., ДеЛусия М., Мехренс Дж., Ван С., Гроненборн А.М., Сковронски Дж. (Апрель 2012 г.). «Дополнительный фактор вирулентности вируса иммунодефицита обезьян (SIV) Vpx загружает фактор ограничения клетки-хозяина SAMHD1 на комплекс убиквитинлигазы E3 CRL4DCAF1». Журнал биологической химии. 287 (15): 12550–8. Дои:10.1074 / jbc.M112.340711. ЧВК 3321004. PMID 22362772.
- ^ Ито, Т .; Ando, H .; Сузуки, Т .; Огура, Т .; Хотта, К .; Imamura, Y .; Yamaguchi, Y .; Ханда, Х. (2010). «Идентификация основной мишени тератогенности талидомида». Наука. 327 (5971): 1345–1350. Bibcode:2010Sci ... 327.1345I. Дои:10.1126 / science.1177319. PMID 20223979. S2CID 17575104.
- ^ а б c Лу Джи, Миддлтон Р.Э., Сан Х., Нанионг М., Отт С.Дж., Мициадес К.С., Вонг К.К., Брэднер Дж. Э., Келин В. Г. мл. «Лекарство от миеломы леналидомид способствует цеблон-зависимому разрушению белков Ikaros». Наука. 343 (6168): 305–9. Bibcode:2014Научный ... 343..305Л. Дои:10.1126 / science.1244917. ЧВК 4070318. PMID 24292623.
- ^ а б c Krönke J, Udeshi ND, Narla A, Grauman P, Hurst SN, McConkey M, Svinkina T, Heckl D, Comer E, Li X, Ciarlo C, Hartman E, Munshi N, Schenone M, Schreiber SL, Carr SA, Ebert BL (2014). «Леналидомид вызывает избирательную деградацию IKZF1 и IKZF3 в клетках множественной миеломы». Наука. 343 (6168): 301–5. Bibcode:2014Научный ... 343..301K. Дои:10.1126 / science.1244851. ЧВК 4077049. PMID 24292625.
- ^ Шиянов П., Наг А., Райчаудхури П. (декабрь 1999 г.). «Cullin 4A связывается с поврежденным ультрафиолетом ДНК-связывающим белком DDB». Журнал биологической химии. 274 (50): 35309–12. Дои:10.1074 / jbc.274.50.35309. PMID 10585395.
- ^ Диас, округ Колумбия, Dolios G, Ван Р, Пан ZQ (декабрь 2002 г.). «CUL7: Cullin, содержащий домен DOC, избирательно связывает Skp1.Fbx29 с образованием SCF-подобного комплекса». Труды Национальной академии наук Соединенных Штатов Америки. 99 (26): 16601–6. Дои:10.1073 / pnas.252646399. ЧВК 139190. PMID 12481031.
- ^ Охта Т., Мишель Дж. Дж., Шоттелиус А. Дж., Сюн Й. (апрель 1999 г.). «ROC1, гомолог APC11, представляет собой семейство партнеров кулина с ассоциированной активностью убиквитинлигазы». Молекулярная клетка. 3 (4): 535–41. Дои:10.1016 / с1097-2765 (00) 80482-7. PMID 10230407.
- ^ Мин К.В., Хван Дж. В., Ли Дж. С., Пак Й., Тамура Т. А., Юн Дж. Б. (май 2003 г.). «TIP120A связывается с кулинами и модулирует активность убиквитинлигазы». Журнал биологической химии. 278 (18): 15905–10. Дои:10.1074 / jbc.M213070200. PMID 12609982.
- ^ Серино Г., Дэн XW (2003). «Сигналосома COP9: регулирование развития растений посредством контроля протеолиза» (PDF). Ежегодный обзор биологии растений. 54: 165–82. Дои:10.1146 / annurev.arplant.54.031902.134847. PMID 14502989.
- ^ Чен Х, Чжан И, Дуглас Л., Чжоу П. (декабрь 2001 г.). «Поврежденные УФ-излучением ДНК-связывающие белки являются мишенями для CUL-4A-опосредованного убиквитинирования и деградации». Журнал биологической химии. 276 (51): 48175–82. Дои:10.1074 / jbc.M106808200. PMID 11673459.
- ^ Нишитани Х., Сиоми Й., Иида Х., Мичисита М., Таками Т., Цуримото Т. (октябрь 2008 г.). «Ингибитор CDK p21 разлагается с помощью связанного с ядерным антигеном пути Cul4-DDB1Cdt2 пролиферирующих клеток во время S-фазы и после УФ-облучения». Журнал биологической химии. 283 (43): 29045–52. Дои:10.1074 / jbc.M806045200. ЧВК 2662008. PMID 18703516.
внешняя ссылка
- Человек CUL4A расположение генома и CUL4A страница сведений о генах в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB за UniProt: Q13619 (Cullin-4A) на PDBe-KB.
дальнейшее чтение
- Осака Ф., Кавасаки Х., Аида Н., Саеки М., Чиба Т., Кавасима С., Танака К., Като С. (август 1998 г.). «Новая система лигирования NEDD8 для cullin-4A». Гены и развитие. 12 (15): 2263–8. Дои:10.1101 / gad.12.15.2263. ЧВК 317039. PMID 9694792.
- Chen LC, Manjeshwar S, Lu Y, Moore D, Ljung BM, Kuo WL, Dairkee SH, Wernick M, Collins C, Smith HS (август 1998 г.). «Человеческий гомолог гена Cul-4 Caenorhabditis elegans усилен и сверхэкспрессируется при первичном раке молочной железы». Исследования рака. 58 (16): 3677–83. PMID 9721878.
- Охта Т., Мишель Дж. Дж., Шоттелиус А. Дж., Сюн Й. (апрель 1999 г.). «ROC1, гомолог APC11, представляет собой семейство партнеров кулина с ассоциированной активностью убиквитинлигазы». Молекулярная клетка. 3 (4): 535–41. Дои:10.1016 / S1097-2765 (00) 80482-7. PMID 10230407.
- Хори Т., Осака Ф., Чиба Т., Миямото К., Окабаяси К., Шимбара Н., Като С., Танака К. (ноябрь 1999 г.). «Ковалентная модификация всех членов белков семейства кулинов человека с помощью NEDD8». Онкоген. 18 (48): 6829–34. Дои:10.1038 / sj.onc.1203093. PMID 10597293.
- Ляпина С., Коуп Г., Шевченко А., Серино Г., Цуге Т., Чжоу С., Вольф Д.А., Вей Н., Шевченко А., Дешайес Р.Дж. (май 2001 г.). «Содействие расщеплению конъюгата NEDD-CUL1 сигнаносомой COP9». Наука. 292 (5520): 1382–5. Bibcode:2001Научный ... 292.1382Л. Дои:10.1126 / science.1059780. PMID 11337588. S2CID 14224920.
- Чен Х, Чжан И, Дуглас Л., Чжоу П. (декабрь 2001 г.). «Поврежденные УФ-излучением ДНК-связывающие белки являются мишенями для CUL-4A-опосредованного убиквитинирования и деградации». Журнал биологической химии. 276 (51): 48175–82. Дои:10.1074 / jbc.M106808200. PMID 11673459.
- Ясуи К., Ари С., Чжао С., Имото И., Уэда М., Нагаи Х., Эми М., Инадзава Дж. (Июнь 2002 г.). «TFDP1, CUL4A и CDC16, идентифицированные как мишени для амплификации на 13q34 в гепатоцеллюлярной карциноме». Гепатология. 35 (6): 1476–84. Дои:10.1053 / jhep.2002.33683. PMID 12029633.
- Лю Дж., Фурукава М., Мацумото Т., Сюн Й. (декабрь 2002 г.). «Модификация NEDD8 CUL1 диссоциирует p120 (CAND1), ингибитор связывания CUL1-SKP1 и лигаз SCF». Молекулярная клетка. 10 (6): 1511–8. Дои:10.1016 / S1097-2765 (02) 00783-9. PMID 12504025.
- Мин К.В., Хван Дж. В., Ли Дж. С., Пак Й., Тамура Т. А., Юн Дж. Б. (май 2003 г.). «TIP120A связывается с кулинами и модулирует активность убиквитинлигазы». Журнал биологической химии. 278 (18): 15905–10. Дои:10.1074 / jbc.M213070200. PMID 12609982.
- Гройсман Р., Полановска Дж., Кураока И., Савада Дж., Сайджо М., Драпкин Р., Киселев А.Ф., Танака К., Накатани Ю. (май 2003 г.). «Активность убиквитинлигазы в комплексах DDB2 и CSA по-разному регулируется сигнаносомой COP9 в ответ на повреждение ДНК». Клетка. 113 (3): 357–67. Дои:10.1016 / S0092-8674 (03) 00316-7. PMID 12732143. S2CID 11639677.
- Хига Л.А., Михайлов И.С., Бэнкс Д.П., Чжэн Дж., Чжан Х. (ноябрь 2003 г.). «Радиационно-опосредованный протеолиз CDT1 комплексами CUL4-ROC1 и CSN составляет новую контрольную точку». Природа клеточной биологии. 5 (11): 1008–15. Дои:10.1038 / ncb1061. PMID 14578910. S2CID 26070877.
- Вертц И.Е., О'Рурк К.М., Чжан З., Дорнан Д., Арнотт Д., Деше Р.Дж., Диксит В.М. (февраль 2004 г.). «Деэтиолированный-1 человека регулирует c-Jun путем сборки убиквитинлигазы CUL4A» (PDF). Наука. 303 (5662): 1371–4. Bibcode:2004Наука ... 303.1371W. Дои:10.1126 / science.1093549. PMID 14739464. S2CID 40501515.
- Обусе С., Ян Х., Нодзаки Н., Гото С., Окадзаки Т., Йода К. (февраль 2004 г.). «Протеомический анализ центромерного комплекса из интерфазных клеток HeLa: поврежденный УФ излучением ДНК-связывающий белок 1 (DDB-1) является компонентом CEN-комплекса, в то время как BMI-1 временно совмещен с центромерной областью в интерфазе». Гены в клетки. 9 (2): 105–20. Дои:10.1111 / j.1365-2443.2004.00705.x. PMID 15009096.
- Ху Дж., Макколл К.М., Охта Т., Сюн Й. (октябрь 2004 г.). «Целевое убиквитинирование CDT1 лигазой DDB1-CUL4A-ROC1 в ответ на повреждение ДНК». Природа клеточной биологии. 6 (10): 1003–9. Дои:10.1038 / ncb1172. PMID 15448697. S2CID 34194616.
- Наг А., Багчи С., Райчаудхури П. (ноябрь 2004 г.). «Cul4A физически связывается с MDM2 и участвует в протеолизе p53». Исследования рака. 64 (22): 8152–5. Дои:10.1158 / 0008-5472.CAN-04-2598. PMID 15548678.
- Мацуда Н., Адзума К., Сайджо М., Иемура С., Хиоки Ю., Нацумэ Т., Чиба Т., Танака К., Танака К. (май 2005 г.). «DDB2, продукт гена группы E xeroderma pigmentosum, непосредственно убиквитилирован комплексом убиквитин-лигазы на основе Cullin 4A». Ремонт ДНК. 4 (5): 537–45. Дои:10.1016 / j.dnarep.2004.12.012. PMID 15811626.