WikiDer > Карбаминовая кислота
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Карбаминовая кислота | |||
| Другие имена Аминометановая кислота | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| КЕГГ | |||
| MeSH | Карбаминовая + кислота | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
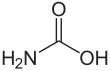
| CЧАС3NО2 | |||
| Молярная масса | 61.040 г · моль−1 | ||
| Родственные соединения | |||
Родственные соединения | Формамид Дитиокарбамат Угольная кислота Мочевина Этилкарбамат | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
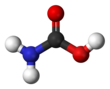
Карбаминовая кислота, который также можно назвать аминомуравьиная кислота или же аминокарбоновая кислота,[1] это химическое соединение с формулой H2NCOOH. Его можно получить по реакции аммиак NH3 и углекислый газ CO2 при очень низких температурах, что также дает такое же количество карбамат аммония. Соединение стабильно только примерно до 250 К (-23 ° C); при более высоких температурах он разлагается на эти два газа.[2] Твердое тело, по-видимому, состоит из димеры, с двумя молекулами, соединенными водородные связи между двумя карбоксил группы –COOH.[3]
Карбаминовую кислоту можно рассматривать как амин и карбоновая кислота, и поэтому аминокислота;[2] однако присоединение кислотной группы непосредственно к атому азота (без какой-либо промежуточной углеродной цепи) заставляет ее вести себя очень иначе, чем у этих классов. (Глицин обычно считается простейшей аминокислотой). В гидроксил группа, присоединенная к углероду, также исключает его из амид учебный класс.
Термин «карбаминовая кислота» также используется в общем для любых соединений в форме RHNCOOH или RR'NCOOH, где R и R 'представляют собой органический группы.[4]
Депротонирование карбаминовой кислоты дает карбамат анион RR′NCOO−, соли которых могут быть относительно стабильными. Карбамат - это также термин, используемый для сложные эфиры карбаминовых кислот, таких как метил карбамат ЧАС2NC (= O) OCH3. В карбамоил функциональная группа RR′NC (= O) - (часто обозначается как М3) представляет собой молекулу карбаминовой кислоты за вычетом ОН-части карбоксила.
Структура
Карбаминовая кислота - это плоская молекула.[2]
H2N– группа карбаминовой кислоты, в отличие от большинства аминов, не может быть протонированный для аммоний группа H3N+-. В цвиттерионный форма H3N+–COO− очень нестабилен и быстро разлагается на аммиак и углекислый газ,[5] но есть сообщение о его обнаружении во льдах, облученных высокоэнергетическими протоны.[2]
Производные
Карбаминовая кислота формально является исходным соединением нескольких важных семейств органических соединений:
Карбаминовые кислоты
Многие замещенные карбаминовые кислоты (RHNCOOH или RR'NCOOH) могут быть легко синтезированы барботированием диоксида углерода через растворы соответствующего амина (RNH2 или RR'NH соответственно) в подходящем растворителе, таком как ДМСО или же сверхкритический углекислый газ.[4] Эти карбаминовые кислоты обычно нестабильны при комнатной температуре, превращаясь в исходный амин и диоксид углерода.[6]
Карбаматные эфиры
В отличие от карбаминовых кислот эфиры карбамата обычно стабильны при комнатной температуре. Они приготовлены реакцией карбамоилхлориды со спиртами, добавление спиртов к изоцианаты, и реакция карбонатных эфиров с аммиаком.[7]
Встречаемость в природе
В фермент карбаматкиназа, участвовал в нескольких метаболический пути живых организмов, катализирует формирование карбамоилфосфат ЧАС
2NС (= O) OPO2−
3
Один гемоглобин молекула может переносить четыре молекулы углекислого газа в легкие как карбаматные группы, образованные реакцией CO
2 с четырьмя концевыми аминогруппами деокси-форма. Полученное соединение называется карбаминогемоглобин.
Использует
Промышленное
Карбаминовая кислота является промежуточным звеном в промышленном производстве мочевины, которое включает реакцию диоксида углерода и аммиака.[8]
- CO2 + NH3 → H2NCOOH
- ЧАС2NCOOH + NH3 → CO (NH2)2 + H2О
Медицинское
Некоторые эфиры карбамата используются в качестве миорелаксанты которые связаны с барбитурат сайт ГАМКА рецептор,[9] в то время как другие используются как инсектициды, Например алдикарб.[10]
Химический синтез
Функциональная группа амина –NH2 возможно защищенный от нежелательных реакций путем образования в виде эфира карбамата остаток –NHC (= O) –ИЛИ. Гидролиз из эфирная связь затем образуется карбаминовая кислота –NHC (= O) OH, которая затем теряет диоксид углерода, давая желаемый амин.
Смотрите также
Рекомендации
- ^ «Обзор соединения PubChem для CID 277, карбаминовая кислота». Национальный центр биотехнологической информации. 2020 г.. Получено 10 октября, 2020.
- ^ а б c d Р. К. Ханна и М. Х. Мур (1999): «Карбаминовая кислота: молекулярная структура и ИК-спектры». Spectrochimica Acta Часть A: Молекулярная и биомолекулярная спектроскопия, том 55, выпуск 5, страницы 961-967. Дои:10.1016 / S1386-1425 (98) 00228-5 PMID 10347902Bibcode:1999AcSpA..55..961K
- ^ J. B. Bossa, P. Theulé, F. Duvernay, F. Borget и T. Chiavassa (2008): "Карбаминовая кислота и образование карбамата в NH3: CO2 льды - УФ-облучение в сравнении с тепловыми процессами ». Астрономия и астрофизика, том 492, выпуск 3, страницы 719-724. Дои:10.1051/0004-6361:200810536
- ^ а б З. Дж. Дейкстра, А. Р. Дорнбос, Х. Вейтен, Дж. М. Эрнстинг, К. Дж. Эльзевьер и Дж. Т. Ф. Керентьес (2007): «Образование карбаминовой кислоты в органических растворителях и в сверхкритическом диоксиде углерода». Журнал сверхкритических жидкостей, том 41, выпуск 1, страницы 109-114. Дои:10.1016 / j.supflu.2006.08.012
- ^ Ю.-Дж. Чен, М. Нуэво, Ж.-М. Се, Т.-С. Yih, W.-H. Солнце, W.-H. ИП, Х.-С. Фунг, С.-Й. Чан, Ю.-Й. Ли, Ж.-М. Чен и Ч.-Й. Р. Ву (2007): «Карбаминовая кислота, полученная УФ / ЭУФ излучением аналогов межзвездного льда». Астрономия и астрофизика, том 464, выпуск 1, страницы 253-257. Дои:10.1051/0004-6361:20066631
- ^ Лемке, Томас Л. (2003). Обзор органических функциональных групп: введение в медицинскую органическую химию. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс. п. 63. ISBN 978-0-7817-4381-5.
- ^ Егер, Питер; Рентцеа, Костин Н .; Кечка, Хайнц (2000). «Карбаматы и карбамоилхлориды». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a05_051. ISBN 3527306730.
- ^ Meessen, J. H .; Петерсен, Х. «Мочевина». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a27_333.
- ^ Блок, Джон Х .; Бил, Джон М., ред. (2004). «Депрессант центральной нервной системы». Учебник Уилсона и Гисволда по органической лекарственной и фармацевтической химии. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс. п. 495. ISBN 978-0-7817-3481-3.
- ^ Ришер, Джон Ф .; Норка, Франклин Л .; Стара, Джерри Ф. (1987). «Токсикологические эффекты карбаматного инсектицида альдикарба на млекопитающих: обзор». Перспективы гигиены окружающей среды. 72: 267–281. Дои:10.2307/3430304. JSTOR 3430304. ЧВК 1474664. PMID 3304999.