WikiDer > Карбазол
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 9ЧАС-карбазол | |
| Другие имена 9-азафлуорен дибензопиррол дифениленимин дифениленимид ВВС США EK-600 | |
| Идентификаторы | |
3D модель (JSmol) | |
| 3956 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.001.542 |
| Номер ЕС |
|
| 102490 | |
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C12ЧАС9N | |
| Молярная масса | 167.211 г · моль−1 |
| Плотность | 1,301 г см−3 |
| Температура плавления | 246,3 ° С (475,3 ° F, 519,5 К)[1] |
| Точка кипения | 354,69 ° С (670,44 ° F, 627,84 К)[1] |
| −117.4 × 10−6 см3 моль−1 | |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| H341, H351, H400, H411, H413 | |
| P201, P202, P273, P281, P308 + 313, P391, P405, P501 | |
| точка возгорания | 220 ° С (428 ° F, 493 К) [1] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Карбазол является ароматный гетероциклический органическое соединение. Имеет трициклическую структуру, состоящую из двух шестичленных бензол кольца слиты по обе стороны от пятичленного азот-содержащее кольцо. В основе состава соединения лежит индол структура, но в которой второй бензол кольцо конденсируется с пятичленным кольцом в положении 2–3 индола (эквивалентно двойной связи 9a – 4a в карбазоле соответственно).
Карбазол входит в состав табачный дым.[2]
Синтез
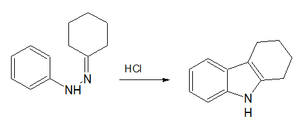
Классическая лаборатория органический синтез для карбазола Циклизация по Борше – Дрекселю.[3][4]
На первом этапе фенилгидразин является конденсированный с циклогексанон к соответствующему я добываю. Второй шаг - это соляная кислотакатализированный реакция перегруппировки и реакция замыкания кольца к тетрагидрокарбазол. В одной модификации обе стадии объединены в одну за счет проведения реакции в уксусная кислота.[5] На третьей стадии это соединение окисляется красный свинец к самому карбазолу.
Еще одна классика - это Синтез карбазола Bucherer, в котором используются нафтол и арилгидразин.[6]
Третий метод синтеза карбазола - это реакция Гребе – Ульмана.
На первом этапе N-фенил-1,2-диаминобензол (N-фенил-о-фенилендиамин) преобразуется в диазоний соль который мгновенно образует 1,2,3-триазол. Триазол нестабилен, и при повышенных температурах выделяется азот и образуется карбазол.[7][8]
Приложения
Аминоэтилкарбазол используется в производстве пигмент фиолетовый 23.

- Римказол также производится из собственно карбазола.
- Карпрофен другое использование.
- NNC 05-2090 & NNC 05-2045 оба являются необычными, но техническими примерами.
Родственные ароматические соединения
Рекомендации
- ^ а б c Лиде, Дэвид Р. (2007). Справочник CRC по химии и физике, 88-е издание. CRC Press. С. 3–86. ISBN 978-0-8493-0488-0.
- ^ Талхаут, Рейнскье; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхёйзен, Антун (2011). «Опасные соединения в табачном дыме». Int. J. Environ. Res. Здравоохранение. 8 (12): 613–628. Дои:10.3390 / ijerph8020613. ЧВК 3084482. PMID 21556207.
- ^ В. Борше (1908). "Ueber Tetra- und Hexahydrocarbazolverbindungen und eine neue Carbazolsynthese. (Mitbearbeitet von. A. Witte und W. Bothe.)". Justus Liebigs Ann. Chem. (на немецком). 359 (1–2): 49–80. Дои:10.1002 / jlac.19083590103.
- ^ Э. Дрехзель (1888). "Ueber Elektrolyse des Phenols mit Wechselströmen". J. Prakt. Chem. (на немецком). 38 (1): 65–74. Дои:10.1002 / prac.18880380105.
- ^ Роджерс, Кросби U .; Корсон, Б. Б. (1950). «1,2,3,4-Тетрагидрокарбазол (карбазол, 1,2,3,4-тетрагидро-)». Органический синтез. 30: 90. Дои:10.15227 / orgsyn.030.0090.; Коллективный объем, 4, п. 884
- ^ Ван, Зеронг (2010). "Bucherer Carbazole Synthesis". Комплексные органические названия реакций и реагенты. Дои:10.1002 / 9780470638859.conrr120. ISBN 9780470638859.
- ^ Карл Грэбе; Фриц Ульманн (1896). "Ueber eine neue Carbazolsynthese". Justus Liebigs Ann. Chem. (на немецком). 291 (1): 16–17. Дои:10.1002 / jlac.18962910104.
- ^ О. Бремер (1934). "Über die Bedeutung der Graebe-Ullmannschen Carbazolsynthese und deren Übertragung auf N-заместитель пиридинотриазола ». Justus Liebigs Ann. Chem. (на немецком). 514 (1): 279–291. Дои:10.1002 / jlac.19345140116.
внешняя ссылка
| Wikisource есть текст 1911 Британская энциклопедия статья Карбазол. |