WikiDer > Азот
 | |||||||||||||||||||||
| Азот | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешность | бесцветный газ, жидкость или твердое вещество | ||||||||||||||||||||
| Стандартный атомный вес Аr, std(N) | [14.00643, 14.00728] общепринятый:14.007 | ||||||||||||||||||||
| Азот в периодическая таблица | |||||||||||||||||||||
| |||||||||||||||||||||
| Атомный номер (Z) | 7 | ||||||||||||||||||||
| Группа | группа 15 (пниктогены) | ||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||
| Блокировать | p-блок | ||||||||||||||||||||
| Категория элемента | Реактивный неметалл | ||||||||||||||||||||
| Электронная конфигурация | [Он] 2 с2 2p3 | ||||||||||||||||||||
| Электронов на оболочку | 2, 5 | ||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||
| Фаза вSTP | газ | ||||||||||||||||||||
| Температура плавления | (N2) 63.15 K (-210,00 ° C, -346,00 ° F) | ||||||||||||||||||||
| Точка кипения | (N2) 77,355 К (-195,795 ° С, -320,431 ° F) | ||||||||||||||||||||
| Плотность (на СТП) | 1,2506 г / л[1] при 0 ° C, 1013 мбар | ||||||||||||||||||||
| в жидком состоянии (приб.п.) | 0,808 г / см3 | ||||||||||||||||||||
| Тройная точка | 63,151 К, 12,52 кПа | ||||||||||||||||||||
| Критическая точка | 126,21 К, 3,39 МПа | ||||||||||||||||||||
| Теплота плавления | (N2) 0.72 кДж / моль | ||||||||||||||||||||
| Теплота испарения | (N2) 5,56 кДж / моль | ||||||||||||||||||||
| Молярная теплоемкость | (N2) 29,124 Дж / (моль · К) | ||||||||||||||||||||
Давление газа
| |||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||
| Состояния окисления | −3, −2, −1, +1, +2, +3, +4, +5 (сильно кислый окись) | ||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 3,04 | ||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||
| Ковалентный радиус | 71±1 вечера | ||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 155 вечера | ||||||||||||||||||||
| Спектральные линии азота | |||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||
| Естественное явление | изначальный | ||||||||||||||||||||
| Кристальная структура | шестиугольник | ||||||||||||||||||||
| Скорость звука | 353 РС (газ, при 27 ° C) | ||||||||||||||||||||
| Теплопроводность | 25.83×10−3 Вт / (м · К) | ||||||||||||||||||||
| Магнитный заказ | диамагнитный | ||||||||||||||||||||
| Количество CAS | 17778-88-0 7727-37-9 (N2) | ||||||||||||||||||||
| История | |||||||||||||||||||||
| Открытие | Дэниел Резерфорд (1772) | ||||||||||||||||||||
| Названный | Жан-Антуан Шапталь (1790) | ||||||||||||||||||||
| Главный изотопы азота | |||||||||||||||||||||
| |||||||||||||||||||||
Азот это химический элемент с символ N и атомный номер 7. Впервые он был обнаружен и изолирован шотландским врачом. Дэниел Резерфорд в 1772 году. Карл Вильгельм Шееле и Генри Кавендиш Независимо сделал это примерно в то же время, Резерфорд обычно получает признание, потому что его работа была опубликована первой. Название нитроген был предложен французским химиком Жан-Антуан-Клод Шапталь в 1790 г., когда было обнаружено, что азот присутствует в азотная кислота и нитраты. Антуан Лавуазье предложил вместо имени азотот греческого ζωτικός «нет жизни», так как это удушающий газ; это имя вместо этого используется во многих языках, например Французский, Итальянский, русский, румынский и турецкий, и появляется в английских названиях некоторых соединений азота, таких как гидразин, азиды и азосоединения.
Азот - самый легкий член группа 15 периодической таблицы Менделеева, часто называемые пниктогенами. Это общий элемент в вселенная, оценивается примерно в седьмой по общему количеству в Млечный Путь и Солнечная система. В стандартная температура и давление, два атома элемента связывать с образованием диазота, бесцветного и без запаха двухатомный газ с формулой N2. Динитроген составляет около 78% Атмосфера Земли, что делает его самым распространенным несоединенным элементом. Азот присутствует во всех организмах, прежде всего в аминокислоты (и поэтому белки), в нуклеиновые кислоты (ДНК и РНК) и в молекуле переноса энергии аденозинтрифосфат. В человеческое тело содержит около 3% азота по массе, четвертый по распространенности элемент в организме после кислорода, углерода и водорода. В азотный цикл описывает движение элемента из воздуха в биосфера и органические соединения, а затем обратно в атмосферу.
Многие промышленно важные соединения, такие как аммиак, азотная кислота, органические нитраты (пропелленты и взрывчатка), и цианиды, содержат азот. Чрезвычайно сильный тройная связь в элементарном азоте (N≡N), вторая по прочности связь в любом двухатомная молекула после монооксид углерода (CO),[2] доминирует в химии азота. Это создает трудности как для организмов, так и для промышленности в преобразовании N2 в полезные соединения, но в то же время означает, что при сжигании, взрыве или разложении соединений азота с образованием газообразного азота высвобождается большое количество полезной энергии. Синтетически произведенные аммиак и нитраты являются ключевыми промышленными удобрения, а нитраты удобрений являются ключевыми загрязняющие вещества в эвтрофикация водных систем.
Помимо использования в удобрениях и запасах энергии, азот входит в состав столь же разнообразных органических соединений, как Кевлар используется в высокопрочной ткани и цианоакрилат используется в супер клей. Азот входит в состав всех основных классов фармакологических препаратов, включая антибиотики. Многие препараты являются имитаторами или пролекарства природного азотсодержащего сигнальные молекулы: например, органические нитраты нитроглицерин и нитропруссид контроль артериальное давление путем метаболизма в оксид азота. Многие известные азотсодержащие препараты, такие как натуральный кофеин и морфий или синтетический амфетаминыдействуют на рецепторы животных нейротрансмиттеры.
История

Соединения азота имеют очень долгую историю, хлорид аммония был известен Геродот. Они были хорошо известны в средние века. Алхимики знал азотную кислоту как Aqua Fortis (крепкая вода), а также другие соединения азота, такие как аммоний соли и нитрат соли. Смесь азотной и соляная кислота был известен как царская водка (королевская вода), известная своей способностью растворять золото, король металлов.[3]
Открытие азота приписывают шотландскому врачу. Дэниел Резерфорд в 1772 году, который назвал его ядовитый воздух.[4][5] Хотя он не считал это совершенно другим химическим веществом, он четко отличал его от вещества Джозефа Блэка. "фиксированный воздух", или диоксид углерода.[6] Дело в том, что там был компонент воздуха, который не поддерживает горение было ясно Резерфорду, хотя он не знал, что это элемент. Примерно в то же время азот исследовали Карл Вильгельм Шееле,[7] Генри Кавендиш,[8] и Джозеф Пристли,[9] кто назвал это горелый воздух или же флогистированный воздух. Французский химик Антуан Лавуазье называется газообразный азот как "зловонный воздух" или же азот, от Греческий слово άζωτικός (азотикос), «нет жизни», поскольку в основном инертный.[10][11] В атмосфере чистого азота животные погибли, а пламя погасло. Хотя имя Лавуазье не было принято на английском языке, поскольку было указано, что почти все газы (действительно, за исключением кислорода) являются ядовитыми, оно используется во многих языках (французском, итальянском, португальском, польском, русском, албанском, Турецкий и др .; немецкий Stickstoff аналогично относится к той же характеристике, а именно. Ersticken «задушить или задохнуться») и до сих пор остается на английском языке в общих названиях многих соединений азота, таких как гидразин и соединения азид ион. Наконец, это привело к названию "пниктогены"для группы, возглавляемой азотом, от греческого πνίγειν" задыхаться ".[3]
Английское слово «азот» (1794 г.) вошло в язык из французского нитроген, изобретенный в 1790 году французским химиком Жан-Антуан Шапталь (1756–1832),[12] из французов селитра (азотнокислый калий, также называемый селитра) и французский суффикс -ген, "производство", от Греческий -γενής (-genes, "рожденный"). Шапталь имел в виду, что азот является неотъемлемой частью азотная кислота, который, в свою очередь, был произведен из селитра. В прежние времена нитру путали с египетским «натроном» (карбонат натрия) - по-гречески νίτρον (нитрон) - который, несмотря на название, не содержал нитратов.[13]
Самые ранние военные, промышленные и сельскохозяйственные применения соединений азота использовали селитру (нитрат натрия или нитрат калия), особенно в порох, а позже как удобрение. В 1910 г. Лорд Рэйли обнаружил, что электрический разряд в газообразном азоте производит «активный азот», одноатомный аллотроп азота.[14] «Вихревое облако яркого желтого света», создаваемое его устройством, реагировало с Меркурий производить взрывчатку нитрид ртути.[15]
Долгое время источники азотных соединений были ограничены. Природные источники происходят либо из биологии, либо из отложений нитратов, образующихся в результате атмосферных реакций. Фиксация азота промышленными процессами, такими как Процесс Фрэнка – Каро (1895–1899) и Процесс Габера – Боша (1908–1913) уменьшили эту нехватку соединений азота до такой степени, что половина мировых производство продуктов питания (см. Приложения) теперь полагается на синтетические азотные удобрения.[16] В то же время использование Оствальдский процесс (1902) для производства нитратов путем промышленной фиксации азота позволил крупномасштабное промышленное производство нитратов в виде сырье в производстве взрывчатка в Мировые войны ХХ века.[17][18]
Характеристики
Атомный
У атома азота семь электронов. В основном состоянии они расположены в электронной конфигурации 1s2
2 с2
2p1
Икс2p1
у2p1
z. Таким образом, он имеет пять валентные электроны на 2s- и 2p-орбиталях, три из которых (p-электроны) неспарены. Имеет один из самых высоких электроотрицательность среди элементов (3,04 по шкале Полинга), превосходит только хлор (3.16), кислород (3.44), и фтор (3.98). (Свет благородные газы, гелий, неон, и аргон, предположительно, также будет более электроотрицательным, и на самом деле они находятся по шкале Аллена.)[19] Следуя периодическим тенденциям, его одинарная облигация ковалентный радиус 71 пм меньше, чем у бор (84 вечера) и углерод (76 пм), в то время как это больше, чем у кислорода (66 пм) и фтора (57 пм). В нитрид анион, N3−, намного больше в 146 часов вечера, как и у окись (O2−: 140 вечера) и фторид (F−: 133 пм) анионы.[19] Первые три энергии ионизации азота составляют 1,402, 2,856 и 4,577 МДж · моль.−1, а сумма четвертого и пятого составляет 16,920 МДж · моль.−1. Из-за этих очень высоких показателей у азота нет простой катионной химии.[20]
Отсутствие радиальных узлов в подоболочке 2p напрямую отвечает за многие аномальные свойства первого ряда p-блок, особенно в азоте, кислород, и фтор. Подоболочка 2p очень мала и имеет такой же радиус, что и оболочка 2s, что облегчает орбитальная гибридизация. Это также приводит к очень большим электростатическим силам притяжения между ядром и валентными электронами в 2s- и 2p-оболочках, что приводит к очень высоким электроотрицательностям. Гипервалентность практически неизвестен в 2p элементах по той же причине, потому что высокая электроотрицательность мешает маленькому атому азота быть центральным атомом в богатой электронами трехцентровая четырехэлектронная связь так как он будет иметь тенденцию сильно притягивать электроны к себе. Таким образом, несмотря на то, что азот занимает первое место в 15-й группе периодической таблицы, его химический состав сильно отличается от химического состава более тяжелых конгенеров. фосфор, мышьяк, сурьма, и висмут.[21]
Азот можно удобно сравнивать с его горизонтальными соседями углеродом и кислородом, а также с его вертикальными соседями по пниктогенному столбцу, фосфором, мышьяком, сурьмой и висмутом. Хотя каждый элемент периода 2 от лития до кислорода показывает некоторое сходство с элементом периода 3 в следующей группе (от магния до хлора; они известны как диагональные отношения), их степень резко спадает после пары бор – кремний. Сходство азота с серой в основном ограничивается кольцевыми соединениями нитрида серы, когда присутствуют только оба элемента.[22]
Азот не имеет склонности углерода к цепочка. Как и углерод, азот имеет тенденцию образовывать ионные или металлические соединения с металлами. Азот образует обширный ряд нитридов с углеродом, в том числе с цепными, графитовый, и фуллереновый-подобные структуры.[23]
Он напоминает кислород своей высокой электроотрицательностью и сопутствующей способностью к водородная связь и способность формировать координационные комплексы пожертвовав одинокие пары электронов. Есть некоторые параллели между химией аммиака NH3 и вода H2О. Например, способность обоих соединений протонироваться с образованием NH4+ и H3О+ или депротонирован с образованием NH2− и ОН−, причем все они могут быть выделены в твердые соединения.[24]
Азот разделяет с обоими своими горизонтальными соседями предпочтение образования множественных связей, обычно с углеродом, кислородом или другими атомами азота, через pπ-пπ взаимодействия.[22] Так, например, азот встречается в виде двухатомных молекул и поэтому имеет гораздо более низкую таяние (−210 ° C) и точки кипения (−196 ° C), чем остальная часть его группы, поскольку N2 молекулы удерживаются вместе только слабыми Ван-дер-Ваальсовы взаимодействия и для создания значительных мгновенных диполей доступно очень мало электронов. Это невозможно для его вертикальных соседей; Таким образом оксиды азота, нитриты, нитраты, нитро-, нитрозо-, азо-, и диазо-соединения, азиды, цианаты, тиоцианаты, и имино-производные не обнаруживают эхо с фосфором, мышьяком, сурьмой или висмутом. По той же причине, однако, сложность оксокислот фосфора не отражается на азоте.[22] Если оставить в стороне свои различия, азот и фосфор образуют обширный ряд соединений друг с другом; они имеют структуру цепи, кольца и клетки.[25]
Изотопы

Азот имеет два стабильных изотопы: 14N и 15N. Первый встречается гораздо чаще, он составляет 99,634% природного азота, а второй (который немного тяжелее) составляет оставшиеся 0,366%. Это приводит к атомному весу около 14,007 ед.[19] Оба этих стабильных изотопа производятся в Цикл CNO в звезды, но 14N более распространен, поскольку его нейтронный захват является этапом, ограничивающим скорость. 14N входит в пятерку стабильных нечетно-нечетные нуклиды (нуклид, имеющий нечетное число протонов и нейтронов); остальные четыре 2ЧАС, 6Ли, 10Группа 180 мТа.[26]
Относительное обилие 14N и 15N практически постоянен в атмосфере, но может варьироваться в других местах из-за естественного фракционирования изотопов из биологических редокс реакции и испарение естественных аммиак или же азотная кислота.[27] Биологически опосредованные реакции (например, ассимиляция, нитрификация, и денитрификация) строго контролируют динамику азота в почве. Эти реакции обычно приводят к 15N обогащение субстрат и истощение товар.[28]
Тяжелый изотоп 15N был впервые открыт С. М. Науде в 1929 году, вскоре после того, как тяжелые изотопы соседних элементов кислород и углерод были обнаружены.[29] Он представляет собой одно из самых низких сечений захвата тепловых нейтронов среди всех изотопов.[30] Часто используется в ядерный магнитный резонанс (ЯМР) спектроскопия для определения структуры азотсодержащих молекул из-за его фракционной ядерное вращение половины, что дает преимущества для ЯМР, такие как более узкая ширина линии. 14N, хотя и теоретически пригодный для использования, имеет целочисленный ядерный спин, равный единице, и, следовательно, имеет квадрупольный момент что приводит к более широким и менее полезным спектрам.[19] 15Тем не менее, N ЯМР имеет осложнения, не встречающиеся в более распространенных 1Рука 13Спектроскопия ЯМР 13С. Низкое естественное обилие 15N (0,36%) значительно снижает чувствительность, и эта проблема усугубляется только низким содержанием азота. гиромагнитное отношение, (всего 10,14% 1ЧАС). В результате отношение сигнал / шум для 1H примерно в 300 раз больше, чем для 15N при той же напряженности магнитного поля.[31] Это может быть несколько смягчено изотопным обогащением 15N путем химического обмена или фракционной перегонки. 15N-обогащенные соединения обладают тем преимуществом, что в стандартных условиях они не подвергаются химическому обмену своих атомов азота с атмосферным азотом, в отличие от соединений с меченым водород, изотопы углерода и кислорода, которые необходимо хранить вдали от атмосферы.[19] В 15N:14Отношение N обычно используется в анализе стабильных изотопов в областях геохимия, гидрология, палеоклиматология и палеоокеанография, где это называется δ15N.[32]
Из десяти других изотопов, произведенных синтетическим путем, в диапазоне от 12N к 23N, 13N имеет период полураспада 10 минут, а оставшиеся изотопы имеют период полураспада порядка секунд (16N и 17N) или миллисекунды. Никакие другие изотопы азота невозможны, так как они выпали бы за пределы ядерные капельные линии, просачивая протон или нейтрон.[33] Учитывая разницу в периоде полураспада, 13N является наиболее важным радиоизотопом азота, достаточно долгоживущим, чтобы его можно было использовать в позитронно-эмиссионная томография (ПЭТ), хотя его период полураспада все еще короткий, и поэтому он должен производиться на месте проведения ПЭТ, например, в циклотрон через бомбардировку протонами 16O производство 13N и альфа-частица.[34]
В радиоизотоп 16N - доминирующая радионуклид в охлаждающей жидкости реакторы с водой под давлением или же реакторы с кипящей водой во время нормальной работы, и, таким образом, он является чувствительным и непосредственным индикатором утечек из системы теплоносителя первого контура во вторичный цикл пара и является основным средством обнаружения таких утечек. Производится из 16O (в воде) через (n, p) реакция в которой 16Атом O захватывает нейтрон и выбрасывает протон. Он имеет короткий период полураспада около 7,1 с.[33] но во время его распада обратно в 16O производит высокую энергию гамма-излучение (От 5 до 7 МэВ).[33][35] По этой причине доступ к трубопроводу теплоносителя первого контура в реакторе с водой под давлением должен быть ограничен во время реактор силовая работа.[35]
Химия и соединения
Аллотропы

Атомарный азот, также известный как активный азот, обладает высокой реакционной способностью. трехрадикальный с тремя неспаренными электронами. Свободные атомы азота легко реагируют с большинством элементов с образованием нитридов, и даже когда два свободных атома азота сталкиваются, образуя возбужденный N2 молекулы, они могут выделять столько энергии при столкновении даже с такими стабильными молекулами, как углекислый газ и воды чтобы вызвать гомолитическое деление на радикалы, такие как CO и O или OH и H. Атомарный азот получают путем пропускания электрического разряда через газообразный азот при 0,1–2 мм рт. послесвечение в течение нескольких минут даже после прекращения разряда.[22]
Учитывая высокую реакционную способность атомарного азота, элементарный азот обычно встречается в виде молекулярного азота.2, диазот. Эта молекула бесцветная, без запаха и вкуса. диамагнитный газ при стандартных условиях: плавится при −210 ° C и кипит при −196 ° C.[22] Динитроген обычно не реагирует при комнатной температуре, но, тем не менее, он будет реагировать с литий металл и некоторые переходный металл комплексы. Это связано с его связыванием, которое является уникальным среди двухатомных элементов в стандартных условиях тем, что имеет N≡N тройная связь. Тройные связи имеют короткую длину связи (в данном случае 109,76 пм) и высокую энергию диссоциации (в данном случае 945,41 кДж / моль) и, таким образом, очень прочные, что объясняет химическую инертность диазота.[22]
Есть некоторые теоретические указания на то, что другой азот олигомеры и полимеры могут быть возможны. Если бы их можно было синтезировать, они могли бы найти потенциальное применение в качестве материалов с очень высокой плотностью энергии, которые можно было бы использовать в качестве мощных ракетных топлив или взрывчатых веществ.[36] Это связано с тем, что все они должны разлагаться до диазота, тройная связь которого N≡N (энергия связи 946 кДжмоль−1) намного прочнее, чем у двойной связи N = N (418 кДж · моль−1) или одинарной связи N – N (160 кДж · моль−1): действительно, тройная связь имеет более чем в три раза больше энергии, чем одинарная. (Обратное верно для более тяжелых пниктогенов, которые предпочитают многоатомные аллотропы.)[37] Большой недостаток состоит в том, что не ожидается, что большинство нейтральных полинитрогенов будут иметь большой барьер на пути разложения, и что несколько исключений будет даже сложнее синтезировать, чем давно ожидаемые, но все еще неизвестные. тетраэдран. Это контрастирует с хорошо изученными катионными и анионными полинитрогенами. азид (N−
3), пентазений (N+
5), и пентазолид (циклический ароматический N−
5).[36] Под чрезвычайно высоким давлением (1,1 млн.банкомат) и высоких температур (2000 К), как производятся в ячейка с алмазной наковальней, азот полимеризуется в односвязные кубический гош Кристальная структура. Эта структура аналогична структуре алмаз, и у обоих очень сильные ковалентные связи, в результате чего получил прозвище «азотный алмаз».[38]
В атмосферное давление, молекулярный азот конденсируется (разжижает) в 77K (−195.79 °C) и замерзает при 63 К (−210,01 ° C)[39] в бета шестиугольный плотно упакованный кристалл аллотропный форма. Ниже 35,4 K (-237,6 ° C) азот предполагает кубический кристалл аллотропной формы (так называемая альфа-фаза).[40] Жидкий азот, бесцветная жидкость, внешне напоминающая воду, но имеющая плотность 80,8% (плотность жидкого азота при температуре кипения 0,808 г / мл), является обычным явлением. криоген.[41] Твердый азот имеет множество кристаллических модификаций. Образует значительное динамическое покрытие поверхности на Плутон[42] и внешние луны Солнечной системы, такие как Тритон.[43] Даже при низких температурах твердого азота он довольно летуч и может возвышенный чтобы образовать атмосферу, или снова сконденсироваться в азотный иней. Он очень слабый и течет в виде ледников и на Тритоне. гейзеры газообразного азота поступает из области полярной ледяной шапки.[44]
Диназотные комплексы

Первый пример азотный комплекс было открыто [Ru (NH3)5(N2)]2+ (см. рисунок справа), и вскоре были обнаружены многие другие подобные комплексы. Эти комплексы, в котором молекула азота отдает по крайней мере одну неподеленную пару электронов центральному катиону металла, иллюстрируют, как N2 может прилипнуть к металлу (ам) в нитрогеназа и катализатор для Процесс Габера: эти процессы, включающие активацию диазотом, жизненно важны для биологии и производства удобрений.[45][46]
Dinitrogen может взаимодействовать с металлами пятью разными способами. Наиболее хорошо охарактеризованные способы - это конец на M ← N≡N (η1) и M ← N≡N → M (μ, бис-η1), в котором неподеленные пары на атомах азота отдают катиону металла. Менее хорошо охарактеризованные способы включают использование диназотодонорных электронных пар из тройной связи, либо как мостиковый лиганд к двум катионам металлов (μ, бис-η2) или только одному (η2). Пятый и уникальный метод включает тройную координацию в качестве мостикового лиганда, отдавая все три электронные пары тройной связи (μ3-N2). Некоторые комплексы имеют несколько N2 лиганды и некоторые особенности N2 связаны несколькими способами. Поскольку N2 изоэлектронен с монооксид углерода (CO) и ацетилен (C2ЧАС2) связывание в диазотных комплексах тесно связано со связью в карбонил соединений, хотя N2 слабее σ-донор и π-акцептор, чем CO. Теоретические исследования показывают, что σ пожертвование является более важным фактором, позволяющим образовать связь M – N, чем π обратное пожертвование, которое в основном только ослабляет связь N – N, и конечное (η1) пожертвование осуществляется легче, чем побочное (η2) пожертвование.[22]
Сегодня диазотные комплексы известны практически всем переходные металлы, что составляет несколько сотен соединений. Обычно их готовят тремя способами:[22]
- Замена лабильных лигандов, таких как ЧАС2О, ЧАС−, или же CO непосредственно азотом: это часто обратимые реакции, протекающие в мягких условиях.
- Восстановление комплексов металлов в присутствии подходящего колиганда в избытке в атмосфере азота. Обычный выбор включает замену хлоридных лигандов на диметилфенилфосфин (PMe2Ph), чтобы восполнить меньшее количество присоединенных лигандов азота, чем исходные лиганды хлора.
- Превращение лиганда со связями N – N, такого как гидразин или азид, непосредственно в диазотистый лиганд.
Иногда связь N≡N может образовываться непосредственно внутри металлического комплекса, например, путем прямого взаимодействия координированных аммиак (NH3) с азотистая кислота (HNO2), но это не всегда применимо. Большинство комплексов диазота имеют цвета в диапазоне белый-желтый-оранжевый-красно-коричневый; известно несколько исключений, например синий [{Ti (η5-C5ЧАС5)2}2- (N2)].[22]
Нитриды, азиды и нитридокомплексы
Азот связывается почти со всеми элементами периодической таблицы, кроме первых трех. благородные газы, гелий, неон, и аргон, и некоторые из очень короткоживущих элементов после висмут, создавая огромное количество бинарных соединений с различными свойствами и применениями.[22] Известно много бинарных соединений: за исключением гидридов, оксидов и фторидов азота, их обычно называют нитриды. Многие стехиометрические фазы обычно присутствуют для большинства элементов (например, MnN, Mn6N5, Mn3N2, Mn2N, Mn4N и MnИксN для 9,2 < Икс <25,3). Они могут быть классифицированы как «солеподобные» (в основном ионные), ковалентные, «алмазоподобные» и металлические (или межстраничный), хотя эта классификация имеет ограничения, обычно возникающие из-за непрерывности типов связи, а не из дискретных и отдельных типов, которые она подразумевает. Обычно их получают путем прямой реакции металла с азотом или аммиаком (иногда после нагревания) или путем термического разложения амидов металлов:[47]
- 3 Ca + N2 → Ca3N2
- 3 мг + 2 NH3 → Mg3N2 + 3 часа2 (при 900 ° C)
- 3 Zn (NH2)2 → Zn3N2 + 4 NH3
Возможны многие варианты этих процессов. Наиболее ионными из этих нитридов являются нитриды щелочных металлов и щелочноземельные металлы, Ли3N (Na, K, Rb и Cs не образуют стабильных нитридов по стерическим причинам) и M3N2 (M = Be, Mg, Ca, Sr, Ba). Формально их можно рассматривать как соли N3− анион, хотя разделение зарядов на самом деле не полное даже для этих высоко электроположительных элементов. Однако щелочной металл азиды NaN3 и КН3с линейным N−
3 анион, хорошо известны, как и Sr (N3)2 и Ba (N3)2. Азиды металлов B-подгруппы ( группы 11 через 16) гораздо менее ионны, имеют более сложную структуру и легко взрываются при сотрясении.[47]
Известно много бинарных ковалентных нитридов. Примеры включают циан ((CN)2), пентанитрид трифосфора (П3N5), динитрид дисеры (S2N2), и тетранитрид тетрасеры (S4N4). По существу ковалентный нитрид кремния (Si3N4) и нитрид германия (Ge3N4) также известны: в частности, нитрид кремния был бы перспективным керамика если бы не сложность его работы и спекания. В частности, группа 13 нитриды, большинство из которых перспективны полупроводники, изоэлектронны графиту, алмазу и Карбид кремния и имеют схожие структуры: их связь меняется с ковалентной на частично ионную на металлическую по мере перехода группы. В частности, поскольку звено B – N изоэлектронно по отношению к C – C, а углерод по размеру занимает промежуточное положение между бором и азотом, большая часть органическая химия находит отклик в химии бор – азот, например, в боразин ("неорганический бензол"). Тем не менее, аналогия не точна из-за простоты нуклеофильный атаковать бор из-за недостатка в нем электронов, что невозможно в полностью углеродсодержащем кольце.[47]
Самую большую категорию нитридов составляют межузельные нитриды формул MN, M2N и M4N (хотя переменный состав вполне возможен), где маленькие атомы азота расположены в промежутках в металлической кубической или шестиугольный плотно упакованный решетка. Они непрозрачные, очень твердые и химически инертные, плавятся только при очень высоких температурах (обычно выше 2500 ° C). Они имеют металлический блеск и проводят электричество, как и металлы. Они очень медленно гидролизуются с образованием аммиака или азота.[47]
Нитрид-анион (N3−) самый сильный π донор, известный среди лигандов (второй по силе - O2−). Нитридокомплексы обычно получают термическим разложением азидов или депротонированием аммиака, и они обычно включают концевой {≡N}3− группа. Линейный азид-анион (N−
3), будучи изоэлектронной с оксид азота, углекислый газ, и цианат, образует множество координационных комплексов. Дальнейшая цепочка встречается редко, хотя N4−
4 (изоэлектронный с карбонат и нитрат) известен.[47]
Гидриды

Промышленно, аммиак (NH3) является наиболее важным соединением азота, и его получают в больших количествах, чем любое другое соединение, потому что оно вносит значительный вклад в удовлетворение потребностей в питании наземных организмов, выступая в качестве предшественника пищи и удобрений. Это бесцветный щелочной газ с характерным резким запахом. Наличие водородная связь оказывает очень значительное влияние на аммиак, придавая ему высокие температуры плавления (-78 ° C) и кипения (-33 ° C). В качестве жидкости это очень хороший растворитель с высокой теплотой испарения (что позволяет использовать его в вакуумных колбах), который также имеет низкую вязкость и электропроводность и высокую диэлектрическая постоянная, и менее плотен, чем вода. Однако водородная связь в NH3 слабее, чем в H2O из-за более низкой электроотрицательности азота по сравнению с кислородом и наличия только одной неподеленной пары в NH3 а не два в H2О. Это слабое основание в водном растворе (пKб 4.74); его сопряженная кислота аммоний, NH+
4. Он также может действовать как чрезвычайно слабая кислота, теряя протон с образованием амидного аниона, NH−
2. Таким образом, он подвергается самодиссоциации, подобно воде, с образованием аммония и амида. Аммиак горит на воздухе или в кислороде, хотя и нелегко, с образованием газообразного азота; горит во фторе с зеленовато-желтым пламенем, давая трифторид азота. Реакции с другими неметаллами очень сложны и, как правило, приводят к образованию смеси продуктов. Аммиак реагирует при нагревании с металлами с образованием нитридов.[49]
Известно много других бинарных гидридов азота, но наиболее важными из них являются гидразин (N2ЧАС4) и азид водорода (HN3). Хотя это не гидрид азота, гидроксиламин (NH2OH) аналогичен по свойствам и структуре аммиаку и гидразину. Гидразин - дымящаяся бесцветная жидкость, имеющая запах аммиака. Его физические свойства очень похожи на свойства воды (точка плавления 2,0 ° C, точка кипения 113,5 ° C, плотность 1,00 г / см3). Несмотря на то, что это эндотермическое соединение, оно кинетически стабильно. Он быстро и полностью сгорает на воздухе, очень экзотермически выделяя азот и водяной пар. Это очень полезный и универсальный восстановитель, который является более слабым основанием, чем аммиак.[50] Он также обычно используется в качестве ракетного топлива.[51]
Гидразин обычно получают реакцией аммиака с щелочью. гипохлорит натрия в присутствии желатина или клея:[50]
- NH3 + OCl− → NH2Cl + OH−
- NH2Cl + NH3 → N
2ЧАС+
5 + Cl− (медленный) - N
2ЧАС+
5 + ОН− → N2ЧАС4 + H2О (быстро)
(Атаки гидроксида и аммиака могут быть обращены, таким образом проходя через промежуточный NHCl− вместо этого.) Причина добавления желатина в том, что он удаляет ионы металлов, таких как Cu2+ который катализирует разрушение гидразина путем реакции с монохлорамин (NH2Cl) производить хлорид аммония и азот.[50]
Азид водорода (HN3) был впервые получен в 1890 году окислением водного гидразина азотистой кислотой. Он очень взрывоопасен, и даже разбавленные растворы могут быть опасными. Он имеет неприятный и раздражающий запах и является потенциально смертельным (но не кумулятивным) ядом. Его можно рассматривать как сопряженную кислоту азид-аниона, и он аналогичен аналогу галогеноводородные кислоты.[50]
Галогениды и оксогалогениды
Все четыре простых тригалогенида азота известны. Известно несколько смешанных галогенидов и гидрогалогенидов, но в основном они нестабильны; примеры включают NClF2, NCl2F, NBrF2, NF2ЧАС, NFH2, NCl2ЧАС, и NClH2.[52]
Известно пять фторидов азота. Трифторид азота (NF3, впервые полученный в 1928 году) представляет собой термодинамически стабильный газ без цвета и запаха, который наиболее легко образуется электролиз расплавленного фторид аммония растворен в безводном фтороводород. Нравиться тетрафторид углерода, он совсем не реакционноспособен и стабилен в воде или разбавленных водных кислотах или щелочах. Только при нагревании он действует как фторирующий агент и реагирует с медь, мышьяк, сурьма и висмут при контакте при высоких температурах с образованием тетрафторгидразин (N2F4). Катионы NF+
4 и N
2F+
3 также известны (последние из-за реакции тетрафторгидразина с сильными фторид-акцепторами, такими как пентафторид мышьяка), как и ONF3, который вызвал интерес из-за короткого расстояния N – O, подразумевающего частичную двойную связь, а также высокополярной и длинной связи N – F. Тетрафторгидразин, в отличие от самого гидразина, может диссоциировать при комнатной температуре и выше с образованием радикала NF2•. Азид фтора (FN3) очень взрывоопасен и термически нестабилен. Дифторид азота (N2F2) существует как термически взаимопревращаемый СНГ и транс изомеры, и был впервые обнаружен как продукт термического разложения FN3.[52]
Трихлорид азота (NCl3) представляет собой плотную, летучую и взрывоопасную жидкость, физические свойства которой аналогичны свойствам четыреххлористый углерод, хотя одно отличие состоит в том, что NCl3 легко гидролизуется водой, а CCl4 не является. Впервые он был синтезирован в 1811 г. Пьер Луи Дюлонг, который потерял три пальца и глаз из-за своих взрывных наклонностей. Как разбавленный газ он менее опасен и поэтому используется в промышленности для отбеливания и стерилизации муки. Трибромид азота (NBr3), впервые полученный в 1975 году, представляет собой темно-красное, чувствительное к температуре, летучее твердое вещество, которое взрывоопасно даже при −100 ° C. Трииодид азота (NI3) еще более нестабилен и был получен только в 1990 году. Его аддукт с аммиаком, который был известен ранее, очень чувствителен к удару: его можно вызвать прикосновением пера, смещением воздушных потоков или даже альфа-частицы.[52][53] По этой причине небольшие количества трийодида азота иногда синтезируют в качестве демонстрации для студентов-химиков средней школы или в качестве акта «химической магии».[54] Азид хлора (ClN3) и азид брома (BrN3) чрезвычайно чувствительны и взрывоопасны.[55][56]
Известны две серии оксогалогенидов азота: нитрозилгалогениды (XNO) и нитрилгалогениды (XNO2). Первые - это очень химически активные газы, которые можно получить путем прямого галогенирования закиси азота. Нитрозил фторид (NOF) - бесцветный и сильный фторирующий агент. Нитрозил хлорид (NOCl) ведет себя примерно так же и часто используется в качестве ионизирующего растворителя. Нитрозил бромид (NOBr) красный. Реакции нитрилгалогенидов в основном похожи: нитрилфторид (FNO2) и нитрилхлорид (ClNO2) также являются химически активными газами и сильнодействующими галогенирующими агентами.[52]
Оксиды
Азот образует девять молекулярных оксидов, некоторые из которых были идентифицированы первыми: N2O (оксид азота), НЕТ (оксид азота), N2О3 (триоксид диазота), НЕТ2 (диоксид азота), N2О4 (тетроксид диазота), N2О5 (пятиокись азота), N4O (нитрозилазид),[57] и N (NO2)3 (тринитрамид).[58] Все они термически нестабильны по отношению к разложению на свои элементы. Еще один возможный оксид, который еще не синтезирован, - это оксатетразол (N4О), ароматическое кольцо.[57]
Закись азота (N2O), более известный как веселящий газ, образуется в результате термического разложения расплавленного нитрат аммония при 250 ° С. Это окислительно-восстановительная реакция, поэтому оксид азота и азот также образуются как побочные продукты. Он в основном используется в качестве пропеллента и аэрирующего агента для консервированные взбитые сливки, и ранее обычно использовался как анестетик. Несмотря на внешность, его нельзя считать ангидрид из азотистая кислота (ЧАС2N2О2), потому что эта кислота не образуется при растворении закиси азота в воде. Он довольно инертный (не реагирует с галогенами, щелочными металлами или озон при комнатной температуре, хотя реакционная способность увеличивается при нагревании) и имеет несимметричную структуру N – N – O (N≡N+О−↔−N = N+= O): выше 600 ° C он диссоциирует, разрывая более слабую связь N – O.[57]
Оксид азота (NO) - простейшая стабильная молекула с нечетным числом электронов. У млекопитающих, в том числе человека, это важный клеточный сигнальная молекула участвует во многих физиологических и патологических процессах.[59] Он образуется при каталитическом окислении аммиака. Это бесцветный парамагнитный газ, который, будучи термодинамически нестабильным, разлагается на азот и кислород при 1100–1200 ° C. Его связь аналогична связи в азоте, но один дополнительный электрон добавляется к π* орбиталь антибондинга и, таким образом, порядок скрепления снижен примерно до 2,5; следовательно, димеризация до O = N – N = O неблагоприятна, за исключением температуры ниже точки кипения (где СНГ изомер более стабилен), потому что он фактически не увеличивает общий порядок связи и потому, что неспаренный электрон делокализован по молекуле NO, обеспечивая ее стабильность. Имеются также данные об асимметричном красном димере O = N – O = N, когда оксид азота конденсируется с полярными молекулами. Он реагирует с кислородом с образованием коричневого диоксида азота и с галогенами с образованием нитрозилгалогенидов. Он также реагирует с соединениями переходных металлов с образованием нитрозильных комплексов, большинство из которых имеют глубокую окраску.[57]
Синий триоксид диазота (N2О3) доступен только в твердом виде, потому что он быстро диссоциирует выше своей точки плавления с образованием оксида азота, диоксида азота (NO2) и тетроксид диазота (N2О4). Последние два соединения довольно трудно изучать по отдельности из-за равновесия между ними, хотя иногда тетроксид диазота может реагировать путем гетеролитического деления с образованием нитрозоний и нитрат в среде с высокой диэлектрической проницаемостью. Двуокись азота - это едкий коррозионный газ коричневого цвета. Оба соединения могут быть легко получены разложением сухого нитрата металла. Оба реагируют с водой с образованием азотная кислота. Четырехокись азота очень полезна для получения безводных нитратов металлов и нитратокомплексов, и он стал предпочтительным окислителем для хранения многих ракет как в Соединенных Штатах, так и в США. СССР к концу 1950-х гг. Это потому, что это гиперголический пропеллент в сочетании с гидразин-основан ракетное горючие и его легко хранить, так как он жидкий при комнатной температуре.[57]
Термически нестабильный и очень реактивный пятиокись азота (N2О5) - ангидрид азотная кислота, и его можно получить путем обезвоживания с пятиокись фосфора. Представляет интерес для приготовления взрывчатых веществ.[60] Это расплывающийся, бесцветное кристаллическое вещество, чувствительное к свету. В твердом состоянии он ионный со структурой [NO2]+[НЕТ3]−; как газ, так и в растворе это молекулярный O2НЕТ НЕТ2. Гидратация до азотной кислоты происходит легко, как и аналогичная реакция с пероксид водорода давая пероксоназотная кислота (ХУНО2). Это сильный окислитель. Газообразный пятиокись азота разлагается следующим образом:[57]
- N2О5 ⇌ НЕТ2 + НЕТ3 → НЕТ2 + O2 + НЕТ
- N2О5 + НЕТ ⇌ 3 НЕТ2
Оксокислоты, оксоанионы и соли оксокислот
Много азота оксокислоты известны, хотя большинство из них нестабильны как чистые соединения и известны только как водный раствор или как соли. Азотная кислота (ЧАС2N2О2) - слабая дипротонная кислота со структурой HON = NOH (pKа1 6.9, п.Kа2 11.6). Кислые растворы довольно стабильны, но при pH выше 4 катализируемое основанием разложение происходит через [HONNO]− к закиси азота и аниону гидроксида. Гипонитриты (с участием N
2О2−
2 анион) устойчивы к восстановителям и чаще сами действуют как восстановители. Они представляют собой промежуточную стадию окисления аммиака до нитрита, которое происходит в азотный цикл. Гипонитрит может действовать как мостиковый или хелатирующий бидентатный лиганд.[61]
Азотистая кислота (HNO2) не известен как чистое соединение, но является обычным компонентом в газовых равновесиях и является важным водным реагентом: его водные растворы могут быть получены путем подкисления холодных водных растворов. нитрит (НЕТ−
2, изогнутые) растворов, хотя уже при комнатной температуре диспропорционирование до нитрат и оксид азота имеет большое значение. Это слабая кислота с pKа 3.35 при 18 ° C. Они могут быть титриметрически анализируется их окислением до нитрата перманганат. Они легко восстанавливаются до закиси азота и окиси азота диоксид серы, в азотистую кислоту с банка(II), и до аммиака с сероводород. Соли гидразиний N
2ЧАС+
5 реакция с азотистой кислотой с образованием азидов, которые далее реагируют с образованием закиси азота и азота. Нитрат натрия умеренно токсичен в концентрациях выше 100 мг / кг, но небольшие количества часто используются для консервирования мяса и в качестве консерванта во избежание бактериальной порчи. Он также используется для синтеза гидроксиламина и диазотизации первичных ароматических аминов следующим образом:[61]
- ArNH2 + HNO2 → [ArNN] Cl + 2 H2О
Нитрит также является обычным лиганд который может координироваться пятью способами. Наиболее распространены нитро (связанные с азотом) и нитрито (связанные с кислородом). Нитро-нитрито-изомерия является обычным явлением, когда нитрито-форма обычно менее стабильна.[61]
Азотная кислота (HNO3), безусловно, является наиболее важной и самой стабильной из оксокислот азота. Это одна из трех наиболее часто используемых кислот (две другие - серная кислота и соляная кислота) и впервые был открыт алхимиками в 13 веке. Он производится путем каталитического окисления аммиака до оксида азота, который окисляется до диоксида азота, а затем растворяется в воде с образованием концентрированной азотной кислоты. в Соединенные Штаты Америкиежегодно производится более семи миллионов тонн азотной кислоты, большая часть которой используется для производства нитратов для удобрений и взрывчатых веществ, а также для других целей. Безводная азотная кислота может быть получена путем дистилляции концентрированной азотной кислоты с пятиокиси фосфора при низком давлении в стеклянном аппарате в темноте. Его можно получить только в твердом состоянии, поскольку при плавлении он самопроизвольно разлагается до диоксида азота, а жидкая азотная кислота подвергается самоионизация в большей степени, чем любая другая ковалентная жидкость, а именно:[61]
- 2 HNO3 ⇌ ЧАС
2НЕТ+
3 + НЕТ−
3 ⇌ H2O + [НЕТ2]+ + [НЕТ3]−
Два гидрата, HNO3·ЧАС2O и HNO3· 3H2O, как известно, могут кристаллизоваться. Это сильная кислота, а концентрированные растворы - сильные окислители, хотя золото, платина, родий, и иридий невосприимчивы к атакам. Смесь 3: 1 концентрированной соляной кислоты и азотной кислоты, называемая царская водка, еще сильнее и успешно растворяет золото и платину, поскольку образуются свободный хлор и нитрозилхлорид, а анионы хлора могут образовывать прочные комплексы. В концентрированной серной кислоте азотная кислота протонируется с образованием нитроний, который может действовать как электрофил для ароматического нитрования:[61]
- HNO3 + 2 часа2ТАК4 ⇌ НЕТ+
2 + H3О+ + 2 HSO−
4
Термическая стабильность нитраты (включая тригональную плоскую НЕТ−
3 анион) зависит от основности металла, как и продукты разложения (термолиза), которые могут варьироваться от нитрита (например, натрия) до оксида (калий и вести) или даже сам металл (серебро) в зависимости от их относительной устойчивости. Нитрат также является распространенным лигандом со многими способами координации.[61]
Наконец, хотя ортоназотная кислота (H3НЕТ4), что было бы аналогом ортофосфорная кислота, не существует, тетраэдрический ортонитрат анион НЕТ3−
4 известен своими солями натрия и калия:[61]
Эти белые кристаллические соли очень чувствительны к водяному пару и двуокиси углерода в воздухе:[61]
- Na3НЕТ4 + H2O + CO2 → NaNO3 + NaOH + NaHCO3
Несмотря на свой ограниченный химический состав, ортонитрат-анион интересен со структурной точки зрения из-за его правильной тетраэдрической формы и короткой длины связи N – O, что указывает на значительный полярный характер связи.[61]
Органические соединения азота
Азот - один из важнейших элементов в органическая химия. Многие органические функциональные группы привлечь связь углерод-азот, Такие как амиды (RCONR2), амины (Р3N), имины (RC (= NR) R), имиды (RCO)2NR, азиды (RN3), азосоединения (RN2Р), цианаты и изоцианаты (ROCN или RCNO), нитраты (РОНО2), нитрилы и изонитрилы (RCN или RNC), нитриты (РОНО), нитросоединения (РНО2), нитрозосоединения (РНО), оксимы (RCR = NOH) и пиридин производные. Связи C – N сильно поляризованы в сторону азота. В этих соединениях азот обычно трехвалентный (хотя он может быть четырехвалентным в четвертичные аммониевые соли, Р4N+), с неподеленной парой, которая может придавать основность соединению, координируясь с протоном. Это может быть компенсировано другими факторами: например, амиды не являются основными, потому что неподеленная пара делокализована в двойную связь (хотя они могут действовать как кислоты при очень низком pH, будучи протонированными по кислороду) и пиррол не является кислым, потому что неподеленная пара делокализована как часть ароматный звенеть.[62] Количество азота в химическая субстанция можно определить по Метод Кьельдаля.[63] В частности, азот является важным компонентом нуклеиновые кислоты, аминокислоты и поэтому белки, а молекула-носитель аденозинтрифосфат и поэтому жизненно важен для всей жизни на Земле.[62]
Вхождение
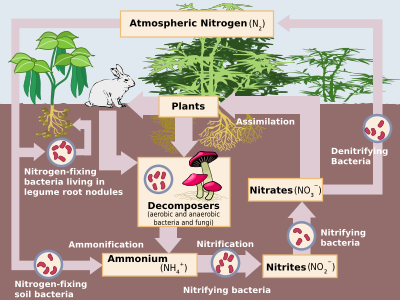
Азот - самый распространенный чистый элемент на Земле, составляющий 78,1% от всего объема атмосфера.[3] Несмотря на это, это не очень много в земной коре, составляя всего 19частей на миллион этого, наравне с ниобий, галлий, и литий. Единственные важные минералы азота: селитра (азотнокислый калий, селитра) и соданитр (нитрат натрия, Чилийская селитра). Однако они не были важным источником нитратов с 1920-х годов, когда промышленный синтез аммиака и азотной кислоты стал обычным явлением.[64]
Соединения азота постоянно обмениваются между атмосферой и живыми организмами. Сначала необходимо обработать азот, или "фиксированный", в пригодную для растений форму, обычно аммиак. Определенная фиксация азота осуществляется ударами молнии, производящими оксиды азота, но большая часть осуществляется диазотрофный бактерии через ферменты, известные как нитрогеназы (хотя сегодня промышленная фиксация азота на аммиак также значительна). Когда аммиак поглощается растениями, он используется для синтеза белков. Затем эти растения перевариваются животными, которые используют азотистые соединения для синтеза собственных белков и выделения азотсодержащих отходов. Наконец, эти организмы умирают и разлагаются, подвергаясь бактериальному окислению и окислению окружающей среды и денитрификация, возвращая свободный диазот в атмосферу. Промышленная азотфиксация Процесс Габера в основном используется в качестве удобрения, хотя избыток азотсодержащих отходов при выщелачивании приводит к эвтрофикация пресной воды и создание морских мертвые зоны, поскольку рост бактерий, вызванный азотом, истощает кислород в воде до такой степени, что все высшие организмы умирают. Кроме того, закись азота, образующаяся при денитрификации, разрушает атмосферный озоновый слой.[64]
Многие морские рыбы производят большое количество оксид триметиламина чтобы защитить их от высоких осмотический влияние окружающей их среды; превращение этого соединения в диметиламин отвечает за появление запаха у непресноводной морской рыбы.[65] У животных свободный радикал оксид азота (получено из аминокислота), служит важной регуляторной молекулой для кровообращения.[66]
Быстрая реакция оксида азота с водой у животных приводит к образованию его метаболита. нитрит. Животное метаболизм азота в белках, как правило, приводит к выделение из мочевина, а метаболизм животных нуклеиновые кислоты приводит к выведению мочевина и мочевая кислота. Характерный запах разложения мяса животных вызван образованием длинноцепочечных азотсодержащих веществ. амины, Такие как путресцин и кадаверин, которые являются продуктами распада аминокислот орнитин и лизинсоответственно в распадающихся белках.[67]
Производство
Газообразный азот - это промышленный газ произведенный фракционная перегонка из жидкий воздух, или механическими средствами с использованием газообразного воздуха (сжатый реверсивный осмосная мембрана или же адсорбция при переменном давлении).Генераторы газообразного азота, использующие мембраны или адсорбцию при переменном давлении (PSA), обычно более экономичны и энергоэффективны, чем азот с объемной доставкой.[68] Технический азот часто является побочным продуктом обработки воздуха при промышленной концентрации кислород для сталеплавильного и других целей. Поставляемый сжатым в баллонах, его часто называют OFN (бескислородный азот).[69] Промышленный азот уже содержит не более 20 частей на миллион кислорода, а специально очищенные сорта содержат не более 2 частей на миллион кислорода и 10 частей на миллион. аргон также доступны.[70]
В химической лаборатории его получают путем обработки водного раствора хлорид аммония с нитрат натрия.[71]
- NH4Cl + NaNO2 → N2 + NaCl + 2 Н2О
Небольшие количества примесей NO и HNO3 также образуются в этой реакции. Примеси можно удалить, пропустив газ через водный раствор серной кислоты, содержащий дихромат калия.[71] Очень чистый азот можно получить путем термического разложения азид бария или же азид натрия.[72]
- 2 NaN3 → 2 Na + 3 N2
Приложения
Газ
Области применения соединений азота, естественно, чрезвычайно разнообразны из-за огромных размеров этого класса: поэтому здесь будут рассматриваться только применения самого чистого азота. Две трети азота, производимого промышленностью, продается в виде газа, а оставшаяся треть - в виде жидкости. Газ в основном используется в качестве инертной атмосферы, когда кислород в воздухе может вызвать пожар, взрыв или окисление. Вот некоторые примеры:[70]
- Как модифицированная атмосфера, чистый или смешанный с углекислый газ, для азотирования и сохранения свежести фасованных или сыпучих продуктов (путем отсрочки прогорклость и другие формы окислительное повреждение). Чистый азот как пищевая добавка указан на Евросоюз с Номер E E941.[73]
- В лампы накаливания как недорогая альтернатива аргон.[74]
- В системы пожаротушения для оборудования информационных технологий (ИТ).[70]
- При изготовлении нержавеющая сталь.[75]
- в цементирование стали азотирование.[76]
- В некоторых авиационных топливных системах для снижения пожарной опасности (см. система инертизации).
- Надуть гоночную машину и самолет шины,[77] уменьшение проблем непостоянного расширения и сжатия, вызванных влажностью и кислород в естественном воздухе.[70]
Азот обычно используется при пробоподготовке в химический анализ. Он используется для концентрирования и уменьшения объема жидких проб. Направление потока газообразного азота под давлением перпендикулярно поверхности жидкости вызывает испарение растворителя, оставляя растворенные вещества и неиспарившийся растворитель.[78]
Азот можно использовать в качестве замены или в сочетании с углекислый газ герметизировать бочонки некоторых пиво, особенно стауты и британский эль, из-за меньшего пузыри производит, что делает розлив пива более гладким и головокружительный.[79] Чувствительная к давлению азотная капсула, известная как "виджет"позволяет упаковывать заряженное азотом пиво в банки и бутылки.[80][81] Резервуары с азотом также заменяют диоксид углерода в качестве основного источника энергии для пейнтбольное оружие. Давление азота должно быть выше, чем давление CO.2, делая N2 танки тяжелее и дороже.[82] Газообразный азот стал предпочтительным инертным газом для удушение инертным газом, и рассматривается как замена летальной инъекции в Оклахома.[83][84] Газообразный азот, образующийся при разложении азид натрия, используется для надувания подушки безопасности.[85]
Поскольку азот удушающий газ, в некоторых юрисдикциях удушение инертным газом путем вдыхания чистого азота в качестве средства смертная казнь (как замена смертельная инъекция).[86] Однако по состоянию на 2020 г.[Обновить], ни одна юрисдикция еще не проводила казней с использованием газообразного азота, и как минимум в одной юрисдикции (Оклахома), который рассматривал удушение азотом как протокол казни, отказался от своих усилий.[87]
Жидкость
Жидкий азот - это криогенная жидкость. При изоляции в надлежащих контейнерах, таких как Сосуды Дьюара, его можно транспортировать без особых затрат потери от испарения.[88]
Нравиться сухой лед, в основном жидкий азот используется в качестве хладагент. Помимо прочего, он используется в криоконсервация крови, репродуктивных клеток (сперма и яйцо), а также другие биологические образцы и материалы. Он используется в клинических условиях в криотерапия для удаления кист и бородавок на коже.[89] Он используется в холодные ловушки для определенного лабораторного оборудования и для охлаждения инфракрасные детекторы или же Детекторы рентгеновского излучения. Он также использовался для охлаждения центральные процессоры и другие устройства в компьютерах, которые разогнанный, которые производят больше тепла, чем при нормальной работе.[90] Другие области применения включают замораживание и механическую обработку материалов, которые являются мягкими или эластичными при комнатной температуре, запрессовку и сборку инженерных компонентов и, в более общем плане, для достижения очень низких температур, когда это необходимо (около -200 ° C). Из-за его низкой стоимости жидкий азот также часто используется, когда такие низкие температуры не являются строго необходимыми, например, при охлаждении продуктов питания, замораживание брендинга скот, замораживание труб, чтобы остановить поток, когда клапаны отсутствуют, и уплотнение нестабильной почвы путем замораживания всякий раз, когда внизу ведутся земляные работы.[70]
Жидкий азот широко используется в вакуумный насос системы.
Безопасность
Газ
Хотя азот нетоксичен, при попадании в замкнутое пространство он может вытеснять кислород и, следовательно, представляет собой удушье опасность. Это может произойти с небольшими предупреждающими симптомами, так как человек сонная артерия это относительно слабая и медленная система восприятия с низким содержанием кислорода (гипоксия).[91] Пример произошел незадолго до запуска первая миссия космического челнока 19 марта 1981 г., когда два техника умерли от удушья, войдя в помещение, расположенное в Мобильная пусковая платформа Space Shuttle в качестве меры предосторожности против пожара он был сжат чистым азотом.[92]
При вдыхании на высокой парциальные давления (более 4 бар, встречаются на глубинах менее 30 м в подводное плавание с аквалангом), азот - анестетик, вызывающий азотный наркоз, временное состояние психического расстройства, подобное оксид азота интоксикация.[93][94]
Азот растворяется в кровь и телесные жиры. Быстрая декомпрессия (например, когда дайверы всплывают слишком быстро или астронавты слишком быстро декомпрессируют от давления в кабине до давления в скафандре) может привести к потенциально смертельному состоянию, которое называется декомпрессионная болезнь (ранее известная как кессонная болезнь или изгибы), когда пузырьки азота образуются в кровотоке, нервах, суставах и других чувствительных или жизненно важных областях.[95][96] Пузырьки других «инертных» газов (газов, отличных от углекислого газа и кислорода) вызывают те же эффекты, поэтому замена азота в дышащие газы может предотвратить азотный наркоз, но не предотвращает декомпрессионную болезнь.[97]
Жидкость
Как криогенный жидкий жидкий азот может быть опасен, вызывая холодные ожоги при контакте, хотя Эффект Лейденфроста обеспечивает защиту при очень коротком воздействии (около одной секунды).[98] Проглатывание жидкого азота может вызвать серьезные внутренние повреждения. Например, в 2012 году молодой женщине из Англии пришлось удалить живот после того, как она проглотила коктейль, приготовленный на жидком азоте.[99]
Потому что жидкость-газ степень расширения азота составляет 1: 694 при 20 ° C, огромное количество силы может быть создано, если жидкий азот быстро испаряется в замкнутом пространстве. Во время инцидента 12 января 2006 г. в г. Техасский университет A&M, устройства сброса давления резервуара с жидким азотом вышли из строя и позднее были закрыты. В результате последующего повышения давления резервуар катастрофически вышел из строя. Сила взрыва была достаточной, чтобы протолкнуть резервуар через потолок непосредственно над ним, разбить железобетонную балку непосредственно под ним и оторвать стены лаборатории на 0,1–0,2 м от фундамента.[100]
Жидкий азот легко испаряется с образованием газообразного азота, и поэтому меры предосторожности, связанные с газообразным азотом, также применимы к жидкому азоту.[101][102][103] Например, кислородные датчики иногда используются в качестве меры предосторожности при работе с жидким азотом, чтобы предупредить рабочих о разливе газа в замкнутом пространстве.[104]
Сосуды, содержащие жидкий азот, могут конденсировать кислород из воздуха. Жидкость в таком сосуде становится все более обогащенной кислородом (точка кипения -183 ° C, выше, чем у азота) по мере испарения азота, что может вызвать сильное окисление органического материала.[105]
Мониторы кислородного голодания
Мониторы дефицита кислорода используются для измерения уровня кислорода в замкнутых пространствах и в любом месте, где хранится или используется газообразный или жидкий азот. В случае утечки азота и снижения содержания кислорода до предварительно установленного уровня сигнала тревоги монитор дефицита кислорода может быть запрограммирован на включение звуковой и визуальной сигнализации, тем самым обеспечивая уведомление о возможной надвигающейся опасности. Чаще всего диапазон кислорода для предупреждения персонала - это когда уровень кислорода становится ниже 19,5%. OSHA указывает, что опасная атмосфера может включать атмосферу, в которой концентрация кислорода ниже 19,5% или выше 23,5%.[106]Мониторы дефицита кислорода могут быть закреплены, прикреплены к стене и подключены к электросети здания, либо просто подключены к розетке, либо к портативному ручному или носимому монитору.
Смотрите также
Рекомендации
- ^ «Газы - Плотность». Набор инструментов для проектирования. Получено 27 января 2019.
- ^ Общие энергии связи (D) и длины связи (r). wiredchemist.com
- ^ а б c Гринвуд и Эрншоу, стр. 406–07.
- ^ Резерфорд, Дэниел (1772 г.) "Dissertatio Inauguralis de aere fixo, aut mephitico"(Первая диссертация по воздуху, [называемому] фиксированным или мефитическим), докторская диссертация, Эдинбургский университет, Шотландия. Английский перевод: Доббин, Леонард (1935). «Инаугурационная диссертация Дэниела Резерфорда». Журнал химического образования. 12 (8): 370–75. Bibcode:1935JChEd..12..370D. Дои:10.1021 / ed012p370.
- ^ Недели, Мэри Эльвира (1932). «Открытие элементов. IV. Три важных газа». Журнал химического образования. 9 (2): 215. Bibcode:1932JChEd ... 9..215W. Дои:10.1021 / ed009p215.
- ^ Аарон Дж. Идэ, Развитие современной химии, Нью-Йорк, 1964.
- ^ Карл Вильгельм Шееле, Chemische Abhandlung von der Luft und dem Feuer [Химический трактат о воздухе и огне] (Упсала, Швеция: Magnus Swederus, 1777; и Лейпциг (Германия): Siegfried Lebrecht Crusius, 1777). В разделе «Die Luft muß aus elastischen Flüßigkeiten von zweyerley Art, zusammengesetzet seyn». (Воздух должен состоять из упругих жидкостей двух видов), стр. 6–14, Шееле представляет результаты восьми экспериментов, в которых воздух реагировал с различными веществами. Он заключил (п. 13): "So viel sehe ich aus angeführten Versuchen, daß die Luft aus 2 von einander unterschiedenen Flußigkeiten bestehe, von welchen die eine die Eigenschaft das Phlogiston anzuziehen gar nicht äussere, die andere aber zur solgetis are well 3 4: ten Theil von der ganzen Luftmasse aus machet ». (Итак, я вижу [это] многое из проведенных [которые] экспериментов: воздух состоит из двух жидкостей, [которые] отличаются друг от друга, из которых одна совсем не проявляет свойства притягивать флогистон, а другая однако способен на такое притяжение и составляет от 1/3 до 1/4 части всей массы воздуха.)
- ^ Пристли, Джозеф (1772). «Наблюдения за разными видами воздуха». Философские труды Лондонского королевского общества. 62: 147–256. Дои:10.1098 / рстл.1772.0021. S2CID 186210131. ; см. стр. 225.
- ^ Пристли, Джозеф (1772). «Наблюдения за разными видами воздуха». Философские труды Лондонского королевского общества. 62: 147–256. Дои:10.1098 / рстл.1772.0021. S2CID 186210131. ; видеть: «VII. Воздуха, зараженного дымом горящего угля». С. 225–28.
- ^ Лавуазье, Антуан с Робертом Керром, пер., Элементы химии, 4-е изд. (Эдинбург, Шотландия: Уильям Крич, 1799), стр. 85–86. [п. 85]: «Размышляя над обстоятельствами этого эксперимента, мы легко понимаем, что ртуть во время прокаливания [т. Е. Обжига на воздухе] поглощает целительную и пригодную для дыхания часть воздуха, или, говоря более строго, основу этого респирабельная часть; что оставшийся воздух является разновидностью мефита [т. е. ядовитым газом, исходящим из земли], неспособным поддерживать горение или дыхание;… " [п. 86]: «Позже я покажу, что, по крайней мере, в нашем климате атмосферный воздух состоит из пригодных для дыхания и ядовитых газов в пропорции 27 и 73…»
- ^ Лавуазье, Антуан с Робертом Керром, пер., Элементы химии, 4-е изд. (Эдинбург, Шотландия: Уильям Крич, 1799 г.), п. 101: «Химические свойства вредной части атмосферного воздуха, которые до сих пор были малоизвестны, мы были удовлетворены тем, что получили название его базы от известного свойства убивать животных, которые вынуждены дышать ею, и дали ей название азот, от греческой первичной частицы α и ξωη, вита; отсюда и название вредной части атмосферного воздуха азотный газ."
- ^ Чапталь, Дж. А. и Николсон, Уильям пер. (1800) Элементы химии, 3-е изд. Лондон, Англия: C.C. and J. Robinson, vol. 1. стр. xxxv – xxxvi: "Чтобы исправить Номенклатуру на этом заголовке [т. Е. В этом отношении], ничего больше не требуется, кроме как заменить [то есть] это слово обозначением, которое происходит из общей системы, используемой; и я предположил чтобы предложить суть азотного газа. Во-первых, это выводится из характерных и исключительных свойств этого газа, который образует радикал азотной кислоты. Таким образом, мы сохраним комбинации [то есть соединения] этого газа. сущность полученных [то есть преобладающих] наименований, таких как азотная кислота, нитраты, нитриты и т. д. "
- ^ азот. Etymonline.com. Проверено 26 октября 2011.
- ^ Стратт, Р. Дж. (1911) «Бейкерская лекция. Химически активная модификация азота, полученная с помощью электрического разряда». Труды Королевского общества А, 85 (577): 219–29.
- ^ Активный азот лорда Рэлея В архиве 2012-11-01 в Wayback Machine. Lateralscience.co.uk. Проверено 26 октября 2011.
- ^ Эрисман, Ян Виллем; Саттон, Марк А .; Галлоуэй, Джеймс; Климонт, Збигнев; Винивартер, Уилфрид (2008). «Как столетие синтеза аммиака изменило мир». Природа Геонауки. 1 (10): 636. Bibcode:2008NatGe ... 1..636E. Дои:10.1038 / ngeo325.
- ^ ГБ, "Усовершенствования в производстве азотной кислоты и оксидов азота", выпущено 20 марта 1902 г.
- ^ ГБ, "Усовершенствования в производстве азотной кислоты и оксидов азота и связанные с ним", выпущено 26 февраля 1903 г.
- ^ а б c d е Гринвуд и Эрншоу, стр. 411–12.
- ^ Гринвуд и Эрншоу, стр. 550
- ^ Каупп, Мартин (1 декабря 2006 г.). «Роль радиальных узлов атомных орбиталей для химической связи и периодической таблицы» (PDF). Журнал вычислительной химии. 28 (1): 320–25. Дои:10.1002 / jcc.20522. PMID 17143872. S2CID 12677737. Получено 7 февраля 2018.
- ^ а б c d е ж грамм час я j Гринвуд и Эрншоу, стр. 412–16.
- ^ Miller, T. S .; Белен, А .; Suter, T. M .; Sella, A .; Corà, A .; Макмиллан, П. Ф. (2017). «Нитриды углерода: синтез и характеристика нового класса функциональных материалов». Физическая химия Химическая физика. 19 (24): 15613–15638. Bibcode:2017PCCP ... 1915613M. Дои:10.1039 / C7CP02711G. PMID 28594419.
- ^ House, J. E .; Дом, К. А. (2016). Описательная неорганическая химия. Амстердам: Эльзевир. п. 198. ISBN 978-0-12-804697-5.
- ^ Рой, А. К .; Бернс, Г. Т .; Григора, С .; Ли, Г. К. (1994). "Поли (алкил / арилоксотиазены), [N = S (O) R]п : Новое направление в неорганических полимерах ». In Wisian-Neilson, P .; Alcock, H.R .; Wynne, K.J. (ред.). Неорганические и металлоорганические полимеры II: современные материалы и промежуточные продукты. Американское химическое общество. С. 344–357. Дои:10.1021 / bk-1994-0572.ch026.
- ^ Бете, Х.А. (1939). «Производство энергии в звездах». Физический обзор. 55 (5): 434–56. Bibcode:1939ПхРв ... 55..434Б. Дои:10.1103 / PhysRev.55.434. PMID 17835673.
- ^ CIAAW (2003). «Атомный вес азота». ciaaw.org. CIAAW. Получено 13 октября 2016.
- ^ Фланаган, Лоуренс Б .; Ehleringer, James R .; Патаки, Дайан Э. (15 декабря 2004 г.). Стабильные изотопы и взаимодействия биосферы и атмосферы: процессы и биологический контроль. С. 74–75. ISBN 978-0-08-052528-0.
- ^ Гринвуд и Эрншоу, стр. 408
- ^ "Получение и построение оценочного файла ядерных данных (ENDF)". Национальный центр ядерных данных.
- ^ Артур Г. Палмер (2007). ЯМР-спектроскопия белков. Elsevier Academic Press. ISBN 978-0-12-164491-8.
- ^ Каценберг, М.А. (2008). «Глава 13: Анализ стабильных изотопов: инструмент для изучения прошлой диеты, демографии и истории жизни». Биологическая антропология скелета человека (2-е изд.). ISBN 978-0-471-79372-4.
- ^ а б c Ауди, Жорж; Берсильон, Оливье; Blachot, Жан; Вапстра, Алдерт Хендрик (2003), "ТогдаUBASE оценка ядерных и распадных свойств », Ядерная физика A, 729: 3–128, Bibcode:2003НуФА.729 .... 3А, Дои:10.1016 / j.nuclphysa.2003.11.001
- ^ Карлсон, Нил (22 января 2012 г.). Физиология поведения. Методы и стратегии исследования. 11-е издание. Пирсон. п. 151. ISBN 978-0-205-23939-9.
- ^ а б Neeb, Карл Хайнц (1997). Радиохимия атомных станций с легководными реакторами. Берлин-Нью-Йорк: Вальтер де Грюйтер. п. 227. ISBN 978-3-11-013242-7.
- ^ а б Льюарс, Эррол Г. (2008). Моделирование чудес: вычислительное ожидание новых молекул. Springer Science + Business Media. С. 141–63. Дои:10.1007/978-1-4020-6973 (неактивно 13.10.2020). ISBN 978-1-4020-6972-7.CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (связь)
- ^ Гринвуд и Эрншоу, стр. 483
- ^ «Азот полимерный синтезированный». Physorg.com. 5 августа 2004 г.. Получено 2009-06-22.
- ^ Грей, Теодор (2009). Элементы: визуальное исследование каждого известного атома во Вселенной. Нью-Йорк: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- ^ Schuch, A. F .; Миллс, Р. Л. (1970). «Кристаллические структуры трех модификаций азота 14 и азота 15 при высоком давлении». Журнал химической физики. 52 (12): 6000–08. Bibcode:1970ЖЧФ..52.6000С. Дои:10.1063/1.1672899.
- ^ Iancu, C.V .; Wright, E. R .; Heymann, J. B .; Дженсен, Дж. Дж. (2006). «Сравнение жидкого азота и жидкого гелия как криогенов для электронной криотомографии». Журнал структурной биологии. 153 (3): 231–40. Дои:10.1016 / j.jsb.2005.12.004. PMID 16427786.
- ^ «Ледяные ледники с потоком азота, видимые на поверхности Плутона после пролета New Horizons». ABC. 25 июля 2015 г.. Получено 6 октября 2015.
- ^ Маккиннон, Уильям Б .; Кирк, Рэндольф Л. (2014). «Тритон». В Спон, Тилман; Брейер, Дорис; Джонсон, Торренс (ред.). Энциклопедия Солнечной системы (3-е изд.). Амстердам; Бостон: Эльзевир. С. 861–82. ISBN 978-0-12-416034-7.
- ^ «Нептун: Луны: Тритон». НАСА. Архивировано из оригинал 15 октября 2011 г.. Получено 21 сентября, 2007.
- ^ Фрайзук М. Д. и Джонсон С. А. (2000). «Продолжение истории об активации диазотом». Обзоры координационной химии. 200–202: 379. Дои:10.1016 / S0010-8545 (00) 00264-2.
- ^ Шрок, Р. (2005). «Каталитическое восстановление диазота до аммиака на единственном молибденовом центре». Соотв. Chem. Res. 38 (12): 955–62. Дои:10.1021 / ar0501121. ЧВК 2551323. PMID 16359167.
- ^ а б c d е Гринвуд и Эрншоу, стр. 417–20.
- ^ Гринвуд и Эрншоу, стр. 434–38.
- ^ Гринвуд и Эрншоу, стр. 420–26.
- ^ а б c d Гринвуд и Эрншоу, стр. 426–33.
- ^ Vieira, R .; К. Фам-Хуу; Н. Келлер; М. Ж. Леду (2002). «Новый композит углеродного нановолокна / графитового войлока для использования в качестве носителя катализатора для каталитического разложения гидразина». Химические коммуникации (9): 954–55. Дои:10.1039 / b202032g. PMID 12123065.
- ^ а б c d Гринвуд и Эрншоу, стр. 438–42.
- ^ Боуден, Ф. П. (1958). «Инициирование взрыва нейтронами, α-частицами и продуктами деления». Труды Лондонского королевского общества A. 246 (1245): 216–19. Bibcode:1958RSPSA.246..216B. Дои:10.1098 / rspa.1958.0123. S2CID 137728239.
- ^ Ford, L.A .; Грундмайер, Э. В. (1993). Химическая магия. Дувр. п.76. ISBN 978-0-486-67628-9.
- ^ Fierson, W. J .; Kronrad, J .; Браун, А. В. (1943). "Азид хлора, ClN3. Я". Журнал Американского химического общества. 65 (9): 1696–1698. Дои:10.1021 / ja01249a012.
- ^ Lyhs, Бенджамин; Блазер, Дитер; Вельпер, Кристоф; Шульц, Стефан; Янсен, Георг (20 февраля 2012 г.). «Твердотельная структура азида брома». Angewandte Chemie International Edition. 51 (8): 1970–1974. Дои:10.1002 / anie.201108092. PMID 22250068.
- ^ а б c d е ж Гринвуд и Эрншоу, стр. 443–58.
- ^ Рам, Мартин; Двинских, Сергей В .; Фуро, Иштван; Бринк, Тор (23 декабря 2010 г.). "Экспериментальное обнаружение тринитрамида, N (NO2)3". Angewandte Chemie International Edition. 50 (5): 1145–48. Дои:10.1002 / anie.201007047. PMID 21268214.
- ^ Hou, Y. C .; Янчук, А .; Ван, П. Г. (1999). «Современные тенденции развития доноров оксида азота». Текущий фармацевтический дизайн. 5 (6): 417–41. PMID 10390607.
- ^ Talawar, M. B .; и другие. (2005). "Создание технологического процесса для производства пятиокиси диазота и ее использования для синтеза самого мощного взрывчатого вещества на сегодняшний день - CL-20". Журнал опасных материалов. 124 (1–3): 153–64. Дои:10.1016 / j.jhazmat.2005.04.021. PMID 15979786.
- ^ а б c d е ж грамм час я Гринвуд и Эрншоу, стр. 459–72.
- ^ а б Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Редеи, Джордж П. (2008). «Метод Кьельдаля». Энциклопедия генетики, геномики, протеомики и информатики. п. 1063. Дои:10.1007/978-1-4020-6754-9_9066. ISBN 978-1-4020-6753-2.
- ^ а б Гринвуд и Эрншоу, стр. 407–09.
- ^ Nielsen, M. K .; Йоргенсен, Б. М. (июнь 2004 г.). «Количественная взаимосвязь между активностью триметиламиноксида альдолазы и накоплением формальдегида в белых мышцах рыбы безубыточной во время хранения в замороженном виде». Журнал сельскохозяйственной и пищевой химии. 52 (12): 3814–22. Дои:10.1021 / jf035169l. PMID 15186102.
- ^ Нокс, Г. А. (2007). Биология Южного океана. CRC Press. п. 392. ISBN 978-0-8493-3394-1.
- ^ Викерстафф Джонеха; Дженис М. (2004). Пищеварение, диета и болезни: синдром раздраженного кишечника и желудочно-кишечная функция. Издательство Университета Рутгерса. п. 121. ISBN 978-0-8135-3387-2.
- ^ Froehlich, Питер (май 2013 г.). «Устойчивый подход к поставке азота». www.parker.com. Корпорация Паркер Ханнифин. Получено 24 ноября 2016.
- ^ Райх, Мюррей; Капенекас, Гарри (1957). «Очистка азота. Опытная установка по удалению кислорода». Промышленная и инженерная химия. 49 (5): 869–73. Дои:10.1021 / ie50569a032.
- ^ а б c d е Гринвуд и Эрншоу, стр. 409–11.
- ^ а б Бартлетт, Дж. К. (1967). «Анализ нитрита путем выделения азота: лабораторный эксперимент по общей химии». Журнал химического образования. 44 (8): 475. Bibcode:1967JChEd..44..475B. Дои:10.1021 / ed044p475.
- ^ Еремец, М. И .; Попов, М.Ю .; Trojan, I.A .; Денисов, В. Н .; Boehler, R .; Хемли, Р. Дж. (2004). «Полимеризация азота в азиде натрия». Журнал химической физики. 120 (22): 10618–23. Bibcode:2004ЖЧФ.12010618Э. Дои:10.1063/1.1718250. PMID 15268087.
- ^ Министры, Северный совет (2002 г.). Пищевые добавки в Европе 2000. п. 591. ISBN 978-92-893-0829-8.
- ^ Хардинг, Чарли, изд. (2002). Элементы блока p. Кембридж: Королевское химическое общество. ISBN 978-0-85404-690-4.
- ^ Гаврилюк В.Г .; Бернс, Ганс (1999). Стали с высоким содержанием азота: структура, свойства, производство, применение. Springer. ISBN 978-3-540-66411-6.
- ^ Meka, S. R .; Chauhan, A .; Steiner, T .; Bischoff, E .; Ghosh, P.K .; Миттемейер, Э. Дж. (2015). «Создание дуплексных микроструктур путем азотирования; азотирование сплава Fe – Mn на основе железа». Материаловедение и технологии: 1743284715Y.000. Дои:10.1179 / 1743284715Y.0000000098.
- ^ «Почему они не используют нормальный воздух в шинах гоночных автомобилей?». Как это работает. 2001-03-16. Получено 2006-07-22.
- ^ Кеммочи, Y; Цуцуми, К .; Arikawa, A .; Накадзава, Х. (2002). «Центробежный концентратор для замещения микроконцентрации продувки азота при пробоподготовке диоксина / полихлорированного бифенила». Журнал хроматографии А. 943 (2): 295–97. Дои:10.1016 / S0021-9673 (01) 01466-2. PMID 11833649.
- ^ Бакстер, Э. Дениз; Хьюз, Пол С. (2001). Пиво: аспекты качества, безопасности и пищевой ценности. Королевское химическое общество. п. 22. ISBN 978-0-85404-588-4.
- ^ "Как может работать виджет в пиве?". Как это работает. 2000-08-16.
- ^ Денни, Марк (1 ноября 2009 г.). Пена !: наука о пиве. п. 131. ISBN 978-0-8018-9569-2.
- ^ Кеннетт, Эндрю Дж. (2008). Разработка системы переключения с пневматическим приводом для гоночных приложений Formula SAE® (Тезис). Отделение машиностроения Массачусетского технологического института. HDL:1721.1/45820.
- ^ Санберн, Джош (10 апреля 2015 г.). «Рассвет новой формы смертной казни». Время. Получено 2015-04-11.
- ^ Секстон, Майк (18 декабря 2012 г.). «Сторонник эвтаназии под пристальным вниманием». ABC. Получено 6 мая 2013.
- ^ Беттертон, Э. А. (2003). «Экологическая судьба азида натрия, полученного из автомобильных подушек безопасности». Критические обзоры в области науки об окружающей среде и технологий. 33 (4): 423–58. Дои:10.1080/10643380390245002. S2CID 96404307.
- ^ Берман, Марк (17 апреля 2015 г.). «Оклахома заявляет, что теперь будет использовать газообразный азот в качестве резервного метода исполнения». Вашингтон Пост. Получено 22 июня, 2019.
- ^ «Генеральный прокурор Оклахомы говорит, что штат возобновит казни». New York Post. Получено 22 марта, 2020.
- ^ Каганер, М. Г .; Кожеуров В., Левина Ж. Л. (1967). «Сосуды для хранения и транспортировки жидкого кислорода и азота». Химическая и нефтяная инженерия. 3 (12): 918–22. Дои:10.1007 / BF01136404. S2CID 96762552.
- ^ Ахмед I; Agarwal S; Ильчишин А; Чарльз-Холмс S; Берт-Джонс Дж (май 2001 г.). «Криотерапия жидким азотом обычных бородавок: крио-спрей vs. ватный тампон». Br. J. Dermatol. 144 (5): 1006–09. Дои:10.1046 / j.1365-2133.2001.04190.x. PMID 11359389. S2CID 221325640.
- ^ Кент, Аллен; Уильямс, Джеймс Г. (1994). Энциклопедия компьютерных наук и технологий. 30. CRC Press. п. 318. ISBN 978-0-8247-2283-8.
- ^ «Биологическая безопасность - криогенные материалы. Риски, которые они представляют». Университет Бата. Архивировано из оригинал 6 февраля 2007 г.. Получено 2007-01-03.
- ^ "Space Shuttle Columbia Fast Facts". CNN. 30 сентября 2013 г.
- ^ Fowler, B .; Ackles, K. N .; Порлье, Г. (1985). «Влияние наркоза инертным газом на поведение - критический обзор». Подводный биомед. Res. 12 (4): 369–402. PMID 4082343. Архивировано из оригинал на 2010-12-25. Получено 2008-09-21.
- ^ Rogers, W. H .; Мёллер, Г. (1989). «Влияние кратковременного многократного гипербарического воздействия на предрасположенность к азотному наркозу». Подводный биомед. Res. 16 (3): 227–32. OCLC 2068005. PMID 2741255. Архивировано из оригинал на 2009-09-01. Получено 2008-09-21.
- ^ Акотт, К. (1999). «Краткая история дайвинга и декомпрессионной болезни». Журнал Южнотихоокеанского общества подводной медицины. 29 (2). OCLC 16986801. Получено 2008-09-21.
- ^ Kindwall, E.P .; Baz, A .; Лайтфут, Э. Н .; Lanphier, E.H .; Сейрег, А. (1975). «Удаление азота у человека при декомпрессии». Подводный биомед. Res. 2 (4): 285–97. OCLC 2068005. PMID 1226586. Архивировано из оригинал на 2011-07-27. Получено 2008-09-21.
- ^ Руководство по дайвингу ВМС США, 6-е издание. США: Командование военно-морских систем США. 2006 г.. Получено 2008-04-24.
- ^ Уокер, Джерл. «Кипение и эффект Лейденфроста» (PDF). Основы физики: 1–4. Получено 11 октября 2014.
- ^ Коктейль с жидким азотом оставил подростка в больнице, Новости BBC, 8 октября 2012 г..
- ^ Маттокс, Брент С. «Отчет о расследовании химического взрыва цилиндра 301A» (PDF). Техасский университет A&M. Архивировано из оригинал (перепечатка) на 2014-04-30.
- ^ Британская ассоциация сжатых газов (2000) Свод правил BCGA CP30. Безопасное использование сосудов Дьюара с жидким азотом до 50 литров. В архиве 2007-07-18 на Wayback Machine ISSN 0260-4809.
- ^ Вход в замкнутое пространство - рабочий и потенциальный спасатель задохнулись В архиве 2015-09-22 на Wayback Machine, Пример случая удушья на нефтеперерабатывающем заводе Валеро.
- ^ Расследование после смерти человека в результате утечки химикатов, Новости BBC, 25 октября 1999 г..
- ^ Жидкий азот - Правила обращения. Великобритания: Биркбек, Лондонский университет. 2007 г.. Получено 2012-02-08.
- ^ Леви, Кристофер Г. «Безопасность жидкого азота». Инженерная школа Тайера в Дартмуте.
- ^ Национальные институты здоровья. Протокол использования и обслуживания устройств для мониторинга кислорода. Февраль 2014 г., 1:35 UTC. Доступны на: https://www.ors.od.nih.gov/sr/dohs/documents/protocoloxygenmonitoring.pdf. Доступ 23 июня 2020 г.
Библиография
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
внешняя ссылка
- Этимология азота
- Азот в Периодическая таблица видео (Ноттингемский университет)
- Подкаст по азоту от Королевского химического общества Мир химии







![{displaystyle {ce {NaNO3 {} + Na2O -> [{ce {Ag ~ тигель}}] [{ce {300 ^ {circ} C ~ в течение ~ 7 дней}}] Na3NO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec729bc88f520e08fdce8a013dec8ae601d28509)


