WikiDer > Культура малярии
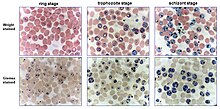
Культура малярии это метод роста малярия паразиты вне тела, т.е. в ex vivo среда. Хотя попытки распространения паразитов за пределами людей или животных моделей начались еще в 1912 году,[2] успех первоначальных попыток ограничивался одним или несколькими циклами. Первая успешная непрерывная культура была создана в 1976 году.[3] Первоначальные надежды на то, что ex vivo культура быстро приведет к открытию вакцина были преждевременными. Однако разработка новых наркотики было значительно облегчено.[4]
Метод
Зараженный человек красные кровяные тельца инкубируют в культуральной чашке или колбе при 37 ° C вместе с питательное вещество средний и плазма, сыворотка или заменители сыворотки.[5] Особенностью инкубации является специальная газовая смесь, наполненная азотом (90-92%) CO.2 (5%) и кислород (3-5%), позволяющий паразитам расти при 37 ° C в клеточный инкубатор.[6] Альтернативой газированию культур точной газовой смесью является использование подсвечника. Подсвечник представляет собой герметичную емкость, в которой культуры и освещенный свеча расположены. Горящая свеча потребляет часть кислорода и производит углекислый газ (CO2), который действует как огнетушитель. Содержание углекислого газа в свежем воздухе колеблется от 0,036% до 0,039%. Когда-то CO2 концентрация достигает примерно 5%, свеча перестает гореть. Количество паразитов увеличивалось в 5 раз примерно каждые 48 часов (один цикл). В паразитемия можно определить через мазок крови, чтобы сохранить его в желаемых пределах, культуру можно разбавить здоровыми эритроцитами.[7]

Оригинальный метод для успешного ex vivo распространение P. falciparum описали культуру паразита в статических условиях (метод Трагера-Йенсена).[3] Джеймс Б. Дженсен присоединился к лаборатории Трагера в качестве Сотрудник докторантуры в 1976 году. Он решил использовать подсвечник вместо СО.2 инкубатор. Летом 1976 года Милтон Фридман, аспирант лаборатории Трагера, работал в лабораториях MRC в г. Гамбия, организовал образец крови человека, зараженной P. falciparum для отправки в Нью-Йорк. Это было разбавлено RPMI 1640 (который оказался лучшим из коммерческих СМИ) в чашки Петри, помещают в подсвечник и инкубируют. Линия росла очень хорошо и стала FCR-3 / Gambia, одним из наиболее широко используемых сортов. Позже будут созданы другие линии с использованием аналогичных методов и влияния непрерывного выращивания P. falciparum был феноменальным, особенно для тестирования предполагаемых противомалярийных препаратов и для расшифровки его генов. Ряд последующих отчетов (еще в начале 1980-х годов) показал, что суспензия клеток (с использованием встряхивания -инкубатор) значительно увеличил рост культуры. Было также показано, что непрерывное перемешивание улучшает другие параметры роста культур, важные для исследователей, такие как продление синхронности культур после процедур синхронизации и снижение частоты множественных инфекций.[9] Несмотря на это, практика культивирования паразита в статических условиях остается широко распространенной. Наибольшая ценность метода подсвечника в том, что его можно использовать в лабораториях практически в любой точке мира, где есть инкубатор, свеча и эксикатор.[10] Около 60% паразитированных клеток можно получить при оптимальных условиях культивирования.[1] Недавние исследования P. falciparum изолированные непосредственно от инфицированных пациентов, указывают на то, что у естественного хозяина возникают альтернативные биологические состояния паразитов, которые не наблюдаются с ex vivo культурные паразиты.[11]
Концентрация инфицированных клеток
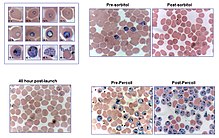
Для достижения синхронизации и / или концентрации паразитов в культуре было разработано несколько методов. Прерывистый Percoll градиент Процедура может быть использована для выделения инфицированных эритроцитов, поскольку эритроциты, содержащие плазмодии, менее плотны, чем нормальные. Молодой трофозоиты совпадали с эритроцитами в широкой полосе, соответствующей плотности от 1,075 до 1,100 г / мл, тогда как шизонты были сконцентрированы с плотностью около 1,062 г / мл.[14] Однако есть исследования, которые предполагают, что некоторые штаммы P.falciparum пострадали от воздействия этого химического вещества. Разница между диамагнитный низкоспиновый оксигемоглобин в неинфицированных эритроцитах и парамагнитный гемозоин в инфицированных эритроцитах также можно использовать для выделения. Магнитные колонки менее вредны для паразитов, просты и приспособлены к потребностям исследователя.[15][16] Колонка устанавливается в мощный магнитодержатель, и культура протекает через него. Колонка улавливает эритроциты, инфицированные последними стадиями паразитов, которые затем могут быть элюированы при снятии колонки с магнита. Это простой метод, не требующий дорогостоящего оборудования, и, похоже, он не влияет на паразитов с точки зрения их способности вторжения впоследствии.[12]
Рекомендации
- ^ а б c Радфар А., Мендес Д., Монерис С., Линарес М., Марин-Гарсия П., Пуйет А., Диез А., Баутиста Дж. М. (2009). «Синхронная культура Plasmodium falciparum при высоких уровнях паразитемии». Nat. Protoc. 4 (11): 1899–915. Дои:10.1038 / nprot.2009.198. PMID 20010926.
- ^ Бас CC, Джонс FM. (1912). "Выращивание малярийных плазмодиев (Plasmodium vivax и Plasmodium Falciparum)" in vitro". J. Exp. Med. 16 (4): 567–579. Дои:10.1084 / jem.16.4.567. ЧВК 2124976. PMID 19867597.
- ^ а б Трэджер В., Дженсен Дж. Б. (1976). «Малярийные паразиты человека в непрерывной культуре». Наука. 193 (4254): 673–675. Дои:10.1126 / science.781840. PMID 781840.
- ^ Трейджер В., Дженсен Дж. Б. (1997). «Непрерывное культивирование Plasmodium falciparum: его влияние на исследования малярии». Int. J. Parasitol. 27 (9): 989–1006. Дои:10.1016 / S0020-7519 (97) 00080-5. PMID 9363481.
- ^ Баско Л.К. (2003). «Молекулярная эпидемиология малярии в Камеруне. XV. Экспериментальные исследования сывороточных заменителей и добавок, а также альтернативных питательных сред для анализа чувствительности к лекарствам in vitro с использованием свежих изолятов Plasmodium falciparum». Являюсь. J. Trop. Med. Hyg. 69 (2): 168–173. Дои:10.4269 / ajtmh.2003.69.168. PMID 14506772.
- ^ Тригг П.И. (1985). «Последние достижения в культивировании малярийных паразитов и их применение в исследованиях взаимоотношений паразит-хозяин: обзор» (PDF). Бык. Всемирный орган здравоохранения. 63 (2): 387–398. ЧВК 2536397. PMID 3893779.
- ^ Шустер FL (2002). «Выращивание плазмодиев spp». Clin. Microbiol. Rev. 15 (3): 355–364. Дои:10.1128 / CMR.15.3.355-364.2002. ЧВК 118084. PMID 12097244.
- ^ Рюссманн Л., Юнг А., Гейдрих Х.Г. (1982). «Использование градиентов перколла, элюции ротора отборщика и окрашивания митрамицином для выделения и идентификации интраэритроцитарных стадий плазмодия berghei». З. Паразитенкд. 66 (3): 273–280. Дои:10.1007 / BF00925344. PMID 6177116.
- ^ Аллен Р.Дж., Кирк К. (2010). "Плазмодий falciparum культура: Польза встряхивания ». Мол. Biochem. Паразитол. 169 (1): 63–5. Дои:10.1016 / j.molbiopara.2009.09.005. PMID 19766147.
- ^ Шерман, И.В. (2010). Волшебные пули для победы над малярией. От хинина до Цинхаосу. ASM Press. ISBN 978-1-55581-543-1.
- ^ Леру М., Лакшманан В., Daily JP (2009). «Биология Plasmodium falciparum: анализ условий роста in vitro по сравнению с in vivo». Тенденции Parasitol. 25 (10): 474–481. Дои:10.1016 / июл 2009.07.005. PMID 19747879.
- ^ а б Спадафора C, Герена L, Копыдловский KM (2011). «Сравнение инвазивных возможностей шизонтов Plasmodium falciparum, выделенных градиентом Перколла или с использованием магнитной сепарации». Малар. J. 10 (1): 96. Дои:10.1186/1475-2875-10-96. ЧВК 3100259. PMID 21501476.
- ^ Коронадо Л.М., Тайлер Н.М., Корреа Р., Джовани Р.М., Спадафора С. (2013). «Разделение эритроцитов, инфицированных на поздней стадии Plasmodium falciparum, с помощью магнитных средств». J. Vis. Опыт. 73 (73): e50342. Дои:10.3791/50342. ЧВК 3622091. PMID 23486405.
- ^ Риваденейра Э.М., Вассерман М., Espinal CT (1983). «Разделение и концентрация шизонтов Plasmodium falciparum градиентами Перколла». J. Protozool. 30 (2): 367–370. Дои:10.1111 / j.1550-7408.1983.tb02932.x. PMID 6313915.[мертвая ссылка]
- ^ Ким CC, Уилсон Е.Б., Деризи Дж.Л. (2010). «Усовершенствованные методы магнитной очистки от малярийных паразитов и гемозоина» (PDF). Малар. J. 9 (1): 17. Дои:10.1186/1475-2875-9-17. ЧВК 2817699. PMID 20074366.
- ^ Bhakdi SC, Ottinger A, Somsri S, Sratogno P, Pannadaporn P, Chimma P, Malasit P, Pattanapanyasat K, Neumann HP (2010). «Оптимизированная магнитная сепарация с высоким градиентом для выделения эритроцитов, инфицированных плазмодиями» (PDF). Малар. J. 9 (1): 38. Дои:10.1186/1475-2875-9-38. ЧВК 2831011. PMID 20122252.
дальнейшее чтение
• Дулан, Д. Л. (редактор) (2002) Методы и протоколы малярии (методы в молекулярной медицине) , Тотова, Нью-Джерси: Humana Press, ISBN 0-89603-823-8 / ISBN 978-0-89603-823-3

