WikiDer > Тетрафторборат нитрозония
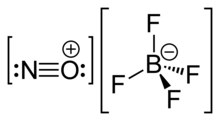 | |
| Имена | |
|---|---|
| Название ИЮПАК тетрафторборат нитрозония | |
| Другие имена нитрозилтетрафторборат | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.035.148 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| BF4NО | |
| Молярная масса | 116.81 г · моль−1 |
| Внешность | бесцветное кристаллическое твердое вещество |
| Плотность | 2,185 г см−3 |
| Температура плавления | 250 ° С (482 ° F, 523 К) (сублимированные) |
| разлагается | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетрафторборат нитрозония, также называемый нитрозилтетрафторборат, это химическое соединение с химическая формула НОБФ4. Это бесцветное твердое вещество используется в органический синтез как нитрозирующий агент.[1]
НОБФ4 это соль нитрозония из фторборная кислота, и состоит из нитрозоний катион, [НЕТ]+, а тетрафторборат анион, [BF4]−.
Реакции
Доминирующая собственность НОБФ4 - окислительная способность и электрофильный характер катиона нитрозония. Образует цветные комплексы с переносом заряда с гексаметилбензолом и с 18-крон-6. Последний, темно-желтый вид, обеспечивает растворение NOBF.4 в дихлорметане.[2]
Тетрафторборат нитрозония можно использовать для получения солей металлов типа [MII(CH3CN)Икс] [BF4]2 (M = Cr, Mn, Fe, Co, Ni, Cu). Катион нитрозония действует как окислитель, сам восстанавливаясь до газообразного оксида азота:[3]
- M + 2NOBF4 + ИксCH3CN → [M (CH3CN)Икс] (BF4)2 + 2НО
С ферроцен в тетрафторборат ферроцения сформирован.[4]
Рекомендации
- ^ «A15806 Тетрафторборат нитрозония, 98%». Альфа Эзар интернет сайт. Получено 2010-09-04.
- ^ Lee, K. Y .; Кучинка, Д.Ю .; Кочи, Джей К. (1990). «Редокс-равновесия катиона нитрозония и его несвязанных комплексов». Неорганическая химия. 29 (21): 4196–4204. Дои:10.1021 / ic00346a008.
- ^ Хайнц, Роберт А .; Смит, Дженнифер А .; Szalay, Paul S .; Вайсгербер, Эми; Данбар, Ким Р. (август 2004 г.). «11. Гомолептические катионы ацетонитрила переходных металлов с тетрафторборатными или трифторметансульфонатными анионами». Неорг. Synth. 33: 75–83. Дои:10.1002 / 0471224502.ch2. ISBN 978-0-471-46075-6.
- ^ Роджер М. Нильсон; Джордж Э. МакМанис; Лэнс К. Саффорд; Майкл Дж. Уивер (1989). «Влияние растворителя и электролита на кинетику самообмена ферроцений-ферроцен. Переоценка». J. Phys. Chem. 93 (5): 2152. Дои:10.1021 / j100342a086.
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |