WikiDer > Оксалилдиаминопропионовая кислота
 | |
| Имена | |
|---|---|
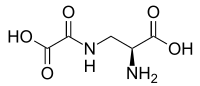
| Название ИЮПАК 3 - [(Карбоксикарбонил) амино] аланин | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol) | |
| 3DMet | |
| Сокращения |
|
| ЧЭБИ | |
| ChemSpider | |
| КЕГГ | |
| MeSH | оксалилдиаминопропионовая + кислота |
PubChem CID | |
| UNII |
|
| |
| |
| Свойства | |
| C5ЧАС8N2О5 | |
| Молярная масса | 176.128 г · моль−1 |
| Родственные соединения | |
Родственные соединения | Бета-метиламино-L-аланин |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Оксалилдиаминопропионовая кислота (ODAP) это структурный аналог из нейротрансмиттер глутамат найдено в траве гороха Lathyrus sativus. Это нейротоксин отвечает за синдром дегенерации двигательных нейронов лафиризм.[1]
Источники
ODAP содержится в семенах бобовых. L. sativusтрава гороха с постоянной концентрацией 0,5%.[2] L. sativus можно найти в районах Южной, Центральной и Восточной Европы, Средиземноморского бассейна, Ирака и Афганистана, а также в районах Азии и Африки.[3]
История
В некоторых регионах, включая Индийский субконтинент, Бангладеш, Эфиопию и Непал, трава гороха стала основным продуктом питания.[3] Растение имеет высокую устойчивость к условиям окружающей среды, что делает его единственным доступным источником пищи во время голода или засухи. После этих нескольких месяцев засухи могут возникнуть эпидемии невролатиризма.[4] Последний случай такой эпидемии (по состоянию на 2013 год) был в Эфиопии во время засухи 1995-1997 годов.[5] за это время 2000 человек получили увечья.[3]
Биологические эффекты
ODAP - это агонист из ионотропный[6] AMPA рецептор глутамата.[5] Известно, что он вызывает невролатризм у людей, дегенеративное заболевание двигательных нейронов, характеризующееся дегенерацией пирамидальный тракт нейроны в спинном мозге и в области коры головного мозга, контролирующей ноги, что приводит к параличу нижней части тела.[6] Нет единого прямого объяснения того, как ODAP вызывает нейролатиризм; тем не менее, были доказательства в поддержку нескольких биологических эффектов. Одна из причин, по которой механизм действия не совсем ясен, может заключаться в том, что до сих пор не была найдена хорошая животная модель для эффекта ODAP у людей.[5] В LD50 тоже неизвестно.
Эксайтотоксичность
ODAP активирует рецепторы AMPA, которые могут вызывать эксайтотоксичность, или чрезмерная стимуляция рецепторов глутамата. Высвобождение слишком большого количества глутамата сразу или в течение длительного периода времени приведет к повышению уровня Ca2+
в цитоплазме. поскольку Ca2+
является сигнальной молекулой для высвобождения глутамата в синапс, это может привести к усилению цикла высвобождения глутамата и распространению эксайтотоксического повреждения на соседние нейроны. Внутри нейрона дополнительные Ca2+
оставит цитоплазма и введите либо митохондрии или эндоплазматический ретикулум (ER), что может приводить к накоплению неправильно свернутых или развернутых белков в ER и, в конечном итоге, к гибели клеток в обоих случаях. Помимо действия в качестве агониста есть доказательства того, что ODAP транспортируется в клетку посредством антипортер который одновременно транспортирует глутамат в синапс.[6]
Окислительный стресс
Второй биологический эффект ODAP: окислительный стресс. Активные формы кислорода (АФК) образуются в митохондриях во время метаболизма, и в организме есть механизмы нейтрализации этих молекул до того, как они нанесут ущерб. Окислительный стресс возникает в результате нарушения нормального функционирования этих путей. Один антиоксидант в нейтрализующем пути глутатион (GSH), для синтеза которого необходимы серосодержащие аминокислоты метионин и цистеин в качестве предшественников. Считается, что ODAP, возможно, из-за индуцированной эксайтотоксичности, снижает потребление цистеина через его антипортер. Это подавляет синтез GSH, что приводит к увеличению производства ROS и повреждению митохондрий. Моторные нейроны могут быть наиболее чувствительны к отравлению ODAP, поскольку они проявляют большую зависимость от метионина, предшественника GSH. В дополнение L. sativus Растение испытывает дефицит серосодержащих аминокислот, что усиливает эффекты ODAP на уровне рецепторов на производство GSH при приеме внутрь.[6]
Синтез
Биосинтез
В L. sativus ODAP синтезируется в молодых проростках из предшественника (β-изоксазолин-5-на-2-ил) -аланина, также известного как BIA. BIA не обнаружен ни в зрелых частях растений, ни в созревающих семенах. Путь начинается с образования BIA из О-ацетил-L-серин (OAS) и изоксазолин-5-он. Разрыв кольца приводит к образованию короткоживущего промежуточного 2,3-L-диаминопропановая кислота (DAPRO), который затем окисляется оксалил-кофермент А сформировать ODAP.[7]
Химический синтез
ODAP может быть синтезирован из L-α, β-диаминопропионовой кислоты и диметил оксалат при pH 4,5-5. Оксид меди может использоваться для временной защиты группы α-NH2 L-α, β-диаминопропионовой кислоты во время реакции.[2]
Смотрите также
- β-Метиламино-L-аланин, родственный токсин
использованная литература
- ^ а б Woldeamanuel, Yohannes W .; Хасан, Анхар; Зенебе, Гута (11.11.2011). «Невролатиризм: два отчета о случаях заболевания в Эфиопии и обзор литературы». Журнал неврологии. 259 (7): 1263–1268. Дои:10.1007 / s00415-011-6306-4. ISSN 0340-5354. PMID 22081101. S2CID 27543906.
- ^ а б Рао, S; Adiga, P; Сарма, П. (март 1964 г.). «Выделение и характеристика β-N-оксалил-L-α, β-диаминопропионовой кислоты: нейротоксин из семян Lathyrus sativus». Биохимия. 3 (3): 432–436. Дои:10.1021 / bi00891a022. PMID 14155110.
- ^ а б c Heuzé V., Tran G., Hassoun P., Lessire M., Lebas F., 2016. Травяной горох (Lathyrus sativus). Feedipedia, программа INRA, CIRAD, AFZ и FAO. https://www.feedipedia.org/node/285 Последнее обновление материала 19 апреля 2016 г., 15:36
- ^ "Lathyrus Research". Universiteit Gent. Архивировано из оригинал 16 апреля 2015 г.. Получено 8 апреля, 2015.
- ^ а б c Сингх, S; Рао, С. (июль 2013 г.). "Уроки невролатризма: болезнь прошлого и будущее Lathyrus sativus (Khesari dal)". Индийский журнал медицинских исследований. 138 (1): 32–37. ЧВК 3767245. PMID 24056554.
- ^ а б c d Moorhem, M; Ламбейн, Ф; Laybaert, L (март 2011 г.). «Раскрытие механизма эксайтотоксичности и оксидативного стресса, вызванных β-N-оксалил-α, β-диаминопропионовой кислотой (β-ODAP), актуальность для профилактики невролатиризма». Пищевая и химическая токсикология. 49 (3): 550–555. Дои:10.1016 / j.fct.2010.03.054. PMID 20510327.
- ^ Куо, Y; Хан, Дж; Ламбейн, Ф (март 1994). «Биосинтез нейротоксина β-odap в развивающихся стручках Lathyrus sativus». Фитохимия. 35 (4): 911–913. Дои:10.1016 / с0031-9422 (00) 90637-х.

