WikiDer > Реакция принса
| Реакция принса | |
|---|---|
| Названный в честь | Хендрик Якобус Принс |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Принс-реакция |
| RSC ID онтологии | RXNO: 0000048 |
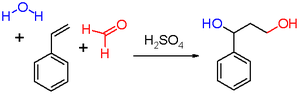
В Реакция принса является органическая реакция состоящий из электрофильная добавка из альдегид или же кетон для алкен или же алкин с последующим захватом нуклеофил или устранение H+ ион.[1][2][3] Результат реакции зависит от условий реакции. С водой и протонной кислотой, такой как серная кислота в качестве реакционной среды и формальдегид продукт реакции представляет собой 1,3-диол. Когда вода отсутствует, катионный интермедиат теряет протон с образованием аллиловый спирт. С избытком формальдегид и при низкой температуре реакции продуктом реакции является диоксан. Когда воду заменяют на уксусная кислота соответствующий сложные эфиры сформированы.
История
Оригинальные реагенты, используемые голландскими химик Хендрик Якобус Принс в его публикации 1919 г. стирол (схема 2), пинен, камфена, эвгенол, изосафрол и анетол.
Хендрик Якобус Принс обнаружил две новые органические реакции во время своих докторских исследований в 1911-1912 годах. Первая - это добавление полигалогеновых соединений к олефинам, а вторая реакция - это кислотно-катализируемое добавление альдегидов к олефиновым соединениям. Ранние исследования реакции Принса носят исследовательский характер и не привлекали особого внимания до 1937 года. Развитие крекинга нефти в 1937 году увеличило производство непредельных углеводородов. Как следствие, коммерческая доступность низшего олефина в сочетании с альдегидом, полученным в результате окисления низкокипящего парафина, увеличила любопытство к изучению олефин-альдегидной конденсации. Позже реакция Принса превратилась в мощный метод образования связей C-O и C-C в синтезе различных молекул в органическом синтезе.[4]
В 1937 году эта реакция была исследована в рамках поисков диолефинов для использования в синтетическая резина.
Механизм реакции
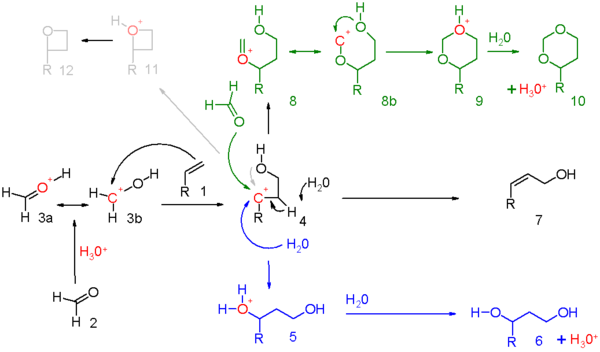
В механизм реакции для этой реакции изображена на схеме 5. карбонил реагент (2) протонированный протонной кислотой и в результате оксониевый ион 3 два резонансные структуры можно нарисовать. Этот электрофил участвует в электрофильная добавка с алкен к карбокатионный промежуточный 4. Сколько точно положительного заряда присутствует на вторичный углерод атом в этом промежуточном продукте следует определять для каждого набора реакций. Доказательства существуют для участие в соседней группе гидроксильного кислорода или соседнего с ним атома углерода. Когда общая реакция имеет высокую степень согласованность, накопление заряда будет скромным.
Три режима реакции открыты для этого оксо-карбений промежуточными являются:
- синим цветом: захват карбокатиона водой или любым подходящим нуклеофилом через 5 к 1,3-аддукту 6.
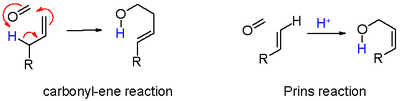
- черным цветом: абстракция протонов в реакция элиминации в ненасыщенное соединение 7. Когда алкен несет метиленовую группу, отщепление и добавление могут согласовываться с переносом аллильного протона на карбонильную группу, которая в действительности является ее реакция в схема 6.
- зеленым цветом: захват карбокатиона дополнительным карбонильным реагентом. В этом режиме положительный заряд рассеивается по кислороду и углероду в резонансных структурах 8a и 8b. Замыкание кольца ведет через промежуточное звено 9 к диоксан 10. Примером может служить преобразование стирол до 4-фенил-м-диоксана.[5]
- серым цветом: только в определенных реакциях и когда карбокатион очень стабилен, реакция сокращается до оксетан 12. Фотохимический Реакция Патерно – Бючи между алкенами и альдегидами в оксетаны более прямолинейно.
Вариации
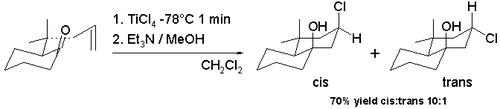
Существует множество вариантов реакции Принса, потому что она легко поддается реакциям циклизации и потому, что можно захватить оксо-карбениевый ион с помощью большого набора нуклеофилов. Реакция галоген-Принса - одна из таких модификаций с заменой протонных кислот и воды на кислоты Льюиса Такие как хлорид олова и трибромид бора. В галоген сейчас нуклеофил рекомбинируя с карбокатионом. Циклизация некоторых аллильные пулегоны в схема 7 с тетрахлорид титана в дихлорметан при −78 ° C дает доступ к декалин скелет с гидроксильной группой и группой хлора преимущественно в конфигурация цис (91% цис).[6] Этот наблюдаемый цис диастереоселективность происходит из-за промежуточного образования алкоксида трихлоротитана, что делает возможной легкую доставку хлора к карбокатион-иону с той же поверхности. Транс-изомер является предпочтительным (98% цис), когда происходит переключение на тетрахлорид олова реакция на комнатная температура.
Реакция Принса-пинакола представляет собой каскадная реакция реакции Принса и пинакольная перегруппировка. Карбонильная группа в реагенте в схема 8[7] маскируется как диметил ацеталь и гидроксил группа замаскирована как триизопропилсилиловый эфир (ЧАЕВЫЕ). С кислотой Льюиса хлорид олова то оксониевый ион активируется, и пинакольная перегруппировка образовавшегося промежуточного соединения Prins приводит к сжатию кольца и перенаправлению положительного заряда на эфир TIPS, который в конечном итоге формирует альдегид группа в конечном продукте как смесь цис- и транс-изомеров с умеренной диастереоселективностью.
Ключевой оксо-карбениевый промежуточный продукт может быть образован другими путями, кроме простого протонирования карбонила. На ключевой стадии синтеза экзигуолида он был образован путем протонирования винилогичный сложный эфир:[8]
Смотрите также
Рекомендации
- ^ Конденсация формальдегида с некоторыми непредельными соединениями Х. Дж. Принс, Chemisch Weekblad, 16, 64, 1072, 1510 1919
- ^ Химические рефераты 13, 3155 1919
- ^ Arundale, E .; Микеска, Л. А. (1952). "Конденсация олефин-альдегида. Реакция Принса". Химические обзоры. 51 (3): 505–555. Дои:10.1021 / cr60160a004.
- ^ Маракатти, Виджайкумар С. (2015). «Разработка твердых кислотных катализаторов реакции Принса и метилирования толуола». Инфлибнет.
- ^ 4-фенил-м-диоксан Р. Л. Шрайнер и Филип Р. Руби Органический синтез, Сб. Vol. 4, стр.786 (1963); Vol. 33, стр.72 (1953). Статья
- ^ Майлз, Р. Брэндон; Дэвис, Чад Э .; Коутс, Роберт М. (2006). «Син- и антиселективные принцы, циклизации δ, ε-ненасыщенных кетонов в 1,3-галогидрины с кислотами Льюиса». Журнал органической химии. 71 (4): 1493–1501. Дои:10.1021 / jo052142n. PMID 16468798.
- ^ Оверман, Ларри Э .; Velthuisen, Эмиль Дж. (2006). «Объем и лицевой селективности синтеза Prins-Pinacol прикрепленных колец». Журнал органической химии. 71 (4): 1581–1587. Дои:10.1021 / jo0522862. PMID 16468809.
- ^ Квон, Мин Санг; Ву, Сан Кук; На, Сон Ук; Ли, Ын (2008). «Полный синтез (+) - экзигуолида». Angewandte Chemie International Edition. 47 (9): 1733–1735. Дои:10.1002 / anie.200705018. PMID 18214872.
внешняя ссылка
- Реакция Принса в общем синтезе алкалоидов Связь
- Реакция Принса @ organic-chemistry.org