WikiDer > Ralstonia solanacearum
| Ralstonia solanacearum | |
|---|---|
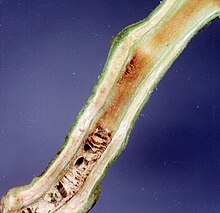 | |
| Ущерб, причиненный Ralstonia solanacearum на стебле томата | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Протеобактерии |
| Класс: | Бетапротеобактерии |
| Порядок: | Burkholderiales |
| Семья: | Burkholderiaceae |
| Род: | Ralstonia |
| Виды: | R. solanacearum |
| Биномиальное имя | |
| Ralstonia solanacearum (Смит 1896) Ябуучи и другие. 1996 | |
| Тип штамма | |
| ATCC 11696 CCUG 14272 | |
| Синонимы | |
Burkholderia solanacearum (Смит 1896 г.) Ябуучи и др. 1993 г. | |
Ralstonia solanacearum является аэробный неспорообразующий, Грамотрицательный, патогенные растения бактерия. R. solanacearum переносится почвой и подвижный с пучок полярного жгутика. Он колонизирует ксилема, вызывая бактериальные увядать в очень широком диапазоне потенциальных растений-хозяев. Он известен как Гранвилл Уилт когда это происходит в табак. Бактериальное увядание томатов, перца, баклажанов и ирландского картофеля, вызванное: R. solanacearum были одними из первых болезней, которые Эрвин Фринк Смит доказано, что это вызвано бактериальным возбудителем. Из-за своей разрушительной смертоносности, R. solanacearum в настоящее время является одной из наиболее интенсивно изучаемых фитопатогенных бактерий, а бактериальное увядание томатов представляет собой модельную систему для исследования механизмов патогенеза.[1]Ralstonia был недавно реклассифицирован как Псевдомонады, со сходством во многих аспектах, за исключением того, что он не производит флуоресцентный пигмент, подобный Псевдомонады.[2] Геномы из разных штаммов варьируются от 5,5 МБ до 6 МБ, что составляет примерно 3,5 МБ хромосомы и 2 МБ мегаплазмиды.[3] Хотя штамм GMI1000 был одной из первых фитопатогенных бактерий, геном которой был завершен,[4] штамм UY031 был первым R. solanacearum иметь свой метилом сообщил.[3] В рамках R. solanacearum комплекс видов, четыре основных монофилетических кластера штаммов называются филотипы, которые географически различны: филотипы I-IV встречаются в Азии, Америке, Африке и Океании соответственно.[1][3]
Ralstonia solanacearum когда-то рассматривался как возможное средство биологической борьбы с имбирем Кахили (Hedychium gardnerianum), высокоинвазивный вид.[5] Однако, R. solanacearum больше не используется в качестве биологического средства борьбы с имбирем кахили в гавайских лесах из-за его широкого диапазона хозяев. Паразитирующий имбирь штамм заразит многие виды имбиря, включая съедобный имбирь (Зингибер лекарственный), шампунь имбирный (Зингибер зерумбет, розовый имбирь (Альпиния пурпурата) и красный имбирь (Альпиния пурпурата).[6]
Хозяева и симптомы
Хосты
Завод хозяев, которые R. solanacearum Инфекции включают:
- Культуры
- Картофель (Solanum tuberosum); помидор (Lycopersicum esculentum)[7]; баклажан (баклажан) (Solanum melongena); банан, (Муса spp); герань (общее название) (Пеларгония); имбирь (Зингибер лекарственный); табак (Nicotiana tabacum); сладкий перец (Стручковый перец виды); оливковый (Olea europea); Роза (Роза); и соя (Глицин макс).[8]
- Дикие хозяева
- Паслен древесный (Solanum dulcamara)
Симптомы
Герань:[9]
- Увядание начинается с нижних листьев и черешков и распространяется вверх по растению.
- Увядшие листья имеют хлоротичные, клиновидные участки или хлоротичные и / или некротические края листа. Пятна на листьях отсутствуют.
- В конце концов, все растение разрушается на среде.
- Из срезанных стеблей сочится белый жидкий материал.
Картофель:[9]
- Увядание листьев происходит в конце дня с восстановлением ночью. Растения в конечном итоге не восстанавливаются и умирают.
- Происходит коричневое окрашивание сосудистого кольца, и при сдавливании клубня из кольца может выделяться гной.
- Бледная слизь может выделяться из глаз и пятки картофеля. Почва будет прилипать к сочащимся глазкам.
- Поперечный разрез стебля, помещенного в воду, источает молочно-белые пряди.
- В отличие от грибкового увядания, листья остаются зелеными при бактериальном увядании.
Цикл болезни
Выживание
Ralstonia solanacearum мочь перезимовать в растительных остатках или больных растениях, диких хозяевах, семенах или вегетативных органах размножения, таких как клубни. Бактерии могут выжить в воде в течение длительного времени (до 40 лет при 20–25 ° C в чистой воде), а популяция бактерий сокращается в экстремальных условиях (температура, pH, соли, например). Иногда зараженные земли нельзя использовать повторно для выращивания восприимчивых культур в течение нескольких лет. R. solanacearum также могут выжить в прохладную погоду и войти в состояние жизнеспособности, но не культивирования. В большинстве случаев эта стадия не представляет угрозы для сельского хозяйства, поскольку после выздоровления бактерии обычно становятся невирулентными.[1]
Рассредоточение
Ralstonia solanacearum вызывает увядание у больших популяций (108 – 1010 КОЕ / г ткани) и распространяется несколькими путями. Большое количество R. solanacearum может проливаться от корней симптоматических и бессимптомных растений. Кроме того, бактериальный ил (который обычно используется как признак обнаружения) на поверхности растений) может попадать в окружающую почву или воду, заражая сельскохозяйственное оборудование, или может быть передан насекомым-переносчикам.[1] Кроме того, этот патоген может распространяться через загрязненные паводковые воды, ирригацию, загрязненные инструменты или зараженные семена. В северной Европе возбудитель поселился в пасленовых сорняках, которые растут в медленно текущих реках. Когда такая загрязненная вода используется для орошения картофеля, патоген попадает в систему производства картофеля. Штамм биовара 2 расы 3 может выжить в многолетних пасленовых, которые действуют как вторичные хозяева, а также может вызывать бактериальное увядание томатов.[10] Некоторым государствам ЕС и странам Ближнего Востока еще не удалось искоренить этот патоген.
Инфекция
Ralstonia solanacearum обычно попадает в растение через ранку. Естественные раны (созданы опадение цветов, генезис боковых корней) и неестественные (сельскохозяйственные методы или нематоды и насекомые, питающиеся ксилемой) могут стать местами входа для R. solanacearum. Бактерии попадают в раны частично благодаря плавательной подвижности, опосредованной жгутиками, и хемотаксическому притяжению к корневым экссудатам. В отличие от многих фитопатогенных бактерий, R. solanacearum потенциально требуется только одно место проникновения, чтобы установить системную инфекцию, которая приводит к бактериальному увяданию.[1]
После вторжения в восприимчивого хозяина, R. solanacearum размножается и систематически перемещается внутри растения до появления симптомов бактериального увядания. Увядание следует рассматривать как наиболее заметный побочный эффект, который обычно возникает после обширной колонизации патогена. Когда возбудитель попадает в ксилему через естественные отверстия или раны, тилосы может образовываться, чтобы блокировать осевую миграцию бактерий внутри растения. У чувствительных растений это иногда происходит медленно и нечасто, чтобы предотвратить миграцию патогенов, и вместо этого может привести к сосудистой дисфункции из-за неспецифической закупорки неколонизированных сосудов.[требуется разъяснение]
Увядание происходит при большом количестве бактерий в ксилеме и частично связано с сосудистой дисфункцией, когда достаточное количество воды не может достичь листьев. В это время содержание внеклеточного полисахарида (EPS1) составляет около 10 мкг / г ткани в стержневом корне, гипокотиле и средней части ствола; Концентрация EPS1 повышается позже и составляет более 100 мкг / г ткани у полностью увядшего растения. Ралстонии Системный токсин также вызывает потерю контроля над устьицами, но нет данных, свидетельствующих о чрезмерной транспирации как ее следствии. Основным фактором увядания, вероятно, является блокирование мембран ямок черешков и листьев высокомолекулярным EPS1. Высокая плотность бактерий является побочным продуктом деградации клеточной стенки растений; Тилозы и камеди, вырабатываемые самим растением, также способствуют увяданию.[1]
Естественная генетическая трансформация
Большинство штаммов R. solanacearum компетентны для генетической трансформации.[11] Естественная генетическая трансформация представляет собой половой процесс, включающий передачу ДНК от одной бактериальной клетки к другой через промежуточную среду и интеграцию донорной последовательности в геном реципиента посредством гомологичная рекомбинация. R. solanacearum способен обмениваться большими фрагментами ДНК от 30 до 90 тысяч оснований.[11]
Механизмы вирулентности
Ralstonia solanacearum обладает генами для всех шести путей секреции белка, которые были охарактеризованы у грамотрицательных бактерий. Возможно, наиболее изученным из них является Система секреции типа III (T3SS или TTSS), который секретирует стимулирующие инфекцию эффекторные белки (T3E) в клетки-хозяева. Около 74 подозреваемых или подтвержденных T3E были идентифицированы в R. solanacearum на сегодняшний день, хотя функции очень немногих в настоящее время известны. Несмотря на то, что это всего лишь одна из нескольких систем секреции белка, T3SS необходим для R. solanacearum вызвать болезнь.[12] Не обнаружено, что ни один эффекторный белок значительно изменяет патогенность R. solanacearum, но одновременное нарушение определенных подмножеств эффекторов (таких как набор из семи эффекторов GALA в штамме GMI1000) сильно влияет на вирулентность патогена. GALA 7 необходим для вирулентности Medicago truncatula, что указывает на то, что разнообразие T3E может играть роль в определении широкого диапазона хозяев R. solanacearum видовой комплекс.[13]
Система секреции типа III не уникальна для R. solanacearum, и на самом деле очень древний. Эволюционная история T3SS оспаривается; высокая степень сходства с жгутик вызвал споры по поводу отношений между этими двумя структурами.[1]
Около половины белков T3SS высоко консервативны в R. solanacearum и, вероятно, представляют собой очень старое и стабильное эффекторное ядро.[14] Среди другой половины, показывающей различия между разными штаммами R. solanacearum, только треть показывает свидетельство боковой перенос гена. Происхождение остальных эффекторов неизвестно, хотя некоторые исследователи предполагают, что взаимодействия ген-ген могут играть важную роль в формировании генов вирулентности в R. solanacearum.[15][16] Некоторые из этих эффекторных белков являются гомологичный к эффекторам, подобным активаторам транскрипции (TAL эффекторы) от Ксантомонады [17] и может иметь аналогичную функцию активации определенных генов в клетках растения-хозяина во время R. solanacearum патогенез.
Окружающая среда
Среда, в которой R. solanacearum обычно обнаруживается, зависит от конкретной расы (генетически разнообразная популяция внутри вида) и конкретного биовара (штамм, который физиологически или биохимически отличается от других штаммов). Раса 1, раса 2, биовар 1 и раса 3, биовар 2. три самых распространенных и важных штамма. Штаммы расы 1 имеют широкий спектр хозяев, включая табак и бананы, и обычно встречаются в тропических и субтропических средах, поскольку им трудно выжить при более низких температурах, и они являются эндемичными для юго-востока Соединенных Штатов.[18] Штаммы расы 2 имеют более ограниченный круг хозяев, чем расы 1, и в основном распространены в тропической среде. Штаммы Race 3 более холодоустойчивы, чем два других, и встречаются в тропических высокогорных районах и районах с умеренным климатом.[18] Диапазон хозяев для биовара 2 гонки 3 включает картофель, помидоры и герань. Биовар 2 расы 3 очень распространен во всем мире, но обычно не регистрируется в Северной Америке.[19] такова цель многих практик управления санитарией и карантином для предотвращения заноса или распространения патогена.
Хотя его еще нет, исследователи из Гуамский университет обеспокоены возможным распространением R. solanacearum к Гуам.[20]
Управление
Общее руководство
Коммерческие химикаты, как правило, неэффективны в борьбе с патогеном и не рекомендуются в качестве средства борьбы.[1] В регионах, где патоген установлен, стратегия комплексного управления заболеванием является лучшим методом уменьшения любого воздействия патогена. Использование посадочного материала, свободного от патогенов, является необходимостью. Посадка устойчивых сортов сводит к минимуму вредное воздействие патогена, хотя в настоящее время нет полностью иммунных сортов. Наконец, хорошая система севооборота, которая следует за восприимчивыми культурами с устойчивыми или невосприимчивыми культурами, может помочь уменьшить количество патогенов.[1] Возбудитель указан как выберите агента В Соединенных Штатах; если патоген обнаружен надлежащим органом, может быть реализован ряд протоколов управления. Они могут варьироваться от обследований до карантина инфицированного и потенциально инфицированного растительного материала, что, в свою очередь, может привести к более масштабным программам ликвидации и санитарии.[18]
Специфические симптомы растения-хозяина и лечение
Картофель
Типичными симптомами являются увядание и пожелтение листьев, а также общая задержка роста растения.[21] Листья также могут принимать бронзовый оттенок.[22] вместе с тем, на стеблях появляются полосы, а глазки клубней обесцвечиваются. Клубни также начинают гнить, если их оставить в земле. Молочно-белый липкий экссудат или ил, состоящий из бактериальных клеток и их внеклеточного полисахарида, обычно заметен на свежесрезанных срезах инфицированных клубней.[23]Бороться с R. solanacearum сложно, потому что это почвенный патоген, имеет широкий круг хозяев, длительное время выживания в почве и широкий биологический диапазон. Не было обнаружено, что ни один метод контроля является эффективным на 100%, хотя в местах, где установлен патоген, некоторый уровень контроля бактериального увядания был возможен за счет использования комбинации различных методов.[23] Эти методы включают фитосанитацию и культивирование, химический контроль, биологический контроль и устойчивость хозяина. Для предотвращения распространения болезни рекомендуются общие санитарно-гигиенические меры, поскольку химический контроль неэффективен. Севооборот с устойчивыми культурами полезно, так как изменяет pH почвы, чтобы поддерживать его на низком уровне летом (4-5) и выше осенью (6).[22]
Помидор
Молодые листья растения станут вялыми, а на стебле растения могут появиться придаточные корни. Сосудистая система приобретает все более темный коричневый цвет по мере прогрессирования заболевания в дополнение к возможным поражениям на стебле.[24]Практика управления аналогична картофельной.
Банан
Обычно происходит пожелтение и увядание старых листьев, а также уменьшение размера плодов и, в конечном итоге, их гниение.[25] Кроме того, цветы могут почернеть и сморщиться, а ткань сосудов обесцветится.[26]Исключение болезни там, где ее нет, является единственным эффективным средством борьбы. Если область действительно заражена, все зараженные растения должны быть уничтожены, поэтому необходимо использовать строгие санитарные методы, чтобы уменьшить распространение болезни.[26]
Важность
Ralstonia solanacearum классифицируется как одна из самых важных фитопатогенных бактерий в мире из-за своей летальности, устойчивости, широкого диапазона хозяев и широкого географического распространения. Хотя патоген вызывает большие потери урожая в тропиках и субтропиках, в настоящее время он представляет постоянную угрозу в умеренном климате.[1]
Ralstonia solanacearum является широко распространенным чужеродным патогеном растений карантинного статуса A2, поражающим очень широкий спектр сельскохозяйственных культур. Это означает, что он присутствует в некоторых частях Европы, но находится под законодательным контролем. Наиболее пострадавшими культурами во всем мире являются картофель, томаты, табак, бананы и герань. В Великобритании и других странах ЕС наиболее важными затронутыми культурами являются картофель и томаты. Это нанесло бы серьезный экономический ущерб, если бы оно стало более развитым, чем сейчас. Убытки вызваны фактическим снижением урожайности, а также законодательными мерами по ликвидации болезни.
Бактериальное увядание, вызванное R. solanacearum имеет экономическое значение, поскольку поражает более 250 видов растений более чем 50 семейств. По состоянию на 2007 год этот патоген поразил более 450 видов-хозяев, представляющих 54 семейства растений, из-за широкого круга хозяев по всему миру.[27] Заболевание известно как южное увядание, бактериальное увядание и бурая гниль картофеля. Многое другое двудольные страдать от болезни, чем однодольные. Среди однодольных-хозяев доминирует отряд Zingiberales, при этом пять из девяти семейств инфицированы этой бактерией.[1] Причина, по которой некоторые семьи более восприимчивы к бактериальному увяданию, до сих пор неизвестна. Первоначально R. solanacearum Встречается в тропическом, субтропическом и теплом умеренном климате, но считается, что он не выдерживает низких температур. Однако недавно этот возбудитель был обнаружен у герани (Пеларгония spp.) в Висконсине, США [28] и был прослежен до импорта черенков герани в Северную Америку и Европу из высокогорных тропиков, где биовар 2 расы 3 является эндемичным. [29]
Коричневая гниль картофеля, вызванная R. solanacearum биовар 2 расы 3 является одним из самых серьезных заболеваний картофеля во всем мире и ежегодно несет убытки в размере 950 миллионов долларов США.[30] Биовар 2 расы 3 устойчив к холоду и классифицируется как карантинный патоген.[29] Кроме того, эта раса / биовар был внесен в список избранного агента в Законе о сельскохозяйственном биотерроризме 2002 г., и считается, что он имеет потенциал для развития в качестве биотеррор оружие.[28]
использованная литература
- ^ а б c d е ж г час я j k Денни Т., "Патогенные растения Ralstonia виды »в GNANAMANICKAM, S. S. (2006). Бактерии, ассоциированные с растениями. Dordrecht, Springer. pp 1-62
- ^ Агриос, Г. Н. (2008). Патология растений. Амстердам [u.a.], Elsevier Academic Press, стр. 647-649
- ^ а б c Гуариски-Соуза, Родриго; Пуигвер, Марина; Coll, Núria S .; Сири, Мария Инес; Пьянццола, Мария Хулия; Валлс, Марк; Сетубал, Жоао К. (15 января 2016 г.). «Полная последовательность генома патогена картофеля Ralstonia solanacearum UY031». Стандарты геномных наук. 11 (1): 7. Дои:10.1186 / s40793-016-0131-4. ЧВК 4714475. PMID 26779304.
- ^ Salanoubat, M .; Генин, С .; Artiguenave, F .; Gouzy, J .; Mangenot, S .; Арлат, М .; Billault, A .; Brottier, P .; Camus, J.C .; Cattolico, L .; Chandler, M .; Choisne, N .; Claudel-Renard, C .; Cunnac, S .; Demange, N .; Гаспин, С .; Lavie, M .; Moisan, A .; Роберт, C .; Saurin, W .; Schiex, T .; Siguier, P .; Thébault, P .; Whalen, M .; Wincker, P .; Леви, М .; Weissenbach, J .; Баучер, К. А. (31 января 2002 г.). «Последовательность генома растительного возбудителя Ralstonia solanacearum». Природа. 415 (6871): 497–502. Дои:10.1038 / 415497a. PMID 11823852.
- ^ Andersona, R.C .; Гарднер, Д. Э. (1999). "Оценка бактерий, вызывающих увядание Ralstonia solanacearum как потенциальный агент биологической борьбы с чужеродным имбирем Кахили (Hedychium gardnerianum) в гавайских лесах ». Биологический контроль. 15 (2): 89–96. Дои:10.1006 / bcon.1999.0705.
- ^ Paret, M.L .; де Сильва, A.S .; Criley, R.A .; Альварес, А. (2008). «Ralstonia solanacearum Race 4: Оценка риска для съедобного имбиря». HortTechnology. 18: 90–96. Дои:10.21273 / HORTTECH.18.1.90.
- ^ Farahat, M.G .; Abdel Rahman, Tahany, M .; Hussein, R.A .; Заглол, Гихан М. (2016). «Биологический контроль бактериального увядания томатов с помощью эндофитных Pseudomonas fluorescens и Bacillus subtilis». Египетский журнал ботаники. 56 (2): 543–558. Дои:10.21608 / ejbo.2017.1150. ISSN 2357-0350.
- ^ Terblanche, J .; де Вильерс, Д.А. (2013). Приор, Филипп; Аллен, Кейтлин; Эльфинстон, Джон (ред.). Бактериальная болезнь вилта: молекулярные и экологические аспекты (1-е изд.). Париж: Springer Science & Business Media. п. 326. ISBN 9783662035924.
- ^ а б «Бактериальное увядание - Ralstonia solanacearum race 3, биовар 2». Massnrc.org. 2008-02-25. Получено 2012-09-24.
- ^ Чарковски, Эми (2020). «Бактериальные болезни картофеля». Картофель: 351–388. Дои:10.1007/978-3-030-28683-5_10. ISBN 978-3-030-28682-8.
- ^ а б Coupat B, Chaumeille-Dole F, Fall S, Prior P, Simonet P, Nesme X, Bertolla F (2008). «Естественная трансформация комплекса видов Ralstonia solanacearum: количество и размер ДНК, которая может быть перенесена». FEMS Microbiol. Ecol. 66 (1): 14–24. Дои:10.1111 / j.1574-6941.2008.00552.x. PMID 18662313.
- ^ Vasse, J; Генин, С .; Паскаль, Ф .; Boucher, C .; Брито, Б. (2000). «Регулирующие гены hrpB и hrpG Ralstonia solanacearum необходимы на разных стадиях процесса заражения корня томата». Молекулярные взаимодействия растений и микробов. 13 (3): 259–267. Дои:10.1094 / mpmi.2000.13.3.259. PMID 10707351.
- ^ Ангот, Орели; Peeters, N; Лехнер, Э; Vailleu, F; Бод, C; Gentzbittel, L; Sartorel, E; Генщик, П; Буше, К; Генин, Стефан (2006). «Ralstonia solanacearum требует, чтобы эффекторы типа III, содержащие F-box-подобный домен, способствовали развитию заболевания на нескольких растениях-хозяевах». Труды Национальной академии наук. 103 (39): 14620–14625. Дои:10.1073 / pnas.0509393103. ЧВК 1600009. PMID 16983093.
- ^ Ременант, Бенуа; Coupat-Goutaland, B .; Guidot, A .; Cellier, G .; Прайор, П. (2010). «Геномы трех патогенов томатов в составе комплекса видов Ralstonia solanacearum обнаруживают значительное эволюционное расхождение». BMC Genomics. 11 (1): 379. Дои:10.1186/1471-2164-11-379. ЧВК 2900269. PMID 20550686.
- ^ Poueymiro, M .; Генин, С. (2009). «Секретные белки Ralstonia solanacearum: сто уловок, чтобы убить растение». Текущее мнение в микробиологии. 12 (1): 44–52. Дои:10.1016 / j.mib.2008.11.008. PMID 19144559.
- ^ Генин, С .; Баучер, К. (2004). «Уроки, извлеченные из анализа генома Ralstonia solanacearum». Ежегодный обзор фитопатологии. 42: 107–134. Дои:10.1146 / annurev.phyto.42.011204.104301. PMID 15283662.
- ^ Heuer, H .; Инь, Ю. -Н .; Сюэ, Q. -Y .; Smalla, K .; Го, Дж. -H. (2007). «Разнообразие повторяющихся доменов avrBs3-подобных генов в штаммах Ralstonia solanacearum и ассоциация с предпочтениями хозяев в полевых условиях». Прикладная и экологическая микробиология. 73 (13): 4379–4384. Дои:10.1128 / AEM.00367-07. ЧВК 1932761. PMID 17468277.
- ^ а б c «R. solanacearum / Бактериальное увядание - Бурая гниль картофеля». Plantpath.ifas.ufl.edu. 2008-09-12. Получено 2012-09-24.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2010-10-07. Получено 2010-12-08.CS1 maint: заархивированная копия как заголовок (ссылка на сайт)
- ^ «UOG следит за молью, бактериями, поражающими пасленовые растения».
- ^ «Симптомы коричневой гнили картофеля». Cals.ncsu.edu. Получено 2012-09-24.
- ^ а б «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2010-10-09. Получено 2010-12-08.CS1 maint: заархивированная копия как заголовок (ссылка на сайт)
- ^ а б Champoisea et al. 2009 (2009). «R alstonia solanacearum Race 3 Биовар 2 вызывает тропические потери и умеренные беспокойства». Прогресс здоровья растений. 10: 35. Дои:10.1094 / PHP-2009-0313-01-RV.
- ^ «Симптомы бактериального увядания томатов». Cals.ncsu.edu. Получено 2012-09-24.
- ^ «Симптомы банановой болезни Моко». Cals.ncsu.edu. Получено 2012-09-24.
- ^ а б http://www.agric.wa.gov.au/objtwr/imported_assets/content/pw/ph/dis/fn/fs2006_moko_neyres.pdf
- ^ Плетеный, Эммануэль (2007-08-24). «Штаммы Ralstonia Solanacearum с Мартиники (Французская Вест-Индия), демонстрирующие новый патогенный потенциал». Прикладная и экологическая микробиология. 73 (21): 6790–6801. Дои:10.1128 / AEM.00841-07. ЧВК 2074947. PMID 17720825.
- ^ а б Худельсон Б. 2005. Предупреждение о вредителях Висконсинского университета - Ralstonia увядать.
- ^ а б Миллинг А., Мэн Ф., Денни Т., Аллен К. 2009. Взаимодействие с хозяевами при низких температурах, а не переносимость холода, объясняют уникальную эпидемиологию Ralstonia solanacearum гонка 3 биовар 2
- ^ Эфинстон, Дж. Г. 2005. Текущая ситуация с бактериальным увяданием: глобальный обзор. pp 9-28 in: Бактериальное увядание: болезнь и Ralstonia solanacearum Видовой комплекс. К. Аллен, П. Прайор и А. С. Хейворд, ред. Американское фитопатологическое общество, Сент-Пол, Миннесота.
внешние ссылки
- Профиль вида - Южное бактериальное увядание (Ralstonia solanacearum), Национальный информационный центр по инвазивным видам, Национальная сельскохозяйственная библиотека США. Перечисляет общую информацию и ресурсы по южному бактериальному увяданию.
- Список патогенов растений, подлежащих экспортному контролю
- Типовой штамм Ralstonia solanacearum в BacНырять - База метаданных по бактериальному разнообразию
