WikiDer > Тетрародий додекакарбонил
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК три-μ-карбонил-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-нонакарбонил-1κ2C, 2κ2C, 3κ2C, 4κ3C-[Тd- (13) -Δ4-близко]- | |
| Другие имена карбонил родия (0); карбонил родия; додекакарбонил родия | |
| Идентификаторы | |
3D модель (JSmol) | |
| ECHA InfoCard | 100.039.232 |
| |
| Характеристики | |
| Rh4(CO)12 | |
| Молярная масса | 747,743 г / моль |
| Внешность | Красные кристаллы |
| Растворимость | Хлороуглероды, толуол, тетрагидрофуран |
| Родственные соединения | |
Родственные соединения | Хлорид родия (III), Rh6(CO)16, Rh2(CO)4Cl2 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
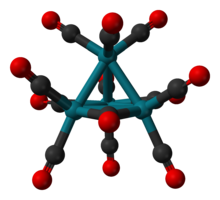
Тетрародий додекакарбонил это химическое соединение с формула Rh4(CO)12. Это темно-красное кристаллическое твердое вещество представляет собой самый маленький стабильный бинарный карбонил родия. Используется как катализатор в органический синтез.
Строение, синтез, реакции
Строение Rh4(CO)12 описывается тетраэдрическим массивом из четырех Rh атомы с девятью терминалами CO лиганды и три мостиковые лиганды CO. Структуру можно выразить как Rh4(CO)9(мк-СО)3.[1] Его получают обработкой водного раствора трихлорида родия активированным медь металл в атмосфере CO.[2]
- 4 RhCl3(ЧАС2O)3 + 8 Cu + 22 CO → Rh4(CO)12 + 2 СО2 + 8 Cu (CO) Cl + 4 HCl + 10 H2О
Альтернативно, соединение можно получить обработкой метанольный решение RhCl3(ЧАС2O)3 с CO, чтобы получить H [RhCl2(CO)2] с последующим карбонилированием в присутствии цитрат натрия.[1]
Кластер подвергается термическому замена с фосфорными лигандами, L:
- Rh4(CO)12-п + п L → Rh4(CO)12-пLп + п CO
Родственные карбонилы металлов
Поскольку они имеют отношение к гидроформилирование катализ, карбонилы металлов систематически изучена в высокой степени. Нестабильность Rh2(CO)8 был источником любопытства. Аналогичный бинарный карбонил кобальта, Co2(CO)8, хорошо известен. Растворы Rh4(CO)12 при высоких давлениях CO превращается в соединение диродия:[3]
- Rh4(CO)12 + 4 CO → 2 Rh2(CO)8
В отличие от Co2(CO)8 который включает мостиковые карбонилы, основной изомер Rh2(CO)8 содержит только концевые лиганды CO. Относительная нестабильность Rh2(CO)8 аналогично тенденции Ru (CO)5 конвертировать в Ru3(CO)12.
Рекомендации
- ^ а б Serp, P .; Kalck, P .; Feurer, R .; Моранчо, Р. (1998). Марсетта. Я. Даренсбург (ред.). «Три-µ-карбонил-нонакарбонилтетрародий». Неорганические синтезы. Неорганические синтезы. 32: 284–287. Дои:10.1002 / 9780470132630.ch45. ISBN 9780470132630.
- ^ С. Мартиненго; Дж. Джордано; П. Чини; Г. В. Паршалл; Э. Р. Вончоба (1990). Роберт Дж. Анджелико (ред.). «Три-µ-карбонил-нонакарбонилтетрародий». Неорганические синтезы. Неорганические синтезы. 28: 242–245. Дои:10.1002 / 9780470132593.ch62. ISBN 9780470132593.
- ^ Браун, Д. Т .; Eguchi, T .; Heaton, B.T .; Iggo, J. A .; Уайман, Р. (1991). «Спектроскопические исследования реакций кластеров [Rh4(CO)12–Икс{P (OPh)3}Икс] (Икс = 1–4) с оксидом углерода или синтез-газом ». Журнал химического общества, Dalton Transactions: 677–683. Дои:10.1039 / DT9910000677.
Общее чтение
- Кинг, Р. Б., "Родий: Металлоорганическая химия" Энциклопедия неорганической химии 1994, 7, 3494.