WikiDer > Аполипопротеин D - Википедия
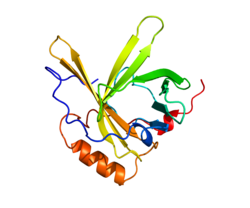
Аполипопротеин D это белок что у людей кодируется Астрономическая картинка дня ген.[5][6][7] в отличие от других липопротеиныАполипопротеин D в основном продуцируется в печени, а в мозге и семенниках.[8] Это гликопротеин массой 29 кДа, открытый в 1963 году как компонент фракции липопротеинов высокой плотности (ЛПВП) плазмы человека.[9][10] Это основной компонент жидкости кисты молочной железы человека. Кодирующий его ген человека был клонирован в 1986 году, и расчетная последовательность белка показала, что ApoD является членом семейства липокалинов, переносчиков малых гидрофобных молекул (Drayna et al, 1986). ApoD состоит из 169 аминокислот, включая сигнал пептида секреции из 20 аминокислот. Он содержит два сайта гликозилирования (аспаргины 45 и 78), а молекулярная масса зрелого белка колеблется от 20 до 32 кДа (см. Рисунок 1).
Разрешенная третичная структура показывает, что ApoD состоит из 8 антипараллельных β-цепей, образующих гидрофобную полость, способную принимать различные лиганды.[11][12] ApoD также содержит 5 остатков цистеина, 4 из которых вовлечены во внутримолекулярные дисульфидные связи.
Функция
Аполипопротеин D (Apo-D) является компонентом липопротеин высокой плотности который не имеет заметного сходства с другими последовательностями аполипопротеина. Имеет высокую степень гомологии с плазмой. ретинол-связывающий белок и другие члены суперсемейства белков-носителей альфа-2-микроглобулинов, также известные как липокалины. Это гликопротеин с предполагаемой молекулярной массой 33 кДа. Apo-D тесно связан с ферментом лецитином: холестерин-ацилтрансферазой - ферментом, участвующим в метаболизме липопротеинов.[7] Было также показано, что ApoD является важным звеном во временном взаимодействии между частицами HDL и LDL и между частицами HDL и клетками.[13]
Взаимодействия и лиганды
Было показано, что ApoD связывает стероидные гормоны, такие как прогестерон и прегненолон, с относительно сильным сродством, а с эстрогеном - с более низким сродством.[14][15] Исследования молекулярного моделирования выявили билирубин, компонент, полученный из гема, в качестве потенциального лиганда. Это свойство связывания было затем продемонстрировано экспериментально.[11] Арахидоновая кислота (АК) была идентифицирована как лиганд ApoD с гораздо лучшим сродством, чем у прогестерона или прегненолона.[16] АК является предшественником простагландинов и лейкотриенов, молекул, которые участвуют в воспалении, агрегации тромбоцитов и клеточной регуляции.[17] Также наблюдали очень плохое связывание между ApoD и холестерином.[18] Другие лиганды ApoD включают Е-3-метил-2-гексеновую кислоту, молекулу, присутствующую в подмышечных секретах;[19] ретиноевая кислота, участвующая в дифференцировке клеток; сфингомиелин и сфинголипиды, которые являются основными компонентами ЛПВП и клеточных мембран.[20] Тот факт, что apoD может связывать такое большое количество лигандов, убедительно подтверждает гипотезу о том, что это может быть полилигандный многофункциональный белок.
Клиническое значение
APOD - это биомаркер синдрома нечувствительности к андрогенам (АИС). APOD представляет собой ген, активируемый андрогеном в нормальных клетках фибробластов мошонки по сравнению с клетками CAIS labia majora.[21] APOD связан с неврологическими расстройствами и повреждениями нервов, особенно связанными с миелин оболочка. Было показано, что APOD был повышен на крысиной модели Инсульт.[8] APOD повышен у пациентов с шизофрения, биполярное расстройство, и Болезнь Альцгеймера.[8]
Экспрессия ApoD в клетках и тканях
Анализ промоторной области гена ApoD выявил большое количество регуляторных элементов, среди которых элементы ответа на стероиды, эстроген, прогестерон и глюкокортикоиды. Также наблюдались элементы ответа на жирные кислоты, острую фазу, сыворотку и иммунный фактор NFkB.[22][23][24] Наличие такого большого количества регуляторных последовательностей предполагает, что регуляция его экспрессии очень сложна.
ApoD был идентифицирован у 6 видов млекопитающих, а также у кур,[25][26] плодовые мошки,[27] растения[28] и бактерии.[29] У людей, обезьян, кроликов и морских свинок ApoD сильно экспрессируется в нервной системе (головном мозге, мозжечке и периферических нервах). В остальном уровни экспрессии ApoD в значительной степени варьируются от органов к органам и от вида к виду, при этом люди демонстрируют наиболее разнообразную экспрессию ApoD, а мыши и крысы почти исключительно экспрессируют ApoD в нервной системе (см. Фиг. 2).
Концентрация ApoD в плазме человека колеблется от 5 до 23 мг / 100 мл.[30] В нервной системе мРНК ApoD экспрессируется фибробластами, астроцитами и олигодендроцитами.[31][32][33] Как гликопротеин с пептидным сигналом секретируется ApoD. Однако его также можно активно реинтернализировать. Трансмембранный гликопротеин Basigin (BSG; CD147) был идентифицирован как рецептор ApoD.[34] BSG представляет собой рецептор мембранного гликопротеина, член семейства иммуноглобулинов, участвующий в нескольких патологиях, таких как рак и болезнь Альцгеймера.[35]
Модуляция экспрессии ApoD
Исследования нескольких типов клеток показали, что экспрессия ApoD может быть вызвана несколькими стрессовыми ситуациями, такими как остановка роста, старение, окислительные и воспалительные стрессы.[23][24] Экспрессия ApoD также увеличивается при некоторых невропатологиях. Экспрессия ApoD модулируется при нескольких патологиях, таких как семейный дефицит ЛПВП, болезнь Танжера,[36][37] Семейный дефицит LCAT[38] и диабет 2 типа.[39] Он сверхэкспрессируется при многочисленных раковых заболеваниях,[40] включая грудь,[41][42] яичник, простата,[43] кожа[44][45] и рак центральной нервной системы (ЦНС). Во многих случаях его экспрессия коррелирует с высокодифференцированным, неинвазивным и неметастатическим состоянием.
Роль ApoD в метаболизме липидов была идентифицирована в исследовании на трансгенных (Tg) мышах, сверхэкспрессирующих человеческий ApoD в ЦНС.[46] У этих мышей медленно развивается стеатоз печени и мышц, сопровождающийся инсулинорезистентностью. Однако ни у одной из мышей Tg не развивается ожирение или диабет. Накопление липидов, индуцированное ApoD, происходит не из-за липогенеза de novo, а скорее из-за повышенного поглощения липидов в ответ на избыточную продукцию простагландинов.[47]
Уровни ApoD в плазме значительно снижаются при нормальной неосложненной беременности. ApoD дополнительно снижается у женщин с избыточным увеличение веса во время беременности и их новорожденные. У этих женщин концентрация ApoD была тесно связана с параметрами липидов.[48] У женщин с морбидным ожирением (ИМТ более 40) в жировой ткани экспрессия белка ApoD положительно коррелирует с параметрами метаболического здоровья. Самки мышей с отсутствием ApoD (мыши, у которых ген ApoD был инактивирован) демонстрируют прогрессирующее (до 50%) уменьшение объема кости. со старением.[49]
ApoD и нервная система
Уровни белка как ApoD, так и аполипопротеина E (ApoE) резко увеличиваются в месте регенерации после повреждения нервной системы у крысы.[50][51] Аналогичные наблюдения были сделаны на кроликах, мартышках и мышах.[52] Повышенные уровни ApoD наблюдались в спинномозговой жидкости, гиппокампе и коре головного мозга пациентов с болезнью Альцгеймера, цереброваскулярным заболеванием, заболеванием двигательных нейронов, менингоэнцефалитом и инсультом.[53] Экспрессия ApoD изменяется в плазме и при вскрытии головного мозга больных шизофренией.[54] У пациентов с болезнью Паркинсона или с рассеянным склерозом экспрессия ApoD сильно повышена в глиальных клетках черной субстанции.[55][56]
Тип С Ниманна-Пика (NPC) - это генетическое заболевание, влияющее на транспорт холестерина, которое сопровождается хронической прогрессирующей нейродегенерацией. В моделях NPC на животных экспрессия ApoD повышена в плазме и головном мозге.[57] У крыс экспрессия ApoD увеличивается в гиппокампе после повреждения энторинальной коры. Уровень мРНК и белка ApoD увеличивается в ипсилатеральной области гиппокампа уже через 2 дня после поражения (DPL), остается высоким в течение 10 дней и возвращается к норме после 14 DPL, периода, который считается необходимым для полной реинервации.[58] Сходные результаты получены после инъекции каиновой кислоты, аналога глутаминовой кислоты, которая вызывает тяжелое нейродегенеративное повреждение в гиппокампе.[59] или после экспериментально индуцированного ингаляции.[60][61] Экспрессия ApoD также увеличивается в стареющем мозге.[53] В целом эти данные предполагают, что ApoD играет важную роль в сохранении и защите нейронов.
Мыши Tg менее чувствительны к окислительному стрессу, вызванному паракватом, генератором свободных кислородных радикалов, и имеют пониженный уровень перекисного окисления липидов. Напротив, мыши с нулевым уровнем apoD демонстрируют повышенную чувствительность к окислительному стрессу, повышенное перекисное окисление липидов в головном мозге и нарушение двигательных и обучающих способностей. Подобные результаты наблюдались на модели дрозофилы.[62] У мышей, инфицированных человеческим коронавирусом OC43, развивается энцефалит и воспалительная демиелинизация ЦНС - заболевание, очень похожее на рассеянный склероз. Мыши Tg, инфицированные OC43, демонстрируют повышенную выживаемость по сравнению с контрольными животными.[63] Мыши Tg, получавшие каиновую кислоту, демонстрируют значительное снижение воспалительных реакций и гораздо более сильную защиту от апоптоза в гиппокампе, чем контрольные животные.[64] ApoD-нулевые мыши, скрещенные с мышами APP-PS1, мышиной моделью болезни Альцгеймера, показали 2-кратное увеличение нагрузки гиппокампа амилоидными бляшками. Напротив, потомство мышей Tg, скрещенных с мышами APP-PS1, демонстрировало снижение нагрузки гиппокампа бляшками на 35% и снижение уровней амилоидного пептида на 35-65%.[65]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000189058 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000022548 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Драйна Д.Т., Маклин Дж. В., Вион К. Л., Трент Дж. М., Драбкин Г. А., Лаун Р. М. (июнь 1987 г.). «Ген аполипопротеина D человека: последовательность гена, локализация в хромосоме и гомология суперсемейства альфа 2u-глобулинов». ДНК. 6 (3): 199–204. Дои:10.1089 / dna.1987.6.199. PMID 2439269.
- ^ Драйна Д., Филдинг С., Маклин Дж., Баер Б., Кастро Дж., Чен Е. и др. (Декабрь 1986 г.). «Клонирование и экспрессия кДНК человеческого аполипопротеина D». Журнал биологической химии. 261 (35): 16535–9. PMID 3453108.
- ^ а б "Энтрез Ген: APOD аполипопротеин D".
- ^ а б c Маффат Дж., Уокер Д.В. (январь 2010 г.). «Аполипопротеин D: обзор его роли в старении и возрастных заболеваниях». Клеточный цикл. 9 (2): 269–73. Дои:10.4161 / cc.9.2.10433. ЧВК 3691099. PMID 20023409.
- ^ Эйро Жарриер М., Леви Дж., Полоновски Дж. (Август 1963 г.). «[Исследование альфа-липопротеинов сыворотки крови с помощью иммуноэлектрофореза]». Bulletin de la Société de Chimie Biologique. 45: 703–13. PMID 14051455.
- ^ МакКонати WJ, Алаупович P (февраль 1976 г.). «Исследования по выделению и частичной характеристике аполипопротеина D и липопротеина D из плазмы человека». Биохимия. 15 (3): 515–20. Дои:10.1021 / bi00648a010. PMID 56198.
- ^ а б Peitsch MC, Богуски MS (февраль 1990 г.). «Является ли аполипопротеин D белком, связывающим билин млекопитающих?». Новый биолог. 2 (2): 197–206. PMID 2083249.
- ^ Эйхингер А., Насрин А., Ким Х. Дж., Скерра А. (октябрь 2007 г.). «Структурное понимание двойной лигандной специфичности и режима ассоциации липопротеинов высокой плотности аполипопротеина D». Журнал биологической химии. 282 (42): 31068–75. Дои:10.1074 / jbc.M703552200. PMID 17699160. S2CID 9647650.
- ^ Braesch-Andersen S, Beckman L, Paulie S, Kumagai-Braesch M (декабрь 2014 г.). «ApoD опосредует связывание HDL с LDL и с растущей карциномой T24». PLOS ONE. 9 (12): e115180. Bibcode:2014PLoSO ... 9k5180B. Дои:10.1371 / journal.pone.0115180. ЧВК 4267786. PMID 25513803.
- ^ Перлман WH, Guériguian JL, Sawyer ME (август 1973). «Специфический прогестерон-связывающий компонент жидкости кисты груди человека». Журнал биологической химии. 248 (16): 5736–41. PMID 4723913.
- ^ Леа О.А. (октябрь 1988 г.). «Связывающие свойства прогестерон-связывающего белка Cyst, PBCP». Стероиды. 52 (4): 337–8. Дои:10.1016 / 0039-128x (88) 90135-3. PMID 3250014. S2CID 26492300.
- ^ Мораис Кабрал Дж. Х., Аткинс Г. Л., Санчес Л. М., Лопес-Боадо Ю. С., Лопес-Отин С., Сойер Л. (июнь 1995 г.). «Арахидоновая кислота связывается с аполипопротеином D: влияние на функцию белка». Письма FEBS. 366 (1): 53–6. Дои:10.1016 / 0014-5793 (95) 00484-кв. PMID 7789516. S2CID 9063157.
- ^ Кюль Ф.А., младший; Иган, Р.В. (28 ноября 1980 г.). «Простагландины, арахидоновая кислота и воспаление». Наука. 210 (4473): 978–84. Bibcode:1980Sci ... 210..978K. Дои:10.1126 / science.6254151. PMID 6254151.
- ^ Пател Р.К., Ланге Д., МакКонати В.Дж., Пател Ю.С., Пател С.К. (июнь 1997 г.). «Исследование структуры полости связывания лигандов липокалинов методом флуоресцентной спектроскопии». Белковая инженерия. 10 (6): 621–5. Дои:10.1093 / белок / 10.6.621. PMID 9278274.
- ^ Цзэн К., Шпильман А.И., Гласные Б.Р., Лейден Дж. Дж., Биман К., Прети Дж. (Июнь 1996 г.). «Человеческий подмышечный одорант переносится аполипопротеином D». Труды Национальной академии наук Соединенных Штатов Америки. 93 (13): 6626–30. Bibcode:1996PNAS ... 93.6626Z. Дои:10.1073 / пнас.93.13.6626. ЧВК 39076. PMID 8692868.
- ^ Бреустедт Д.А., Шенфельд Д.Л., Скерра А. (февраль 2006 г.). «Сравнительный анализ связывания лиганда десяти липокалинов человека». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1764 (2): 161–73. Дои:10.1016 / j.bbapap.2005.12.006. PMID 16461020.
- ^ Аппари М., Вернер Р., Вюнш Л., Карио Дж., Деметер Дж., Хиорт О. и др. (Июнь 2009 г.). «Аполипопротеин D (APOD) является предполагаемым биомаркером функции рецепторов андрогенов при синдроме нечувствительности к андрогенам». Журнал молекулярной медицины. 87 (6): 623–32. Дои:10.1007 / s00109-009-0462-3. ЧВК 5518750. PMID 19330472.
- ^ Ламберт, Дж; Провост, PR; Marcel, YL; Рассарт, Э (20 февраля 1993 г.). «Структура промоторной области гена аполипопротеина D человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1172 (1–2): 190–2. Дои:10.1016 / 0167-4781 (93) 90292-л. PMID 7916629.
- ^ а б Ду Карму, S; Séguin, D; Milne, R; Рассарт, Э (15 февраля 2002 г.). «Модуляция экспрессии мРНК аполипопротеина D и аполипопротеина E путем остановки роста и идентификации ключевых элементов в промоторе». Журнал биологической химии. 277 (7): 5514–23. Дои:10.1074 / jbc.M105057200. PMID 11711530. S2CID 45692527.
- ^ а б Ду Карму, S; Levros LC, Jr; Рассарт, Э (июнь 2007 г.). «Модуляция экспрессии и транслокации аполипопротеина D в определенных стрессовых условиях». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1773 (6): 954–69. Дои:10.1016 / j.bbamcr.2007.03.007. PMID 17477983.
- ^ Vieira, AV; Линдстедт, К; Schneider, WJ; Виейра, премьер-министр (декабрь 1995 г.). «Идентификация циркуляторного и ооцитарного птичьего аполипопротеина D». Молекулярное воспроизводство и развитие. 42 (4): 443–6. Дои:10.1002 / мрд.1080420411. PMID 8607974. S2CID 34209685.
- ^ Ганфорнина, доктор медицины; Санчес, Д.; Пагано, А; Tonachini, L; Descalzi-Cancedda, F; Мартинес, С. (январь 2005 г.). «Молекулярная характеристика и паттерн онтогенетической экспрессии гена куриного аполипопротеина D: последствия для эволюции липокалинов позвоночных». Динамика развития. 232 (1): 191–9. Дои:10.1002 / dvdy.20193. PMID 15580625. S2CID 14396229.
- ^ Санчес, Д.; Ганфорнина, доктор медицины; Торрес-Шуман, S; Спиз, SD; Лора, JM; Bastiani, MJ (июнь 2000 г.). «Характеристика двух новых липокалинов, экспрессируемых в нервной системе эмбриона дрозофилы». Международный журнал биологии развития. 44 (4): 349–59. PMID 10949044.
- ^ Френетт Шаррон, JB; Бретон, G; Бадави, М. Сархан, Ф (24 апреля 2002 г.). «Молекулярный и структурный анализ нового липокалина, вызванного температурным стрессом, из пшеницы и арабидопсиса». Письма FEBS. 517 (1–3): 129–32. Дои:10.1016 / s0014-5793 (02) 02606-6. PMID 12062422. S2CID 34705682.
- ^ Епископ, RE; Пенфолд, СС; Фрост, LS; Höltje, СП; Вайнер, Дж. Х. (29 сентября 1995 г.). «Стационарная фаза экспрессии нового липопротеина внешней мембраны Escherichia coli и его взаимосвязь с аполипопротеином D. Последствия для происхождения липокалинов». Журнал биологической химии. 270 (39): 23097–103. Дои:10.1074 / jbc.270.39.23097. PMID 7559452. S2CID 2904679.
- ^ Camato, R; Marcel, YL; Милн, RW; Люсье-Какан, S; Вич, ПК (июнь 1989 г.). "Белковый полиморфизм антигенного эпитопа аполипопротеина D плазмы человека". Журнал липидных исследований. 30 (6): 865–75. PMID 2477480.
- ^ Смит, К.М.; Газон, РМ; Уилкокс, Дж. Н. (июнь 1990 г.). «Клеточная локализация мРНК аполипопротеина D и лецитина: холестерина ацилтрансферазы в тканях макаки-резуса путем гибридизации in situ». Журнал липидных исследований. 31 (6): 995–1004. PMID 2373967.
- ^ Провост, PR; Marcel, YL; Милн, RW; Вич, ПК; Рассарт, Э (23 сентября 1991 г.). «Транскрипция аполипопротеина D происходит специфически в непролиферирующих покоящихся и стареющих культурах фибробластов». Письма FEBS. 290 (1–2): 139–41. Дои:10.1016/0014-5793(91)81244-3. PMID 1915865. S2CID 20185401.
- ^ Провост, PR; Вильнёв, L; Вич, ПК; Милн, RW; Marcel, YL; Рассарт, Э (декабрь 1991 г.). «Локализация основных сайтов транскрипции гена аполипопротеина D кролика путем гибридизации in situ». Журнал липидных исследований. 32 (12): 1959–70. PMID 1816324.
- ^ Наджиб, О; Бриссетт, L; Рассарт, Э (26 июня 2015 г.). «Интернализация аполипопротеина D - это базисно-зависимый механизм». Журнал биологической химии. 290 (26): 16077–87. Дои:10.1074 / jbc.M115.644302. ЧВК 4481210. PMID 25918162.
- ^ Iacono, KT; Браун, Алабама; Грин, Мичиган; Saouaf, SJ (декабрь 2007 г.). «Функция рецептора суперсемейства иммуноглобулинов CD147 и роль в патологии». Экспериментальная и молекулярная патология. 83 (3): 283–95. Дои:10.1016 / j.yexmp.2007.08.014. ЧВК 2211739. PMID 17945211.
- ^ Бодзиох, М; Орсо, Э; Klucken, J; Лангманн, Т; Böttcher, A; Дидерих, Вт; Дробник, З; Barlage, S; Бюхлер, К; Porsch-Ozcürümez, M; Камински, WE; Hahmann, HW; Oette, K; Rothe, G; Асланидис, C; Lackner, KJ; Шмитц, Г. (август 1999 г.). «Ген, кодирующий переносчик 1 АТФ-связывающей кассеты, мутирован при болезни Танжера». Природа Генетика. 22 (4): 347–51. Дои:10.1038/11914. PMID 10431237. S2CID 26890624.
- ^ Алаупович, П; Schaefer, EJ; МакКонати, WJ; Fesmire, JD; Брюэр HB, младший (август 1981 г.). «Концентрации аполипопротеина в плазме при семейной недостаточности аполипопротеина A-I и A-II (болезнь Танжера)». Метаболизм: клинический и экспериментальный. 30 (8): 805–9. Дои:10.1016/0026-0495(81)90027-5. PMID 6790903.
- ^ Альберс, JJ; Адольфсон, Дж; Чен, Швейцария; Мураяма, Н. Хонма, S; Аканума, Y (9 июля 1985 г.). «Дефектный фермент вызывает дефицит лецитин-холестерина ацилтрансферазы у японских родственников». Biochimica et Biophysica Acta (BBA) - липиды и липидный метаболизм. 835 (2): 253–7. Дои:10.1016/0005-2760(85)90280-2. PMID 4005283.
- ^ Бейкер, Вашингтон; Hitman, Джорджия; Хаврами, К; Маккарти, Мичиган; Рийконен, А; Туомилехто-Вольф, Э; Ниссинен, А; Туомилехто, Дж; Mohan, V; Вишванатан, М. (декабрь 1994 г.). «Полиморфизм гена аполипопротеина D: новый генетический маркер для пациентов с диабетом 2 типа в Науру и южной Индии». Диабетическая медицина: журнал Британской диабетической ассоциации. 11 (10): 947–52. Дои:10.1111 / j.1464-5491.1994.tb00252.x. PMID 7895459. S2CID 24833816.
- ^ Рю, Б; Джонс, Дж; Холлингсворт, Массачусетс; Hruban, RH; Kern, SE (1 марта 2001 г.). «Гены, специфичные для инвазии при злокачественных новообразованиях: серийный анализ сравнений экспрессии генов первичного и пассированного рака». Исследования рака. 61 (5): 1833–8. PMID 11280733.
- ^ Диес-Ица, я; Vizoso, F; Merino, AM; Санчес, Л. М.; Толивия, Дж; Фернандес, Дж; Руибал, А; Лопес-Отин, К. (февраль 1994 г.). «Экспрессия и прогностическое значение аполипопротеина D при раке груди». Американский журнал патологии. 144 (2): 310–20. ЧВК 1887137. PMID 8311115.
- ^ Søiland, H; Скаланд, I; Varhaug, JE; Kørner, H; Янссен, EA; Гудлаугссон, Э; Baak, JP; Сёрейде, Дж. А. (2009). «Совместная экспрессия рецептора эстрогена альфа и аполипопротеина D при операбельном раке груди с положительным узлом - возможное значение для выживаемости и эффекты адъювантного тамоксифена у пациентов в постменопаузе». Acta Oncologica (Стокгольм, Швеция). 48 (4): 514–21. Дои:10.1080/02841860802620613. PMID 19107621. S2CID 22404040.
- ^ Aspinall, JO; Bentel, JM; Хорсфолл, диджей; Haagensen, DE; Маршалл, VR; Тилли, WD (август 1995 г.). «Дифференциальная экспрессия аполипопротеина-D и специфического антигена простаты в доброкачественных и злокачественных тканях простаты». Журнал урологии. 154 (2 Пет 1): 622–8. Дои:10.1097/00005392-199508000-00082. PMID 7541868.
- ^ Миранда, Э; Vizoso, F; Мартин, А; Quintela, I; Корте, Мэриленд; Сеги, штат Мэн; Ордиз, я; Мерино, AM (июнь 2003 г.). «Экспрессия аполипопротеина D при кожной злокачественной меланоме». Журнал хирургической онкологии. 83 (2): 99–105. Дои:10.1002 / jso.10245. PMID 12772203. S2CID 25700567.
- ^ Запад, РБ; Харвелл, Дж; Linn, SC; Лю, CL; Прапонг, Вт; Эрнандес-Буссар, Т; Монтгомери, К. Nielsen, TO; Рубин, БП; Патель, Р. Голдблюм-младший; Браун, ПО; ван де Рейн, М. (август 2004 г.). «Апо D в опухолях мягких тканей: новый маркер протуберанской дерматофибросаркомы». Американский журнал хирургической патологии. 28 (8): 1063–9. Дои:10.1097 / 01.pas.0000126857.86186.4c. PMID 15252314. S2CID 5773777.
- ^ Ду Карму, S; Fournier, D; Mounier, C; Рассарт, Э (апрель 2009 г.). «Сверхэкспрессия человеческого аполипопротеина D у трансгенных мышей вызывает инсулинорезистентность и изменяет метаболизм липидов». Американский журнал физиологии. Эндокринология и метаболизм. 296 (4): E802-11. Дои:10.1152 / ajpendo.90725.2008. PMID 19176353.
- ^ Desmarais, F; Bergeron, KF; Рассарт, Э; Мунье, К. (апрель 2019 г.). «Сверхэкспрессия аполипопротеина D изменяет метаболизм простагландинов в печени и омега-жирных кислот во время развития невоспалительного стеатоза печени» (PDF). Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов. 1864 (4): 522–531. Дои:10.1016 / j.bbalip.2019.01.001. PMID 30630053.
- ^ Ду Карму, S; Forest, JC; Giguère, Y; Массе, А; Лафонд, Дж; Рассарт, Э (2 сентября 2009 г.). «Модуляция уровней аполипопротеина D при беременности человека и связь с увеличением веса во время беременности». Репродуктивная биология и эндокринология: RB&E. 7: 92. Дои:10.1186/1477-7827-7-92. ЧВК 3224896. PMID 19723339.
- ^ Мартино, К; Наджиб, О; Синьор, C; Рассарт, Э; Моро, Р. (сентябрь 2016 г.). «Дефицит аполипопротеина D связан с высоким метаболизмом костной ткани, низкой костной массой и нарушением остеобластической функции у старых самок мышей». Метаболизм: клинический и экспериментальный. 65 (9): 1247–58. Дои:10.1016 / j.metabol.2016.05.007. ЧВК 7094319. PMID 27506732.
- ^ Boyles, JK; Notterpek, LM; Андерсон, LJ (15 октября 1990 г.). «Накопление аполипопротеинов в регенерирующем и ремиелинизирующем периферическом нерве млекопитающих. Идентификация аполипопротеина D, аполипопротеина A-IV, аполипопротеина E и аполипопротеина A-I». Журнал биологической химии. 265 (29): 17805–15. PMID 2120218.
- ^ Boyles, JK; Notterpek, LM; Wardell, MR; Rall SC, Jr (декабрь 1990 г.). «Идентификация, характеристика и тканевое распределение аполипопротеина D у крыс». Журнал липидных исследований. 31 (12): 2243–56. PMID 2090718.
- ^ Ганфорнина, доктор медицины; Ду Карму, S; Мартинес, Э; Толивия, Дж; Наварро, А; Рассарт, Э; Санчес, Д. (15 августа 2010 г.). «ApoD, аполипопротеин, полученный из глии, необходим для функциональной целостности периферических нервов и своевременного ответа на повреждение». Глия. 58 (11): 1320–34. Дои:10.1002 / glia.21010. ЧВК 7165554. PMID 20607718.
- ^ а б Terrisse, L; Пуарье, Дж; Бертран, П.; Merched, A; Висвикис, S; Siest, G; Milne, R; Рассарт, Э (октябрь 1998 г.). «Повышенные уровни аполипопротеина D в спинномозговой жидкости и гиппокампе пациентов с болезнью Альцгеймера». Журнал нейрохимии. 71 (4): 1643–50. Дои:10.1046 / j.1471-4159.1998.71041643.x. PMID 9751198. S2CID 24675226.
- ^ Томас, EA; Дин, B; Пэйви, G; Сатклифф, Дж. Г. (27 марта 2001 г.). «Повышенный уровень аполипопротеина D в ЦНС у больных шизофренией и биполярным расстройством: последствия для патофизиологии психических расстройств». Труды Национальной академии наук Соединенных Штатов Америки. 98 (7): 4066–71. Bibcode:2001PNAS ... 98.4066T. Дои:10.1073 / pnas.071056198. ЧВК 31180. PMID 11274430.
- ^ Рейндл, М; Книппинг, G; Wicher, I; Дилитц, Э; Яйцо, R; Deisenhammer, F; Бергер, Т. (1 октября 2001 г.). «Повышенная интратекальная продукция аполипопротеина D при рассеянном склерозе». Журнал нейроиммунологии. 119 (2): 327–32. Дои:10.1016 / s0165-5728 (01) 00378-2. PMID 11585636. S2CID 24583456.
- ^ Ордоньес, К. Наварро, А; Перес, К; Astudillo, A; Мартинес, Э; Толивия, Дж. (Апрель 2006 г.). «Экспрессия аполипопротеина D в черном веществе болезни Паркинсона». Гистология и гистопатология. 21 (4): 361–6. Дои:10.14670 / HH-21.361. PMID 16437381.
- ^ Йошида, К; Кливленд, ES; Нэгл, JW; Французский, S; Yaswen, L; Ohshima, T; Брэди, RO; Пентчев П.Г .; Кулькарни, А.Б. (октябрь 1996 г.). «Молекулярное клонирование гена аполипопротеина D мыши и его повышенная экспрессия в модели мышей с болезнью Ниманна-Пика типа C». ДНК и клеточная биология. 15 (10): 873–82. Дои:10.1089 / dna.1996.15.873. PMID 8892759.
- ^ Terrisse, L; Séguin, D; Бертран, П.; Пуарье, Дж; Milne, R; Рассарт, Э (18 июня 1999 г.). «Модуляция экспрессии аполипопротеина D и аполипопротеина E в гиппокампе крыс после поражения энторинальной коры». Исследование мозга. Молекулярные исследования мозга. 70 (1): 26–35. Дои:10.1016 / s0169-328x (99) 00123-0. PMID 10381540.
- ^ Онг, Вайоминг; Привет; Суреш, S; Пател, Южная Каролина (июль 1997 г.). «Дифференциальная экспрессия аполипопротеина D и аполипопротеина E в гиппокампе крысы, поврежденном каиновой кислотой». Неврология. 79 (2): 359–67. Дои:10.1016 / s0306-4522 (96) 00608-2. PMID 9200721. S2CID 11857861.
- ^ Рикхэг, М; Wieloch, T; Gidö, G; Elmér, E; Крог, М; Мюррей, Дж; Lohr, S; Горький, H; Чин, диджей; фон Шак, D; Шамлоо, М; Николич, К (январь 2006 г.). «Комплексное региональное и временное профилирование экспрессии генов в головном мозге крысы в течение первых 24 часов после экспериментального инсульта позволяет идентифицировать динамические модели экспрессии генов, вызванные ишемией, и выявлять двухфазную активацию генов в выживших тканях». Журнал нейрохимии. 96 (1): 14–29. Дои:10.1111 / j.1471-4159.2005.03508.x. PMID 16300643. S2CID 23231070.
- ^ Рикхэг, М; Дейерборг, Т; Патель, С; Ruscher, K; Велох, Т. (март 2008 г.). «Аполипопротеин D повышен в олигодендроцитах в периинфарктной области после экспериментального инсульта: влияние обогащенной среды». Журнал церебрального кровотока и метаболизма. 28 (3): 551–62. Дои:10.1038 / sj.jcbfm.9600552. PMID 17851453. S2CID 25611779.
- ^ Ганфорнина, доктор медицины; Ду Карму, S; Лора, JM; Торрес-Шуман, S; Фогель, М; Allhorn, M; Гонсалес, К. Bastiani, MJ; Рассарт, Э; Санчес, Д. (август 2008 г.). «Аполипопротеин D участвует в механизмах, регулирующих защиту от окислительного стресса». Ячейка старения. 7 (4): 506–15. Дои:10.1111 / j.1474-9726.2008.00395.x. ЧВК 2574913. PMID 18419796.
- ^ Ду Карму, S; Jacomy, H; Talbot, PJ; Рассарт, Э (8 октября 2008 г.). «Нейропротекторный эффект аполипопротеина D против человеческого энцефалита, вызванного коронавирусом OC43, у мышей». Журнал неврологии. 28 (41): 10330–8. Дои:10.1523 / JNEUROSCI.2644-08.2008. ЧВК 6671015. PMID 18842892.
- ^ Наджиб, О; Ду Карму, S; Аликашани, А; Рассарт, Э (август 2017 г.). «Сверхэкспрессия аполипопротеина D защищает мышей от нейротоксичности, вызванной каинатом». Молекулярная нейробиология. 54 (6): 3948–3963. Дои:10.1007 / s12035-016-9920-4. ЧВК 7091089. PMID 27271124.
- ^ Ли, Н; Руберу, К; Муньос, СС; Дженнер, AM; Спиро, А; Чжао, H; Рассарт, Э; Санчес, Д.; Ганфорнина, доктор медицины; Карл, Т; Гарнер, Б. (май 2015 г.). «Аполипопротеин D модулирует амилоидную патологию у мышей APP / PS1 с болезнью Альцгеймера». Нейробиология старения. 36 (5): 1820–33. Дои:10.1016 / j.neurobiolaging.2015.02.010. PMID 25784209. S2CID 15335129.
дальнейшее чтение
- Рассарт Э., Бедириан А., До Карму С., Гуинар О, Сируа Дж., Террисс Л., Милн Р. (октябрь 2000 г.). «Аполипопротеин D». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1482 (1–2): 185–98. Дои:10.1016 / S0167-4838 (00) 00162-X. PMID 11058760.
- Peitsch MC, Богуски MS (февраль 1990 г.). «Является ли аполипопротеин D белком, связывающим билин млекопитающих?». Новый биолог. 2 (2): 197–206. PMID 2083249.
- Бальбин М., Фрейе Дж. М., Фуэйо А., Санчес Л. М., Лопес-Отин С. (ноябрь 1990 г.). «Аполипопротеин D является основным белковым компонентом жидкости кисты женщин с макропузырной болезнью груди человека». Биохимический журнал. 271 (3): 803–7. Дои:10.1042 / bj2710803. ЧВК 1149635. PMID 2244881.
- Драйна Д., Скотт Дж. Д., Лаун Р. (ноябрь 1987 г.) «Множественные RFLP в локусе человеческого аполипопротеина D (APOD)». Исследования нуклеиновых кислот. 15 (22): 9617. Дои:10.1093 / nar / 15.22.9617. ЧВК 306509. PMID 2891117.
- Филдинг PE, Филдинг CJ (июнь 1980 г.). «Комплекс для переноса эфира холестерина в плазме человека». Труды Национальной академии наук Соединенных Штатов Америки. 77 (6): 3327–30. Bibcode:1980PNAS ... 77.3327F. Дои:10.1073 / pnas.77.6.3327. ЧВК 349608. PMID 6774335.
- Schindler PA, Settineri CA, Collet X, Fielding CJ, Burlingame AL (апрель 1995 г.). «Сайт-специфическое обнаружение и структурная характеристика гликозилирования лецитина белков плазмы человека: холестерин-ацилтрансфераза и аполипопротеин D с использованием масс-спектрометрии ВЭЖХ / электроспрея и последовательного переваривания гликозидазой». Белковая наука. 4 (4): 791–803. Дои:10.1002 / pro.5560040419. ЧВК 2143102. PMID 7613477.
- Ян CY, Gu ZW, Blanco-Vaca F, Gaskell SJ, Yang M, Massey JB и др. (Октябрь 1994 г.). «Структура человеческого аполипопротеина D: расположение межмолекулярных и внутримолекулярных дисульфидных связей». Биохимия. 33 (41): 12451–5. Дои:10.1021 / bi00207a011. PMID 7918467.
- Holzfeind P, Merschak P, Dieplinger H, Redl B (октябрь 1995 г.). «Слезная железа человека синтезирует мРНК аполипопротеина D в дополнение к мРНК преальбумина слезы, оба вида кодируют членов суперсемейства липокалинов». Экспериментальные исследования глаз. 61 (4): 495–500. Дои:10.1016 / S0014-4835 (05) 80145-9. PMID 8549691.
- Цзэн К., Шпильман А.И., Гласные Б.Р., Лейден Дж. Дж., Биман К., Прети Дж. (Июнь 1996 г.). «Человеческий подмышечный одорант переносится аполипопротеином D». Труды Национальной академии наук Соединенных Штатов Америки. 93 (13): 6626–30. Bibcode:1996PNAS ... 93.6626Z. Дои:10.1073 / пнас.93.13.6626. ЧВК 39076. PMID 8692868.
- Каргилл М., Альтшулер Д., Ирландия Дж., Склар П., Ардли К., Патил Н. и др. (Июль 1999 г.). «Характеристика однонуклеотидных полиморфизмов в кодирующих областях генов человека». Природа Генетика. 22 (3): 231–8. Дои:10.1038/10290. PMID 10391209. S2CID 195213008.
- Лю З., Чанг GQ, Лейбовиц С.Ф. (май 2001 г.). «Аполипопротеин D взаимодействует с рецептором лептина длинной формы: функция гипоталамуса в контроле энергетического гомеостаза». Журнал FASEB. 15 (7): 1329–31. Дои:10.1096 / fj.00-0530fje. PMID 11344130. S2CID 14390285.
- Санчес Д., Ганфорнина, доктор медицины, Мартинес С. (январь 2002 г.). «Паттерн экспрессии липокалина аполипопротеина D во время эмбриогенеза мышей». Механизмы развития. 110 (1–2): 225–9. Дои:10.1016 / S0925-4773 (01) 00578-0. PMID 11744388. S2CID 17460139.
- Махадик С.П., Хан М.М., Эванс Д.Р., Парих В.В. (ноябрь 2002 г.). «Повышенный уровень аполипопротеина D в плазме при шизофрении, ее лечение и исход». Исследование шизофрении. 58 (1): 55–62. Дои:10.1016 / S0920-9964 (01) 00378-4. PMID 12363390. S2CID 22634600.
- Strausberg RL, Feingold EA, Grouse LH, Derge JG, Klausner RD, Collins FS, et al. (Декабрь 2002 г.). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Труды Национальной академии наук Соединенных Штатов Америки. 99 (26): 16899–903. Bibcode:2002ПНАС ... 9916899М. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Desai PP, Hendrie HC, Evans RM, Murrell JR, DeKosky ST, Kamboh MI (январь 2003 г.). «Генетические вариации аполипопротеина D влияют на риск болезни Альцгеймера у афроамериканцев». Американский журнал медицинской генетики. Часть B, Нейропсихиатрическая генетика. 116B (1): 98–101. Дои:10.1002 / ajmg.b.10798. PMID 12497622. S2CID 25171300.
- Канг М.К., Камета А., Шин К.Х., Балуда М.А., Ким Х.Р., Парк Н.Х. (июль 2003 г.). «Связанные со старением гены в нормальных кератиноцитах ротовой полости человека». Экспериментальные исследования клеток. 287 (2): 272–81. Дои:10.1016 / S0014-4827 (03) 00061-2. PMID 12837283.
- Томас Е.А., Лоус С.М., Сатклифф Дж. Г., Харпер С., Дин Б., МакКлин С. и др. (Июль 2003 г.). «Уровни аполипопротеина D повышены в префронтальной коре головного мозга субъектов с болезнью Альцгеймера: не имеет отношения к экспрессии или генотипу аполипопротеина E». Биологическая психиатрия. 54 (2): 136–41. Дои:10.1016 / S0006-3223 (02) 01976-5. PMID 12873803. S2CID 46158571.
внешняя ссылка
- Аполипопротеины + D в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Прикладные исследования аполипопротеинов
- Человек Астрономическая картинка дня расположение генома и Астрономическая картинка дня страница сведений о гене в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB за UniProt: P05090 (Аполипопротеин D) в PDBe-KB.